土霉素胁迫对大豆和小麦幼苗生长的影响
2012-10-26秦俊梅卜玉山李兆君郭晋
秦俊梅,卜玉山,李兆君,郭晋
(1.山西农业大学 资源环境学院,山西 太谷030801;2.中国农业科学院农业资源与农业区划研究所 农业部植物营养与养分循环重点实验室,北京100081)
进入21世纪以来,抗生素在畜牧业、种植业,水产养殖业中得到了广泛应用。我国作为人口大国和农业大国,抗生素的总用量一直居世界“领先”地位,近年来国内抗生素年均消费量已达6000 t[1],由此导致我国抗生素对生态环境的不良影响显现出越来越严重的趋势,这也成为人们普遍关注的一个社会热点问题。在环境中,一些代谢物甚至能重新转变为最初的活性药物。未经处理的畜禽粪便年复一年地施于农田,导致了土霉素在土壤中的累积。此外,土壤中的土霉素极易在植物体内富集,富集率可高达万倍以上,并通过食物链最终作用于人体,对人体造成危害[2,3]。Ha mscher[4]研究报道,在长期施用动物排泄物的表层土壤中,土霉素最大残留量高达32.3 mg·kg-1,对农田植物的生长发育和对土壤养分的吸收产生影响。当前国内外对抗生素的研究主要集中在水体、土壤、动物性食品和蔬菜中[5~12],关于抗生素造成植物的危害研究甚少[13~15]。本文以大豆和小麦为供试作物,通过水培试验研究了不同浓度土霉素对大豆和小麦幼苗部分形态和生长发育的影响,以期为土霉素的合理使用和科学研究提供科学依据。
1 材料与方法
1.1 供试材料
供试土霉素为兽用药品(含量为99.0%),分子式为C22H24N2O9,氯化汞(Hg Cl2)和甲烯蓝(C16H18N3SCl·3 H2O)均为分析纯化学试剂。
供试作物为大豆(Gl ycine max(L.)M.)和小麦(Triticu m asetivu m L.),大豆品种为晋大74号,小麦品种为乐639号。
1.2 试验方法
选取饱满而大小均匀的大豆、小麦种子,用0.1%氯化汞溶液消毒后在室温下水培发芽。配制0 mg·L-1(CK)、5 mg·L-1、10 mg·L-1、20 mg·L-1、40 mg·L-1、80 mg·L-1系列浓度的土霉素水溶液。当种子催出白芽时,选取发芽一致的大豆、小麦幼苗均匀放置于垫有滤纸的培养皿中,每个培养皿20株,分别吸取10 mL系列浓度土霉素水溶液于不同培养皿中,4次重复,然后将培养皿置于人工气候室(25℃)中暗培养,培养期间每天用差减法补充损失的水分。
1.3 测定项目与方法
培养7天后测定大豆和小麦株高、根数和根长度及植株和根鲜重,采用甲烯蓝法测定根总吸收面积和活跃吸收面积[16]。
采用试验结果EXCEL2003和DPS9.50进行LSD显著性差异检验,α=0.05。
2 结果与分析
2.1 不同浓度土霉素对大豆、小麦幼苗根数的影响
由图1可看出,不同浓度土霉素之间大豆根数的差异达到显著水平,随着土霉素浓度的增加,大豆根数呈下降趋势,而随着土霉素浓度增加对小麦根数无影响(注:主要对小麦主根进行了统计),均为6条。这表明土霉素对大豆根数的影响大于对小麦根数的影响。小麦根数不宜作为土霉素类有机污染生态毒理学的敏感生态学指标。
2.2 不同浓度土霉素对大豆、小麦幼苗株高和根长的影响
不同浓度土霉素之间大豆和小麦株高及根长的差异均达到显著水平。随着土霉素浓度的增加,大豆株高呈下降趋势,而小麦株高浓度在0~20 mg·L-1有促进作用,20~80 mg·L-1有抑制作用(图2)。随着土霉素浓度的增加,大豆和小麦的根长都呈下降趋势(图3)。

图1 不同浓度土霉素对大豆、小麦幼苗根数的影响Fig.1 Influence of different concentration of OTC on root numbers of soybean and wheat seedlings

图2 不同浓度土霉素对大豆、小麦幼苗株高的影响Fig.2 Influence of different concentration of OTC on plantheight of soybean and wheat seedlings
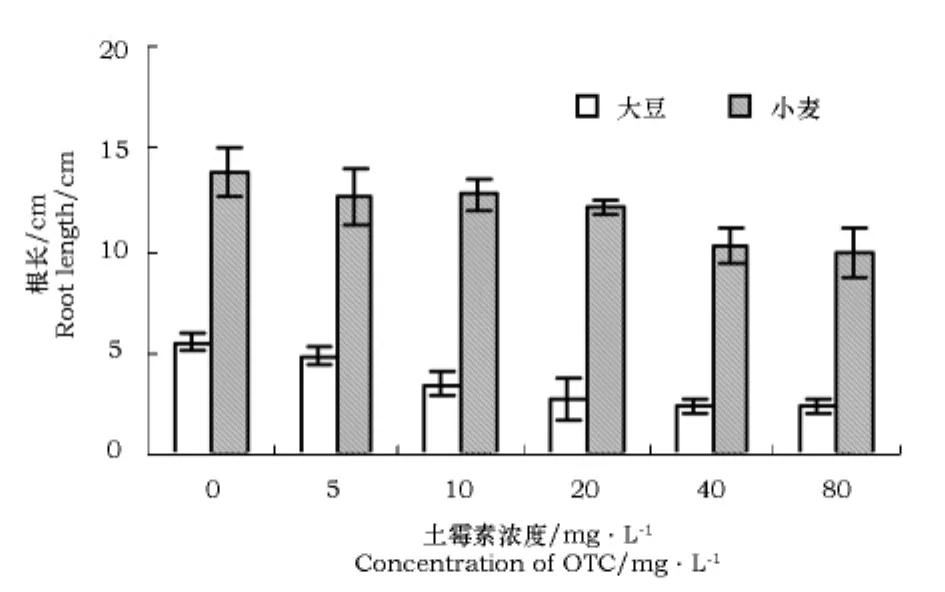
图3 不同浓度土霉素对大豆、小麦幼苗根长的影响Fig.3 Influence of different concentration of OTC on root length of soybean and wheat seedlings
2.3 不同浓度土霉素对大豆幼苗株鲜重和根鲜重的影响
不同浓度土霉素处理之间大豆株鲜重以及根鲜重的差异均达到了显著水平。随着土霉素浓度的增加,大豆株鲜重呈下降趋势,小麦株鲜重浓度在0~20 mg·L-1有促进作用,20~80 mg·L-1有抑制作用(图4),但大豆、小麦的根鲜重都是随着土霉素浓度的增加呈下降趋势(图5)。
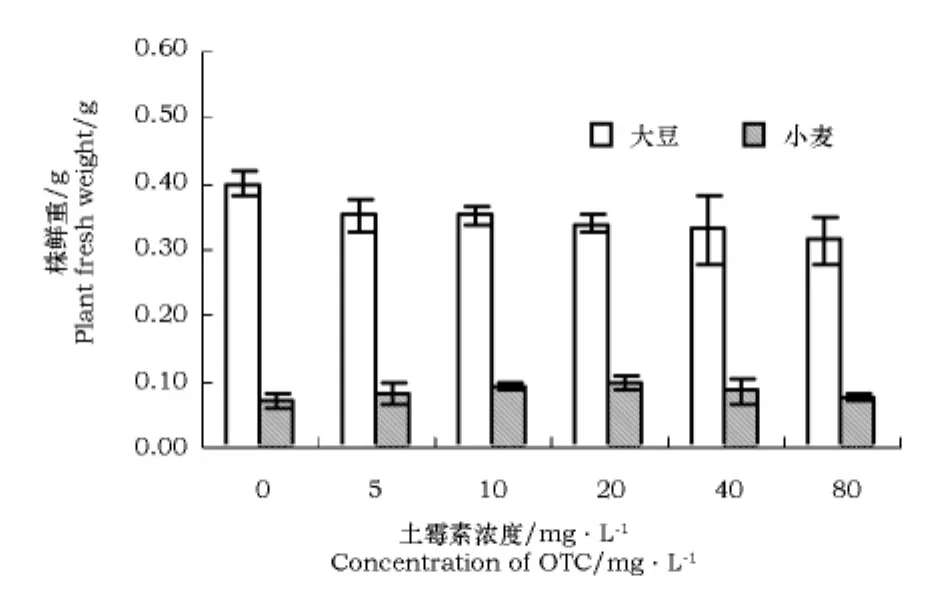
图4 不同浓度土霉素对大豆、小麦幼苗株鲜重的影响Fig.4 Influence of different concentration of OTC on plant fresh weight of soybean and wheat seedlings
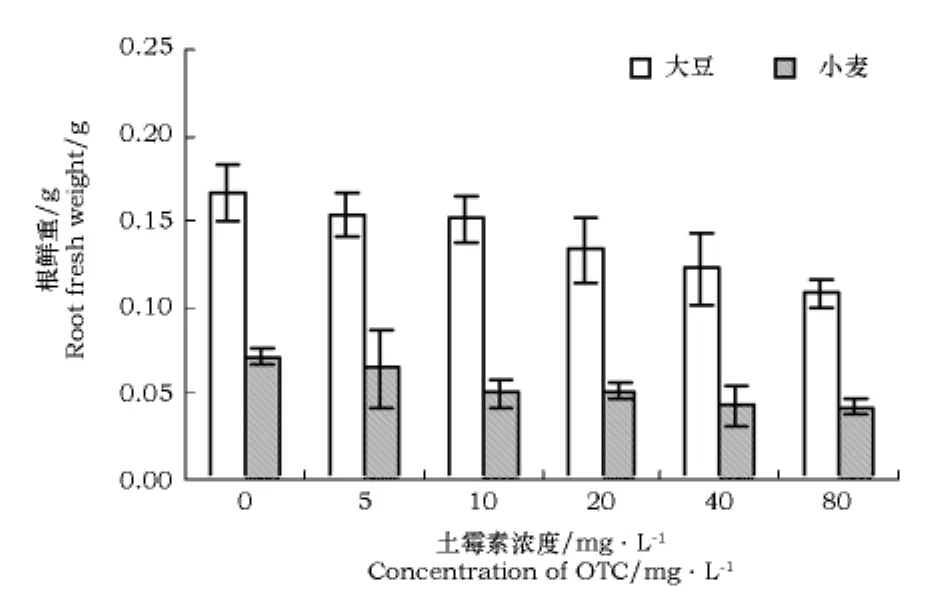
图5 不同浓度土霉素对大豆、小麦幼苗根鲜重的影响Fig.5 Influence of different concentration of OTC on root fresh weight of soybean and wheat seedlings
不同浓度土霉素之间大豆、小麦根总吸收面积和根活跃吸收面积的差异不显著。随着土霉素浓度的增加大豆、小麦根总吸收面积和根活跃吸收面积均呈下降趋势(图6、图7)。
3 结论与讨论
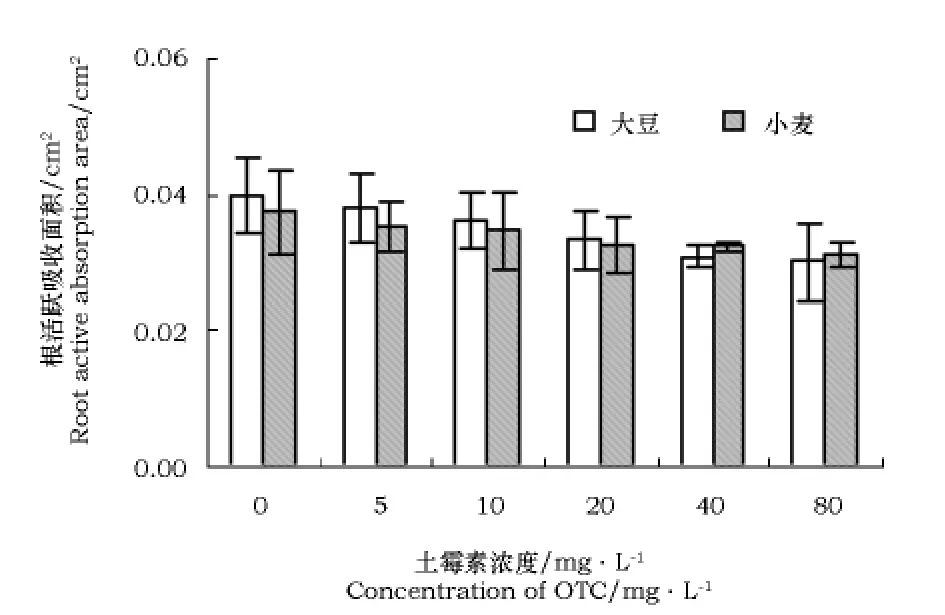
图6 不同浓度土霉素对大豆、小麦幼苗根活跃吸收面积的影响Fig.6 Influence of different concentration of OTC on root active absor ption area of soybean and wheat seedlings

图7 不同浓度土霉素对大豆、小麦幼苗根总吸收面积的影响Fig.7 Influence of different concentration of OTC on root total absor ption area of soybean and wheat seedlings
本研究结果表明,除小麦根数外,土霉素浓度的增加对大豆、小麦根长、株高、根鲜重、株鲜重和根总吸收面积以及活跃吸收面积等指标具有抑制作用,与 Kong等[17]关于土霉素能够显著抑制紫花苜蓿(Medicago sativa L.)生长的结果相似,而Boonsaner等[18]报道抗生素在土壤中降减比较快,但在水中降减比较慢,与本水培试验结果是相符合。
土霉素对大豆和小麦影响虽总体上表现为抑制作用,但低浓度土霉素对小麦株高、株鲜重起促进作用,其余测试指标与大豆一致,均随土霉素浓度增加呈下降趋势,表明二者对土霉素的反应存在差异性。本研究大豆与小麦之间的差异可能是由于小麦种子本身对透过性有机物的阻碍(防御)作用要强于大豆,也可能与种子萌发相关的酶类有关。同时,土霉素对小麦根系的影响大于对地上部,与 Migliore等[19]和 Chen 等[20]的研究结果相似,即四环素类药物在相同浓度下对植物幼苗根的抑制效应大于其它部位,这可能与四环素类药物在植物根部的蓄积量最多,因此表现出对根生长的抑制作用更为明显。
[1]候放亮.饲料添加剂应用大全[M].北京:中国农业大学出版社,2003:1-45.
[2]P A Black well,P Kay,R Ashaure,etal.Effects of agricult ural conditions on the leaching behavior of veterinary antibiotics in soil[J].Che mosphere,2009,75(2):13-19.
[3]Ku mar K,Gupta S C,Baidoo S K,etal.Antibiotic uptake by plants fr o m soil fertilized wit h ani mal manure[J].Jour nal of Environ mental Quality,2005a,34(6):2028-2085.
[4]Ha mscher G,Pawelzick H T,Hoper H.Different behavior of tetracy clines and sulf onamides in study soil after repeated fertilization wit h liquid manure[J].Envir on mental Toxicology and chemistr y,2005,24(4):861-868.
[5]Feng C,Guang G Y,Ling X K,etal.Distribution and accu mulation of endocrine-disr upting chemicals and phar maceuticals in wastewater irrigated soils in Hebei,China[J].Environ mental Pollution 2011,159:1490-1498.
[6]Hirsch R,Ter nes T,Haberer K,etal.Occurrence of antibiotics in the aquatic environ ment[J].The Science of the Total Envir on ment,1999,225:109-188.
[7]Tho mas Heberer.Tracking persistent pha maceutical residues fr o m municipal sewage to drinking water[J].Jour nal of Hydr ology,2002,266:175-189.
[8]Michael P,Schlusener,Kai Bester.Persistence of antibiotics such as macr olides,tia mulin and salino mycin in soil[J].Environ mental Poll ution,2006,143:565-571.
[9]Kay P,Black well P A,Boxall A B A,etal.Colu mn studies to investigate the fate of veterinary antibiotics in clay soils f ollo wing slurry application to agricult ural land[J].Chemosphere,2005,60:497-507.
[10]Castellari M,Gratacós-CubarsíM,García-Reg ueiro J A.Detection of tetracycline an oxytetracycline residues in pig and calf hair by ultra-high-perfor mance liquid chromatography tandem mass spectrometry[J].Journal of Chromatography A,2009,1216:8096-8100.
[11]俞道进,曾振灵,陈杖榴.土霉素残留对底泥细菌耐药性的影响[J].毒理学杂志,2005,19(3):307.
[12]Patrícia Penido Maia,Susanne Rath,Felix Guiller mo Reyes.Deter mination of oxytetracycline in tomatoes by HPLC using fluorescence detection[J].Food Chemistry,2008,109:212-218.
[13]安婧,周启星,刘维涛.土霉素对小麦种子发芽与幼苗生长发育的生态毒性[J].环境科学学报,2009,30(10):3022-3027.
[14]鲍艳宇,周启星,谢秀杰.四环素类抗生素对小麦种子芽与根伸长的影响[J].中国环境科学,2008,28(6):566-570.
[15]姚建华,牛德奎,李兆君,等.抗生素土霉素对小麦根际土壤酶活性和微生物生物量的影响[J].中国农业科学,2010,43(4):721-728.
[16]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:57-59.
[17]Kong W D,Zhu Y G,Liang Y C,etal.Uptake of oxytetracycline and its phytotoxicity to alfalfa(Medicago sativa L.)[J].Environmental Poll ution,2007,147(1):187-193.
[18]Boonsaner M,Hawker D W.Accumulation of oxytetracycline and norfloxacin from saline soil by soybeans[J].Science of the Total Environment,2010,408:1731-1737.
[19]Migliore L,Cozzolino S,Fiori M.Phytotoxicity to and uptake of enrofloxacin in crop plants[J].Hemosphere,2003,40:741-750.
[20]Chen Y,Zhaou Q X.Ecological toxicity of reactive X-3Bred dye and cad miu m acting on wheat(Triticu m aestivum)[J].Joural of Environ ment Sciences,2002,14(1):136-140.
