水酶法提取大豆油脂过程中蛋白相对分子质量变化对油脂释放的影响
2012-10-25隋晓楠江连洲齐宝坤
隋晓楠,江连洲,*,李 杨,齐宝坤,刘 雯
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.国家大豆工程技术研究中心,黑龙江 哈尔滨 150030)
水酶法提取大豆油脂过程中蛋白相对分子质量变化对油脂释放的影响
隋晓楠1,2,江连洲1,2,*,李 杨1,2,齐宝坤1,2,刘 雯1,2
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.国家大豆工程技术研究中心,黑龙江 哈尔滨 150030)
分析对比4种挤压膨化工艺和4种蛋白酶对水酶法水解挤压膨化大豆的油得率、蛋白得率的影响,并分析水解过程中蛋白相对分子质量的变化与油脂释放的关系。结果表明,Alcalase 2.4L碱性蛋白酶水解膨化大豆粉3.6h后油脂已经被充分释放出来。水解过程中油脂释放率与蛋白性质变化的分析表明,油脂释放的状态与相对分子质量大于70000的蛋白质能否被水解到相对分子质量小于5000的肽有一定的联系。水解3.5h后近90%易水解的大分子蛋白被水解为相对分子质量小于5000的肽,此时油脂已经充分释放。水解前油脂受到相对分子质量大于70000的蛋白的束缚,油脂释放不够完全。
挤压膨化;水酶法;蛋白相对分子质量;油脂释放
近些年来,由于正己烷的危害逐步被大家认识到,因此寻求一种健康的绿色提油方法的需求日益增大[1]。将挤压膨化与水酶法提取技术相结合利用从低含油的大豆中提取油脂,成为了一种替代正己烷提取油脂的绿色方法[2]。挤压膨化工艺使大豆细胞壁受到破坏,更有利于油脂释放;在高温、高压、高剪切力作用下使蛋白质的分子结构发生伸展、重组,分子表面的电荷重新分布,分子间氢键、二硫键部分断裂,导致蛋白质变性,蛋白质的消化率明显提高,通过蛋白增加表面积和蛋白变性从而更有利于酶对大豆蛋白质的作用[1-5]。挤压可增加蛋白对酶攻击的敏感性[6-7],使得在酶解后油脂释放更充分,并且减少酶解全脂豆粉后油与蛋白形成乳状物[8-9]。然而目前国外研究均在特定的挤压膨化参数条件下进行预处理后采用水酶法提取大豆油脂和蛋白[10-14],并未优化适合水酶法同时提取大豆油脂和蛋白的挤压膨化工艺参数与挤压膨化后的酶水解工艺参数,且对相关的机理研究较少。本实验针对此类问题,在通过确定适合水酶法提取的蛋白酶和酶解工艺参数的基础上,探讨大豆蛋白质水解过程中相对分子质量的变化与油脂释放的关系。
1 材料与方法
1.1 材料与试剂
大豆(农垦42号)由黑龙江省农业科学院提供,其水分含量10.6%、蛋白含量41.6%、油脂含量20.8%、灰分含量4.3% (以干物质计)。
2.4L碱性蛋白酶(2.4AU/g)、复合蛋白酶(1.5AU/g)丹麦Novo-Nodisk公司;Protex 7L中性蛋白酶(13.5AU/g)、Protex 50FP风味蛋白酶(13.5AU/g) 美国Genencor公司;木瓜蛋白酶(16~40AU/g)、蛋白标准品(牛白蛋白、蛋卵清蛋白、胰蛋白酶、溶菌酶和胰岛素酶) 美国Sigma Aldrich公司。
1.2 仪器与设备
双螺杆挤压机(由螺杆、六节套筒以及加热冷却系统组成,配有喂料、温度、压力控制系统,套筒可沿径向开合,方便物料的采集清理) 东北农业大学工程学院农产品加工实验室;DMI3000 B倒置显微镜 德国Leica公司;AKTA 100蛋白纯化仪 瑞典Amersham公司。
1.3 方法
1.3.1 挤压膨化大豆蛋白水酶法提油工艺流程
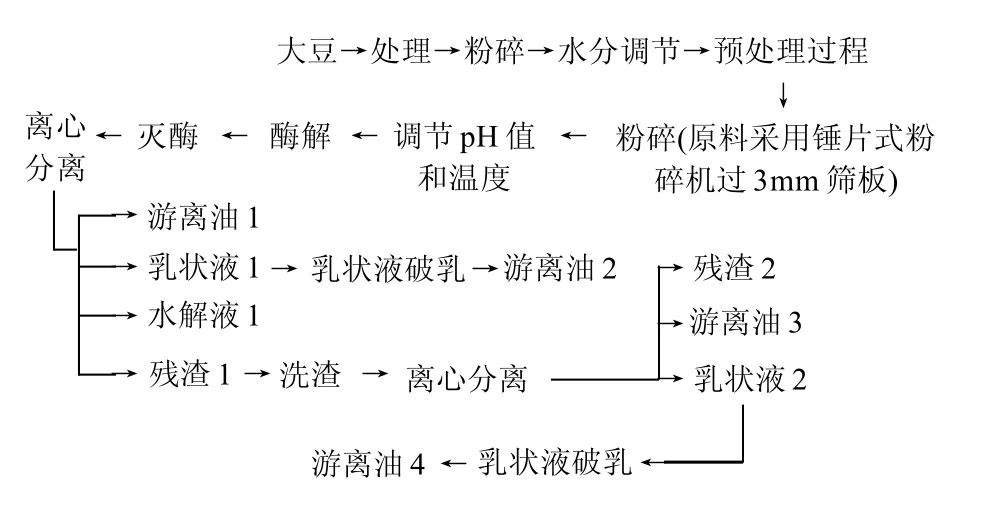
1.3.2 不同预处理步骤
干法挤压膨化的步骤为:1)大豆去壳;2)破碎大豆籽粒;3)压片,大豆片厚度为5mm;4)挤压膨化。湿法挤压膨化的步骤为:1)大豆去壳;2)破碎大豆籽粒;3)压片,大豆片厚度为5mm;4)调节物料含水率为14.5%;5)挤压膨化。湿热处理的步骤为:1)大豆去壳;2)破碎大豆籽粒;3)压片,大豆片厚度为5mm;4)用100℃水蒸气处理30min。超声波处理的步骤为:1)大豆去壳;2)粉碎大豆籽粒(粉碎后的颗粒度为0.48~1.6mm);3)超声波处理30min,300W,60℃。
1.3.3 挤压膨化工艺参数
采用双螺杆挤压机完成挤压膨化操作,具体参数为:模孔孔径20mm,螺杆转速105r/min,套筒温度90℃[15-16]。原料经锤片式粉碎机过3mm筛板处理,膨化后的膨化料再利用中药粉碎机粉碎30s作为水解原料。
1.3.4 4种酶酶法提取大豆油脂和蛋白能力的对比实验
分别研究中性蛋白酶、木瓜蛋白酶、风味蛋白酶、碱性蛋白酶以及复合蛋白酶的水酶法提取大豆油脂和蛋白的能力。在料液比为1:5,各种酶的建议pH值和酶解温度条件下(2.4L碱性蛋白酶,pH7,50℃;复合蛋白酶,pH8,50℃;Protex 7L中性蛋白酶,pH9,60℃;Protex 50FP风味蛋白酶,pH7,50℃;木瓜蛋白酶,pH4,40℃),考察不同加酶量和酶解时间对总油提取率与总蛋白提取率的影响。通过对最优加酶量和酶解时间条件下总油提取率与总蛋白提取率的对比,确定适合大豆水酶法提取油脂和蛋白的最佳蛋白酶。
1.3.5 蛋白水解过程中相对分子质量变化与油脂释放关系
1.3.5.1 蛋白质标准品的Sephadex G-75凝胶洗脱
将已知相对分子质量的标准品:牛血清白蛋白(相对分子质量66000)、卵白蛋白(相对分子质量44000)、胰蛋白酶(相对分子质量21000)、溶菌酶(相对分子质量14000)和胰岛素(相对分子质量5500)分别称取20mg,溶解于3mL pH8的磷酸盐缓冲溶液中。将5种配制好的蛋白质标准品溶液混合振荡均匀后,抽取混合液1mL加样到Sephadex G-75柱,在波长280nm处分别检测蛋白质吸光度。采用最小二乘法,根据标准品相对分子质量对数与保留时间的关系建立线性回归方程。
1.3.5.2 膨化大豆2.4L碱性蛋白酶水解产物Sephadex G-75凝胶洗脱
在挤压膨化工艺(模孔孔径20mm,物料含水率14.5%,螺杆转速105r/min,套筒温度90℃)和酶解工艺(加酶量1.85%,酶解温度50℃,酶解时间3.6h,料水比1:6,酶解pH9.26)条件下,按照不同水解时间取样品喷雾干燥。分别称取喷雾干燥后粉末20mg溶解于3mL、pH8的磷酸盐缓冲溶液中。将待测样品混合振荡均匀后,抽取1mL经0.22μm微滤膜过滤后加样到Sephadex G-75柱,在波长280nm处分别检测蛋白质吸光度。
1.3.6 指标计算方法
大豆物料以及残渣含油质量分数的测定:参考AOAC 922.06法;大豆物料以及残渣含蛋白质量分数含量的测定:参考AOAC 993.13法。按式(1)计算游离油提取率,按式(2)计算蛋白提取率。

式中:m为游离油质量;m1为大豆物料的质量;w为大豆含油质量分数;m2为残渣的质量;w1为大豆含蛋白质量分数;w2为残渣含蛋白质量分数。
2 结果与分析
2.1 预处理方法的对比分析
对比研究干法挤压膨化、湿法挤压膨化、湿热处理、超声波处理大豆蛋白后得到的游离油提取率、蛋白提取率,确定最适合水酶法提取大豆油脂和蛋白的预处理方法。

图1 不同预处理方法对游离油和蛋白提取率的影响Fig.1 Comparison of different pretreatment methods on the yield of total oil and protein
由图1可见,干法挤压膨化预处理与湿法挤压膨化预处理较其他预处理方法有较大优势。由于湿法挤压膨化预处理需蒸汽加热,其温度高、能耗大且蛋白变性严重,因此本实验确定最适合水酶法提取大豆油脂和蛋白的预处理方法为干法挤压膨化预处理方法。
2.2 水解蛋白酶种类对大豆油脂和蛋白提取率影响的对比分析

图2 中性、风味、碱性、复合以及木瓜蛋白酶对游离油和蛋白提取率的影响Fig.2 Effects of Protex 7L, Protex 50FP, Alcalase 2.4L, Protamex and Papain on the yield of oil and protein
由图2可见,利用碱性蛋白酶进行水酶法提取,游离油提取率、蛋白提取率均高于其他4种酶的水解效果。以下实验利用水酶法提取大豆油脂和蛋白工艺中均选用2.4L碱性蛋白酶。酶解工艺参数为:加酶量1.85%、酶解温度50℃、酶解时间3.6h、料水比1:6、酶解pH值 9.26。
2.3 水酶法提取过程中蛋白水解与油脂释放的关系
水解过程中利用考马斯亮蓝对蛋白质染色,苏丹红Ⅲ对脂肪球染色[17],结果见图3。
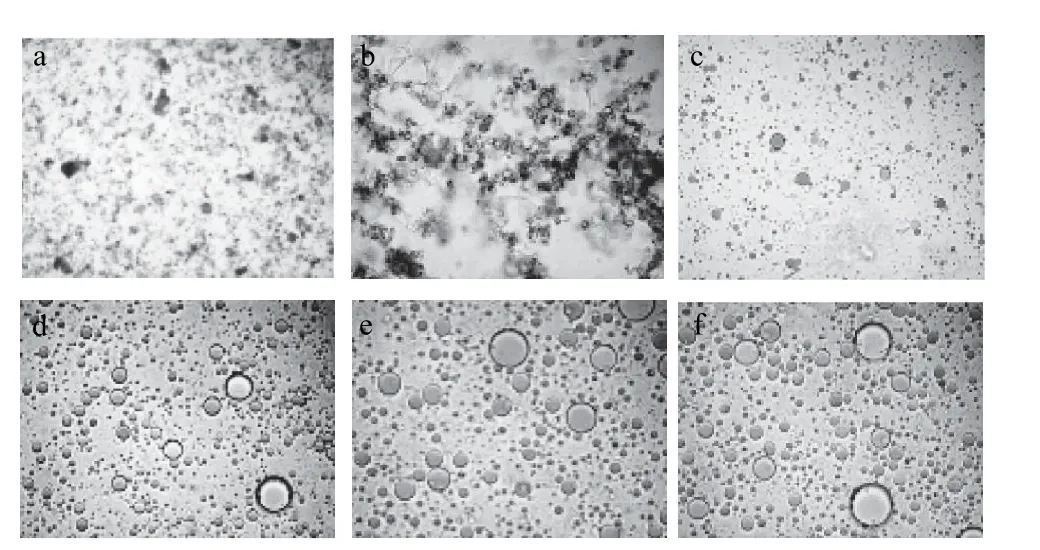
图3 大豆蛋白水解过程中油脂释放状态显微切片观察结果Fig.3 The release of oil during the hydrolysis of protein
由图3可知,未水解前体系中并无明显可见油滴存在。水解1h时,由于水解时间较短,一部分脂肪已经游离出来。水解超2h时油脂释放量增大且脂肪球聚集,但聚集后的脂肪球粒径较小。水解3h时小粒径脂肪球逐渐聚集为大粒径脂肪球,此时染色的蛋白质已经从背景中消失,说明蛋白质已经逐步被酶解为不能被染色的肽类物质。水解时间超过3.6h继续水解油滴颗粒大小已经不再变化。由此可知,挤压膨化后水酶法提取大豆油脂过程中,蛋白质的水解状态对油脂释放起到重要影响。通过对图3的观察发现,在最优水解条件下2.4L碱性蛋白酶水解干法膨化大豆3.6h后油脂释放较充分。
2.4 蛋白质水解过程中相对分子质量变化与油脂释放关系探讨
通过研究发现干法挤压膨化后水酶法提取大豆油脂过程中,蛋白质的水解状态对油脂释放有一定影响。因此针对2.4L碱性蛋白酶水解膨化大豆过程中蛋白相对分子质量的变化进行研究,并分析蛋白相对分子质量变化与油脂释放之间的关系。
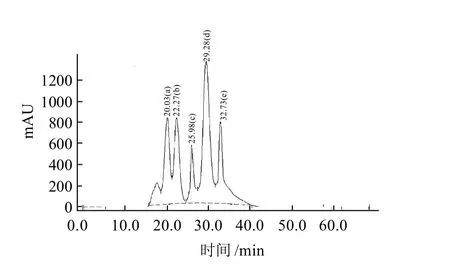
图4 蛋白质标准品的Sephadex G-75凝胶洗脱图谱Fig.4 Elution profile of protein standard sample in Sephadex G-75 gel
蛋白质标准品的Sephadex G-75凝胶洗脱图谱如图4所示。相对分子质量对数与保留时间的回归方程为:y=-0.0821x+6.4726(R2=0.9883),其中,x表示保留时间/min;y为lgMr。采用该回归方程可以根据某蛋白的保留时间估算出该物质的相对分子质量。
膨化大豆2.4L碱性蛋白酶水解产物Sephadex G-75凝胶洗脱图谱如图5所示。

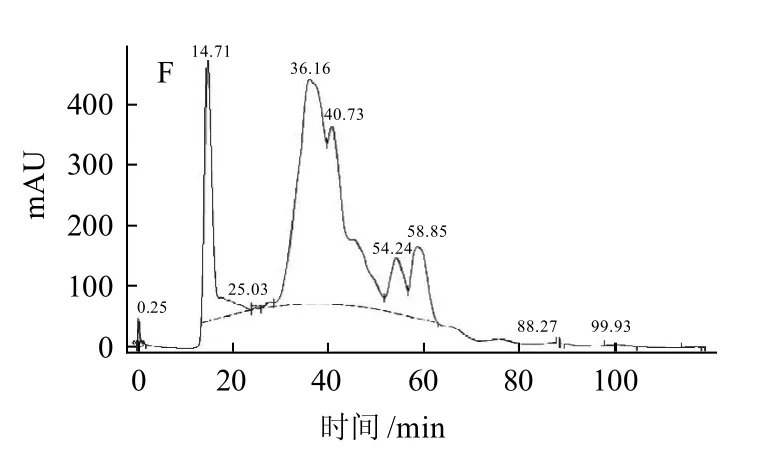
图5 膨化大豆的2.4L碱性蛋白酶水解产物Sephadex G-75凝胶洗脱图谱Fig.5 Elution profile of extruded soybean hydrolysates by Alcalase 2.4L in Sephadex G-75 gel
由图5可知,各样品洗脱谱图存在两个主峰,根据相对分子质量对数与保留时间关系的线性方程换算出各峰的相对分子质量发现,先出现的第一个主峰为相对分子质量大于70000的蛋白质,后出现的一系列峰为相对分子质量小于5000的肽,由此可知水解时间对样品相对分子质量分布的影响规律,结果见表1。

表1 酶解时间与水解蛋白相对分子质量分布的关系Table 1 Correlation between the distribution of protein molecular weights and hydrolysis time
从表1可以看出,水解过程中大豆蛋白相对分子质量的变化经过从蛋白眎到蛋白胨,最后变成小肽。随着时间的延长,样品中相对分子质量小于5000肽的百分比逐渐增大,但在水解时间大于4h后略有波动,分析可能是由于水解4h后一部分未能通过0.22μm微滤膜的蛋白被水解,导致大于70000蛋白的百分比增加,而在水解4.5h后该部分蛋白进一步水解为肽。从图5还可以看出,洗脱谱图中始终存在相对分子质量大于70000蛋白的高峰,说明膨化大豆蛋白中始终存在一些不容易被水解的蛋白成分。
由表1和图5与图3蛋白水解过程中相对分子质量变化与油脂释放状态对比可知,水解3.5h后近90%易水解的大分子蛋白质被水解为相对分子质量小于5000的肽,而此时油脂已经充分释放。由此推断,水解前油脂受到相对分子质量大于70000蛋白质的束缚,油脂不能够得到很好的释放。
3 结 论
通过对干法挤压膨化大豆水解过程的显微切片观察分析可知,挤压膨化后水酶法提取过程中,蛋白质水解与油脂释放同步进行,并且蛋白质的水解状态对油脂释放起到重要影响。2.4L碱性蛋白酶水解膨化大豆粉3.6h后油脂已经被充分释放出来。水解过程中蛋白质没有完全被水解为多肽时,油脂已经逐步从蛋白的束缚中被释放出来。水解3.5h后近90%易水解的大分子蛋白质被水解为相对分子质量小于5000的肽,此时油脂已经充分释放。经推断,水解前油脂受到相对分子质量大于70000蛋白质的束缚,油脂不能够得到很好的释放。
[1] MARLOWE I T, GIDDINGS T J, RICHARDSON S J, et al. U.K. industry and ozone pollution from volatile organic compound emissions. II. Update to October 1991, Report 878 (PA) (London: Warres Spring Laboratory, Environmental Technology Executive Agency of the Department of Trade and Industry, 1991)[J]//ROSENTHAL A, PYLE D L, NIRANJAN K. Aqueous and enzymatic processes for edible oil extraction. Enzyme and Microbial Technology, 1996, 19: 402-420.
[2] LAWRENCE J. Recovery of fats and oils from plant and animal sources [M]// O,BRIEN R D, FARR W E, WAN P J. Introduction to fats and oils technology. Boulder: AOCS Press, 2000: 108-135.
[3] CAMPBELL K, GLATZ C E. Mechanisms of aqueous extraction of soybean oil[J]. Journal of Agricultural and Food Chemistry, 2009, 57 (22): 10904-10912.
[4] BAIR C W, SNYDER H E. Ultrastructural changes in soybeans during processing to yield desolventized-toasted meal[J]. J Food Science, 2006, 45(3): 529-533.
[5] BAIR C W. Microscopy of soybean seeds: cellular and subcellular structure during germination, development, and processing with emphasis on lipid bodies[D]. Iowa American: Iowa State University, 1979.
[6] JUNG S, MAHFUZ A, MAURER D. Structure, protein interactions andin vitroprotease accessibility of extruded and pressurized full-fat soybean flakes[J]. J American Oil Chemists, Society, 2008, 86(5): 475-483.
[7] STEPHANIE J, ABDULLAH M. Low temperature dry extrusion and high-pressure processing prior to enzyme-assisted aqueous extraction of full fat soybean flakes[J]. Food Chemistry, 2009, 114(3): 947-954.
[8] LI Yang, JIANG Lianzhou, QIAO Guohua. Effect of extruding parameters on soybean oil yield of enzyme-assisted aqueous extraction processing [J]. Advanced Material Research, 2011, 148/149: 7-18.
[9] BAIR C W, SNYDER H E. Electron microscopy of soybean lipid bodies[J]. J American Oil Chemists, Society, 1980, 57(9): 279-282.
[10] de MOURA J M L N, CAMPBELL K, MAHFUZ A, et al. Enzymeassisted aqueous extraction of oil and protein from soybeans and cream de-emulsification[J]. J American Oil Chemists, Society, 2008, 85(10): 985-995.
[11] LI Yang, JIANG Lianzhou, SUI Xiaonan. The research on freeze-thaw de-emulsification technology in enzyme-assisted aqueous extraction processing[J]. Advanced Materials Research, 2011, 236/238: 2598-2609.
[12] SUI Xiaonan, JIANG Lianzhou, WANG Chen, et al. The comparison of amino acid content of the hydrolysate under extrusion pretreatment with non-extrusion pretreatment[J]. Applied Mechanics and Materials, 2011, 66/68: 702-708.
[13] SUI Xiaonan, JIANG Lianzhou, LI Yang, et al. Antioxidant activity of soybean peptides[J]. Advanced Materials Research, 2011, 233/235: 854-865.
[14] LI Yang, JIANG Lianzhou, WANG Chen, et al. The comparison of oil quality from different processes[J]. Applied Mechanics and Materials, 2011, 66/68: 598-607.
[15] LI Yang, JIANG Lianzhou, ZHANG Zhaoguo, et al. Fuzzy optimization of enzyme assistant aqueous for extracting oil and protein from extruded soybean[J]. Transactions of the CSAE, 2010, 26(2): 375-380.
[16] 江连洲, 隋晓楠, 齐宝坤, 等. 挤压膨化预处理水酶法提取大豆多肽的研究[J]. 食品科学, 2011, 32(14): 161-164.
[17] WERNER H J, CHRISTMAN J F. Chromatography and biological stains: III. comparison of the fat staining efficiency of fractions of commercial sudan III separated by column chromatography read[J]. Biotechnic & Histochemistry, 1952, 27(2): 93-96.
Effect of Molecular Weight Change on Oil Release during Enzyme-assisted Aqueous Extraction Process of Oil
SUI Xiao-nan1,2,JIANG Lian-zhou1,2,*,LI Yang1,2,QI Bao-kun1,2,LIU Wen1,2
(1. College of Food Science, Northeast Agricultural University, Harbin 150030, China;2. National Research Center of Soybean Engineering and Technology, Harbin 150030, China)
In this study, the yields of oil and protein obtained from 4 extrusion methods and enzymatic hydrolysis of four enzymes were compared. Meanwhile, the relationship between protein molecular weight and oil yield during enzyme-assisted aqueous extraction process (EAEP) was also explored. By using Alcalase 2.4L, oil was almost completely released after 3.6 h. The release of oil had an obvious correlation with molecular weight of the protein hydrolyzed from 70000 to 5000. After 3.5 h hydrolysis, 90% protein was hydrolyzed into peptide with molecular weight smaller than 5000. Oil cannot be released at the beginning of EAEP, due to the inhibition of protein with molecular weight larger than 70000.
extrusion;aqueous enzymatic extraction process;protein molecular weight;oil release
TS214.2;TS225.13
A
1002-6630(2012)05-0037-05
2011-09-09
黑龙江省科技攻关计划项目(GA09B401-6)
隋晓楠(1987—),男,硕士研究生,研究方向为粮食油脂及植物蛋白工程。E-mail:xiaonan.sui@hotmail.com
*通信作者:江连洲(1960—),男,教授,博士,研究方向为粮食油脂及植物蛋白工程。E-mail:jlzname@163.com
