常温条件下拮抗酵母菌对葡萄果实的抗性诱导研究
2012-10-25周海莲王雪强肖红梅
索 娜,周海莲,王雪强,肖红梅
(南京农业大学食品科学技术学院,江苏南京 210095)
常温条件下拮抗酵母菌对葡萄果实的抗性诱导研究
索 娜,周海莲,王雪强,肖红梅*
(南京农业大学食品科学技术学院,江苏南京 210095)
以从草莓果实上筛选的、对由灰葡萄孢(Botrytis cinerea)引起的灰霉病具有较好抑制作用的葡萄有孢汉逊酵母(Hanseniaspora uvarum)菌株为供试拮抗酵母菌,研究其对“巨峰”葡萄果实抗性的诱导。将葡萄果实分组,并分别进行喷洒和人工接入浓度为1×108cfu/mL的拮抗酵母菌悬液,常温条件下贮藏,观察果实感官品质变化,并测定抗性相关酶酶活变化。结果表明,拮抗酵母菌处理不影响果实感官品质,甚至可以较好地维持果实的感官品质;人工接入的拮抗酵母菌可以较好的诱导果实的POD、PAL、CAT、PPO及APX的酶活,而对喷洒拮抗酵母菌的整个果实可以较好的诱导POD、SOD、PAL及APX的酶活。整体而言,拮抗酵母菌可引起果实的应激反应,诱导寄主产生抗性。
葡萄有孢汉逊酵母,灰葡萄孢,酶活,抗性诱导
灰霉病是葡萄生产中最大的病害之一,发生普遍,并随着设施栽培面积的扩大而日益严重。葡萄灰霉病不仅是生产田中常见病害更是产后储藏过程中的毁灭性病害[1]。每年因灰霉病造成的葡萄产后损失最高可达50%,一般损失也达20%~30%[2]。因此,采取有效的防治方法防治葡萄灰霉病意义重大。葡萄采后灰霉病害的控制手段主要有臭氧处理[3]、化学杀菌剂[4]及生物防治[5-6]等。生物防治法(又称生物保鲜技术)具有安全、无毒、对经济友好的特点[7]。生物保鲜技术主要包括微生物菌体及其代谢产物保鲜技术、生物天然提取物保鲜技术和利用遗传基因的保鲜技术三方面。其中最受研究者重视的是微生物菌体及代谢产物保鲜技术,目前可用于拮抗的微生物种类有酵母菌、细菌、霉菌及放线菌等。酵母菌具有生长繁殖能力强、广谱抗菌性、可与化学杀菌剂相容、不产生对人体有害的代谢物质等优点[8-9],是拮抗微生物中最受关注的拮抗菌。目前,用于防治的常用拮抗酵母菌有毕赤酵母(Pichia membranifactien)[10]、粘红酵母(Rhodotorula glutinis)[8-9]、罗伦隐球酵母(Cryptococcus laurentii)[11]等。但拮抗酵母菌对果蔬采后病害的防治效力与化学杀菌剂相比仍有较大的差距,大部分拮抗酵母菌的使用都处于实验阶段。为了实现拮抗酵母菌的商业化应用,深入研究拮抗酵母菌的抑制机理显得至关重要。本文选择实验室筛选出的对果蔬采后灰霉病具有较好抑制效果的葡萄有孢汉逊酵母作为研究主体,通过测定过氧化物酶(peroxidase,POD)、超氧化物歧化酶(superoxide dismutase,SOD)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、过氧化氢酶(catalase,CAT)、苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)和多酚氧化酶(polyphenol oxidase,PPO)六种抗性相关酶的酶活变化,探讨常温条件下拮抗酵母菌对果实抗性的诱导,为拮抗酵母的生物防治应用提供技术支持。
1 材料与方法
1.1 材料与仪器
1.1.1 供试菌株
1.1.1.1 拮抗酵母菌 由本实验室分离自草莓果实,经过纯化鉴定为葡萄有孢汉逊酵母(Hanseniaspora uvarum)菌株,保持在4℃的马铃薯葡萄糖琼脂培养基(potato dextrose agar medium,PDA)斜面上。使用时用无菌接种环从斜面上取一环菌种划线于PDA平板上,28℃下恒温培养2d活化。
1.1.1.2 拮抗酵母菌悬浮液制备 用无菌接种环取一环活化后的菌种于装有100m L马铃薯葡萄糖液体培养基(potato dextrose brothrmedium,PDB)的250m L三角瓶中,28℃条件下180r/min振荡培养24h。血球计数板计数后,用无菌水配制成浓度为1×108cfu/m L的菌悬液,备用。
1.1.1.3 病原菌 灰葡萄孢霉,实验室储藏菌种。保持在4℃的马铃薯琼脂培养基(PDA)斜面上。使用时用无菌接种环从斜面上取一环菌种划线于PDA平板上,23℃恒温培养7d活化。
1.1.1.4 病原菌孢子悬浮液制备 用无菌接种环取灰葡萄孢霉菌丝接种于PDA培养基平板上,23℃培养7d后,将少量无菌水注入平板中,用接种环轻轻刮下孢子,充分振荡后用八层无菌纱布进行过滤取其滤液。用无菌水制备成1×105spore/m L的灰葡萄孢霉孢子悬液,备用。
1.1.2 供试果实 葡萄 清晨采摘于南京江心洲葡萄园,选择大小一致、无病虫害、无机械损伤、成熟度相似的“巨峰”葡萄。
1.1.3 培养基
1.1.3.1 马铃薯葡萄糖琼脂培养基(PDA) 取新鲜去皮马铃薯200g切成小块,加水煮沸30m in,四层纱布过滤后,补充自来水,使滤液体积为1000m L,向滤液中加入20g葡萄糖和15~20g琼脂,玻棒搅拌,溶解后分装,于121℃湿热灭菌30m in后存放备用。
1.1.3.2 马铃薯葡萄糖液体培养基(PDB) 不加琼脂的PDA培养基,于121℃湿热灭菌30m in后存放备用。
1.1.4 主要仪器 MC高速冷冻离心机 湘仪仪器;旋转蒸发仪 德国Heidolph;紫外可见分光光度计北京莱伯泰科仪器有限公司;SW-CJ-ID型单人净化工作台 苏州净化;光学显微镜 尼康有限公司;HVE-50自动灭菌锅 HIRAYAMA有限公司;SPX-150B-I型生化培养箱 上海博迅实业有限公司医疗设备厂;HZQ-F160全温振荡培养箱 太仓市实验设备厂;恒温恒湿培养箱 宁波海曙赛福实验仪器厂;HH-6数显恒温水浴锅 国华电器有限公司。
1.2 处理方法
以葡萄果实为寄主,在常温条件下研究人工接种拮抗酵母菌与病原菌及喷洒拮抗酵母菌对葡萄果实抗性的诱导。将新鲜果实用2%NaClO溶液浸泡2m in,再用蒸馏水冲洗干净,常温下晾干并随机分为4组,每组300个,备用。
打孔组:用无菌打孔器在果实腰部打大小为4mm(宽)×4mm(深)、相距1cm的两个孔,形成伤口系统,常温下晾干,一个孔内接入10μL 1×108cfu/m L拮抗酵母菌菌悬液,另一孔内接入10μL 1×105spore/m L病原菌孢子悬液。
打孔对照组:用无菌打孔器在果实腰部打大小为4mm(宽)×4mm(深)、相距1cm的两个孔,形成伤口系统,常温下晾干,一个孔内接入10μL无菌水,另一孔内接入10μL 1×105spore/m L病原菌孢子悬液。
喷洒组:用1×108cfu/m L拮抗酵母菌菌悬液喷洒整个葡萄果实。
喷洒对照组:用无菌水喷洒整个葡萄果实。
将4组果实常温晾干,装入套有保鲜袋的水果框内,25℃贮藏。每隔24h观察葡萄果实感官品质变化,测定POD、SOD、PAL、CAT、PPO、APX的酶活。
1.3 感官品质观察
肉眼观察葡萄果实表面颜色、病斑直径,并用手触摸葡萄果实感知其硬度的变化,评定经不同处理后果实的感官品质,从而从感官品质的变化了解拮抗酵母菌处理果实的效果。
1.4 酶活测定方法
1.4.1 POD、SOD、APX、CAT酶活测定 从3颗去皮的葡萄上称取1.5g葡萄果肉,放入预冷的研钵中,加入3m L 50mmol/L pH 7.8磷酸盐缓冲液(1%PVP),冰水中研磨至匀浆,移至10m L离心管中,再加5m L缓冲液冲洗并移至移液管中,在4℃10000r/m in下冷冻离心15m in,取上清液为酶液,4℃冰箱中保存,备用。每个处理取4个样。
POD活性测定:采后愈创木酚法[12],以每分钟在460nm处吸光值变化0.001为1个活性单位。
SOD活性测定:采用NBT光还原法[13],以抑制反应50%为一个酶活力单位。
CAT活性测定:参照范冬梅等[14]的方法,以反应液每分钟在240nm处吸光值变化0.001为一个酶活单位。
APX活性测定:参照Nakano等[15]方法进行,以每分钟反应液在290nm处吸光值变化0.001为1个酶活力单位。
1.4.2 PPO、PAL酶活测定 PPO酶液提取:从3颗葡萄上称取1.5g去皮葡萄果肉,放入预冷的研钵中,加入0.2mol/L pH 6.8磷酸氢二纳-柠檬酸缓冲液,冰水中研磨至匀浆,移至10m L离心管中,再加5m L缓冲液冲洗并移至移液管中,在4℃10000r/m in下冷冻离心15min,取上清液为酶液,4℃冰箱中保存,备用。每个处理取4个样。
PPO活性测定:采用邻苯二酚比色法测定[16],以反应液每分钟在398nm处吸光值变化0.001为1个酶活力单位。
PAL酶液提取:从3颗葡萄上称取1.5g去皮葡萄果肉,放入预冷的研钵中,加入硼酸缓冲液(0.1mol/L pH 8.8),冰水中研磨至匀浆,移至10m L离心管中,再加5m L缓冲液冲洗并移至移液管中,在4℃10000r/m in下冷冻离心15min,取上清液为酶液,4℃冰箱中保存,备用。每个处理取4个样。
PAL活性测定:取甲、乙两支试管,分别加入硼酸缓冲液(0.1mol/L,pH 8.8)3m L和苯丙氨酸1m L(0.02mol/L),甲试管加入1m L粗酶液,乙试管以1m L硼酸缓冲液作为空白对照。反应液于37℃恒温水浴中保温60m in,立即加入0.2m l 6mol/L HCI溶液终止酶促反应。随后在290nm处测定吸光值,以每分钟吸光值变化0.001为一个酶活性单位。
1.5 数据分析
采用SAS软件,所有实验数据用One-way ANOVA进行Duncan方差分析。
2 结果与分析
2.1 对果实感官品质的影响
果实的感官品质评定如表1所示。

表1 葡萄果实的感官品质评定Table 1 Organoleptic quality of grape fruits evaluation
由表1可以看出,拮抗酵母菌处理对葡萄果实的感官品质影响较小,但还是起到了一定的作用。因此,可以得出结论:拮抗酵母菌处理可以较好的保持葡萄果实的感官品质。
2.2 对POD酶活的影响

图1 拮抗酵母菌对葡萄果实伤口系统及整个果实的POD抗性酶活的诱导Fig.1 Effectof H.uvarum on POD activity of the inoculated and the whole grape fruit
如图1所示,葡萄有孢汉逊酵母可以诱导整个葡萄果实的POD活性增加,人工接入拮抗酵母菌也可以诱导POD活性的增加。喷洒组在前2d的POD活性与对照组的活性没有显著性差异(p<0.05),但第3d以后活性显著高于对照组的活性。打孔组的果实POD活性一直显著高于对照组的活性。对于四个组别,POD活性在贮藏过程中整体上呈现先上升后下降的趋势。在第1d,打孔组别果实的POD活性远远大于喷洒组的POD活性,同时喷洒组及其对照组的峰值出现在第3d,而打孔组的峰值出现在第2d,且打孔的两组果实的POD活性下降速度大于喷洒的两组。分析上述现象的原因可能为:打孔组别对果实进行了破坏,在同样贮藏条件下,衰老腐烂速度大于喷洒组的果实,因此导致其POD的峰值比喷洒组的提前1d,而且下降速度偏大。
2.3 对SOD酶活的影响

图2 拮抗酵母菌对葡萄果实伤口系统及整个果实的SOD抗性酶活的诱导Fig.2 Effectof H.uvarum on SOD activity of the inoculated and the whole grape fruit
如图2所示,所有组别果实的SOD活性都呈下降趋势,而且打孔组的果实SOD活性下降速度高于喷洒组别果实活性下降速度。进行显著性差异分析可以得出:在整个储藏过程中,葡萄有孢汉逊酵母可以一直显著诱导葡萄整个果实SOD活性,而对人工接入拮抗酵母菌的打孔组果实的SOD活性诱导不显著,打孔组与打孔对照组仅在第2和第4d存在显著性差异。
2.4 对APX酶活的影响
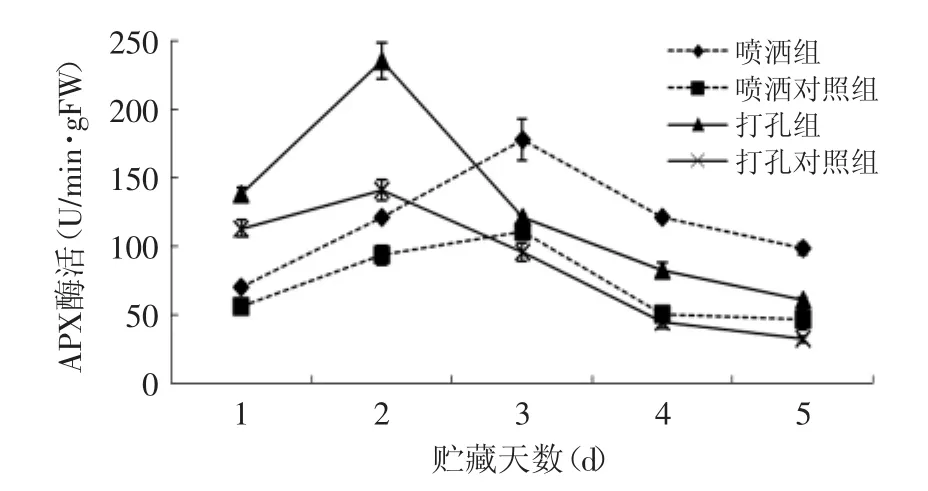
图3 拮抗酵母菌对葡萄果实伤口系统及整个果实的APX抗性酶活的诱导Fig.3 Effectof H.uvarum on APX activity of the inoculated and the whole grape fruit
如图3所示,葡萄有孢汉逊酵母可以诱导喷洒组别葡萄果实的APX活性增加,人工接入拮抗酵母菌也可以诱导果实APX活性的增加。对于喷洒组别,在第1d,喷洒组的APX活性与对照组的活性没有显著性差异(p<0.05),但第2d以后活性显著高于对照组的活性。对于打孔果实组别,APX的活性一直显著高于对照组的活性。在整个贮藏过程中四个组别果实的APX活性在整体上均呈先上升后下降的趋势,喷洒组及其对照组的峰值出现在第3d,而打孔组别的峰值出现在第2d,同时活性下降速度大于喷洒组。APX活性变化在整体上与POD活性变化相同。分析打孔组别酶活下降速度大于喷洒组别,可能原因为:打孔组别对果实进行了破坏,导致其衰老腐烂加快,而打孔组别峰值提前1d出现也可能是因为打孔伤口造成的。
2.5 对CAT酶活的影响

图4 拮抗酵母菌对葡萄果实伤口系统及整个果实的CAT抗性酶活的诱导Fig.4 Effectof H.uvarum on CAT activity of the inoculated and the whole grape fruit
如图4所示,所有组别果实的CAT活性都呈下降趋势,而且打孔组别的果实CAT活性下降速度高于喷洒的整个果实CAT活性下降,喷洒组别果实的CAT活性始终维持在比较平稳的状态。进行显著性差异分析可以得出:葡萄有孢汉逊酵母在整体上没有显著性的诱导葡萄整个果实CAT活性的增加,但人工接入拮抗酵母菌在前2d可以显著性诱导CAT活性,随着贮藏时间的延长,实验组与对照组之间不存在显著性差异。CAT的活性变化在整体上与上述SOD的活性变化相同。
2.6 对PAL酶活的影响

图5 拮抗酵母菌对葡萄果实伤口系统及整个果实的PAL抗性酶活的诱导Fig.5 Effectof H.uvarum on PAL activity of the inoculated and the whole grape fruit
如图5所示,所有组别果实的PAL活性都呈先上升后下降的趋势,其中前3d PAL活性比较稳定,第4d时所有组别活性急剧上升,尤其是喷洒组及打孔组,两者的对照组上升趋势相对缓慢。第4d之后,所有组别PAL活性开始下降,喷洒组的下降速度大于打孔组的果实下降速度。差异性分析结果显示:喷洒组及其对照组在第1d时不存在差异性,但是第2d以后均存在显著性差异,到第4d时差异性已达到极显著(p<0.01);而打孔的两个组别在前4d均存在显著性差异,第5d时不存在显著性差异。
2.7 对PPO酶活的影响
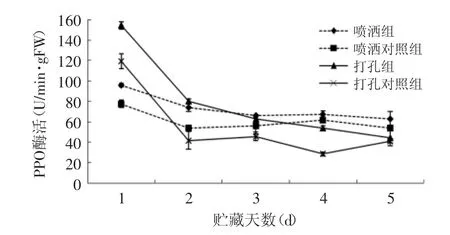
图6 拮抗酵母菌对葡萄果实伤口系统及整个果实的PPO抗性酶活的诱导Fig.6 Effect of H.uvarum on PPO activity of the inoculated and the whole grape fruit
如图6所示,所有组别的PPO活性呈下降趋势,打孔组别PPO活性的下降速度大于喷洒,其原因为打孔组的果实上打有两孔,加快葡萄果实的衰老腐烂。显著性差异分析结果显示:喷洒组与其对照组在前2d存在显著性差异,但到第3d两组之间没有显著性差异;而打孔组别的两个组的酶活下降速度较快,但其显著性差异一直维持到第4d结束,到第5d时,两组之间没有差异性。
3 讨论与结论
POD、SOD、APX、CAT、PAL、PPO等酶是与植物抗病性有关的酶类,酶活的高低是植物抗病性强弱的一个重要生理特征[17]。植物在光合作用及受到逆境胁迫时会产生大量的氧自由基,大量氧自由基的积累会引起膜脂的过氧化、膜蛋白发生聚合等反应,从而使生物膜的功能与结构受到严重破坏,损伤植物细胞及机体[18]。提高植物体内氧自由基代谢途径的酶活力,可以使植物的抗氧化胁迫的能力增强。植物体内可以消除氧自由基的酶包括SOD、POD、CAT、APX等[19],它们相互协同作用可以保证寄主细胞内的氧化还原平衡,从而增强寄主的抗病性,延缓或阻止寄主细胞的衰老或死亡[20]。长期以来,PPO一直被认为是引起果蔬果实采后褐变的主要因素之一,同时可以通过形成醌类物质直接发挥抗病作用[21]。PAL是苯丙氨酸代谢的首要关键酶,与植物抗毒素的合成密切相关[22]。因此很多研究者研究果蔬果实这些酶活的变化来研究保鲜方法保鲜果蔬的机制[23-25]。
在研究常温条件下葡萄有孢汉逊酵母对葡萄果实抗性诱导的实验中,将拮抗酵母菌喷洒在整个果实上以及与灰葡萄孢一起人工接入葡萄果实上。其中将拮抗酵母与灰葡萄孢分别接入不同的伤口孔,是为了消除拮抗酵母菌与病原菌之间的直接相互作用而给结果带来的影响。实验结果表明:葡萄有孢汉逊酵母在较好保持果实感官品质的同时又可以显著性诱导整个果实的POD、SOD、PAL、APX酶活,但是对于CAT、PPO酶活的诱导效果不佳。而人工接入拮抗酵母菌可以显著性诱导POD、PAL、APX、CAT、PPO酶活,但对SOD酶活的诱导效果不佳。
感官品质通过观察果实颜色、病斑直径、硬度,分析描述拮抗酵母菌对果实感官品质的实际影响,结果显示,拮抗酵母菌处理对葡萄果实的感官品质影响较小。
从整体而言,在常温条件下葡萄有孢汉逊酵母可较好的保持果实的感官品质,同时可以引起果实的应激反应,诱导寄主产生抗性,从而提高果实对病原菌的抵抗能力。
[1]陈宇飞,文景芝,李立军.葡萄灰霉病研究进展[J].东北农业大学学报,2006,37(5):693-699.
[2]陈宇飞.葡萄果实抗灰霉病研究[D].哈尔滨:东北农业大学,2006.
[3]Ozkan R,Smilanick JL,Karabulut O A.Toxicity of ozone gas to conidia of Penicillium digitatum,Penicillium italicum,and Botrytis cinerea and control of gray mold on table grapes[J]. Postharvest Biology and Technology,2011,60(1):47-51.
[4]张鹏,刘长远,梁春浩,等.7种杀菌剂对葡萄灰霉病的室内抑菌活性测定[J].园艺与种苗,2012(1):61-64.
[5]李永刚,郭晓慧.枯草芽袍杆菌BS2对葡萄灰霉病菌抑菌机制的初步探索[J].微生物学通报,2010,37(5):721-725.
[6]田恩琴,常永义,朱建兰,等.2株拮抗菌的抑菌作用及产酶能力初探[J].甘肃农业大学学报,2011,46(6):41-45.
[7]陈捷,朱洁伟,张婷,等.木霉菌生物防治作用机理与应用研究进展[J].中国生物防治,2011,27(2):145-151.
[8]王雷,张华,张红印,等.粘红酵母对水果采后病害生物防治的研究进展[J].食品研究与开发,2008,29(8):129-132.
[9]Zhang Hongyin,Wang Lei,Dong Ying,et al.Postharvest biological control of gray mold decay of strawberry with Rhodotorula glutinis[J].Biological Control,2007,40(2):287-292.
[10]Masih E I,Slezack-Deschaumes S,Marmaras I,et al. Characterisation of the yeast Pichia membranifaciens and its possible use in the biological control of Botrytis cinerea,causing thegreymould diseaseofgrapevine[J].FEMSMicrobiology Letters,2001,202(2):227-232.
[11]Zheng Xiaodong,Zhang Hongyin,Xi Yufang.Postharvest biological controlofgraymold rotof strawberrywith Cryptococcus laurentii[J].Transactions of the CSAE,2003,19(5):171-175.
[12]王学奎.植物生理生化实验原理和技术[M].第2版.北京:高等教育出版社,2006:197.
[13]Rao M V,Paliyath G,Ormrod D P.Ultraviolet-B-and ozone-induced biochemieal changes in Antioxidant enzymes of Arabidopsis thaliana[J].Plant Physiol,1996,110:125-136.
[14]范冬梅,王莉.分光光度法测定植物过氧化氢酶活性的研究[J].山西大学学报:自然科学版,2008,31(1):89-91.
[15]Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascorbatespecific peroxidase in spinach chloroplasts[J].Plant Cell Physiology,1981,22(5):867-880.
[16]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:198.
[17]ZhaoYan,Tu Kang,Shao Xingfeng,et al.Effects of the yeast Pichia guilliermondii anginst Rhizopus nigricans on tomato fruit [J].Postharvest Biology Technology,2008,9:113-120.
[18]李惠华,赖钟雄.植物抗坏血酸过氧化物酶研究进展[J].亚热带植物科学,2006,35(2):66-69.
[19]李娜,陆海.植物抗坏血酸过氧化物酶基因家族研究进展[J].成都大学学报:自然科学版,2011,20(2):97-101.
[20]马旭俊,朱大海.植物超氧化物歧化酶(SOD)的研究进展[J].遗传,2003,25(2):225-231.
[21]王曼玲,胡中立,周明全,等.植物多酚氧化酶的研究进展[J].植物学通报,2005,22(2):215-222.
[22]秦国政,田世平,刘海波,等.拮抗菌与病原菌处理对采后桃果实多酚氧化酶、过氧化物酶及苯丙氨酸解氨酶的诱导[J].中国农业科学,2003,36(1):89-93.
[23]严启梅,牛丽影,唐明霞,等.微波烫漂对杏鲍菇POD酶活的影响[J].食品科学,2012,33(4):247-251.
[24]刘零怡,于萌萌,郑杨,等.采后一氧化氮处理调控番茄果实茉莉酸类物质合成并提高灰霉病抗性[J].食品科学,2010,31(22):457-461.
[25]袁根良,杨公明,余铭,等.超高压处理对香蕉果肉多酚氧化酶和过氧化物酶活性抑制的研究[J].食品科学,2010,31(10):64-68.
Research of resistance of grape fruits induced by antagonistic yeast under normal tem perature
SUO Na,ZHOU Hai-lian,WANG Xue-qiang,XIAO Hong-mei*
(College of Food Science and Technology,Nanjing Agricultural University,Nanjing 210095,China)
The antagonistic yeast,Hanseniaspora uvarum,isolated from strawberry fruitand foundeffective against Botrytis cinerea was tested to the experiment to assay the antagonism in Jufeng g rape fruits.Grape fruits were divided into g roups.In some of the fruits two holes(one injected antagonistic yeast at the concentration of 1×108c fu/m L,another one injec ted B.cinerea at the concentration of 1×105spore/m L)were punched,and H.uvarum were sp rayed ac ross some of the whole fruits.Organolep tic quality of grape fruits was observed and enzyme activity of enzymes that related to resistance was measured under normal storage temperature. The result showed that antagonistic yeast had no influence on organolep tic quality of fruits,and could maintain the organolep tic quality of fruits.For the fruits punching two holes(one injec ted antagonistic yeast,another one injec ted B.cinerea),H.uvarum can be significant induced the activity of peroxidase(POD),phenylalanine ammonia lyase(PAL),ascorbate peroxidase(APX),catalase(CAT)and polyphenol oxidase(PPO).For the whole fruits which sp rayed H.uvarum,H.uvarum could be significant induced the activity of POD,PAL,SOD and APX.Taken as a whole,antagonism yeast could trigger stress reaction of fruits,and induce resistance of host.
Hanseniaspora uvarum;Botrytis cinerea;enzyme activity;induced resistance
TS255.1
A
1002-0306(2012)22-0346-05
2012-06-01 *通讯联系人
索娜(1990-),女,大学本科生,研究方向:农产品储藏加工。
江苏省科技厅科技支撑计划(BE2010385)。
