宫颈上皮内瘤变与正常宫颈组织差异表达蛋白分析
2012-10-25吴玉梅王晓丽钱小红张玉祥
何 玥 吴玉梅* 赵 群 王晓丽 陈 硕 钱小红 张玉祥
(1.首都医科大学附属北京妇产医院妇瘤科,北京 100006;2.北京蛋白质组中心,北京 102206;3.首都医科大学基础医学院生物化学教研室,北京 100069)
宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)是宫颈癌的癌前病变,文献[1]报道北京地区25~54岁已婚妇女CIN的患病率为5.84%,其中CINⅠ为 4.65%,CINⅡ为 0.80%,CINⅢ为0.38%,CIN总体发展为原位癌的概率为正常子宫颈的20倍,发展为浸润癌的概率为正常子宫颈的7倍[2-4]。因此对于CIN的筛查显得尤为重要,目前临床医师希望能够找到一种简便经济,敏感性、特异性高,假阳性、假阴性率低的方法,早期筛查及诊断CIN[5]。由于从正常宫颈发展为CIN的发病机制尚不清楚,寻找有效的阻断正常宫颈向宫颈上皮内瘤变发展的靶点也是迫切需要解决的问题。本研究应用蛋白质组学技术,研究CIN组织与正常宫颈组织之间差异蛋白质表达,并对其中显著差异表达的蛋白质S100钙结合蛋白A9(S100 calcium-binding protein A9,S100A9)、丙酮酸激酶 M2(pyruvate kinase M2,PKM2)和真核延长因子 1A1(eukaryotic elongation 1-alpha-1,eEF1A1)应用免疫组化及蛋白印记 2种方法从定性及定量角度进行验证。筛选出CIN组织中的差异蛋白,为筛查及诊断CIN以及寻找新的治疗靶点提供客观依据。
1 资料与方法
1.1 研究对象
1)蛋白质组学研究对象:筛选2008年8月至2009年9月首都医科大学附属北京妇产医院妇瘤科收治患者的子宫颈组织32例,其中CIN组23例(CINⅠ为7例、CINⅡ为8例、CINⅢ为8例),对照组(即因子宫肌瘤行全子宫切除术的正常子宫颈组织)9例,患者年龄22~72岁,平均年龄(41.0±12.1)岁。选取纳入标准:行子宫颈锥形切除术或子宫切除术术后病理确诊。排除标准:①既往行化疗或放疗患者;②既往因CIN行手术或其他治疗患者。术中收集切除病变组织,30 min内放入液氮中,然后转移至-80℃冰箱保存。
2)免疫组织化学研究对象:筛选2011年2月至3月首都医科大学附属北京妇产医院妇瘤科收治患者的子宫颈组织40例,患者年龄22~72岁。纳入断及排除标准同蛋白质组学。其中正常、CINⅠ、Ⅱ、Ⅲ组各10例。
3)蛋白免疫印迹研究对象:筛选同期首都医科大学附属北京妇产医院妇瘤科收治的子宫颈组织36例,患者年龄在22~72岁。纳入及排除标准同蛋白质组学。其中正常、CINⅠ~Ⅱ及CINⅢ组各12例。
以上病理诊断均经2名病理学专家核实,纳入患者均签署知情同意书并由首都医科大学附属北京妇产医院伦理委员会审查通过。
1.2 主要试剂与仪器
1)蛋白组学试剂:蛋白酶抑制剂,样品裂解液,IPG胶条(IPGstrip,pH3~10)、聚丙烯酰胺凝胶(PAGE)及荧光标志物 Cy2、Cy3、Cy5均为瑞典 Amersham Pharmacia Biotech公司产品。
2)IHC及Western blotting试剂:β-actin抗体购自Santa Cruz Biotechnology公司、一抗为兔抗人PKM2多抗、兔抗人eEF1A1多抗、鼠抗人S100A9单抗,二抗为羊抗兔IgG、羊抗鼠IgG均购自美国Sigma-Aldrich公司;PV-9000试剂盒及DAB试剂盒均购自Lab Vision公司;十二烷基硫酸钠(SDS)、丙烯酰胺、甘氨酸购自美国Sigma-Aldrich公司;BCA蛋白质定量试剂盒、化学发光液、超敏发光液购自美国Pierce公司。
3)主要仪器:等电聚焦仪 IPGphor、Typhoon9410型扫描仪、MALDI-TOF/TOF MS 均为美国 Applied Biosystem公司产品;垂直电泳仪为Ettan DaltSix公司产品、DeCyderTM2D Version 6.5软件为瑞典Amersham Pharmacia Biotech公司产品。
1.3 实验方法
1)组织总蛋白抽提:将冻存组织标本迅速研磨至粉末状,经过蛋白裂解液裂解,手工匀浆及超声波粉碎细胞1 min、混匀、高速离心取上清液即为宫颈组织的总蛋白,采用改良Bradford方法进行蛋白定量。
2)二维荧光差异凝胶电泳(two-dimensional fluo-rescence difference in gel electrophoresis,2-D DIGE)2-D DIGE分离宫颈组织蛋白:用Cy2、Cy3、Cy5荧光染料标记待测样品,整个操作避光进行。遵循正反标和内标的原则,Cy2标记混合样品(内标),Cy3及Cy5分别标记CINⅠ和对照组、CINⅡ和CINⅠ组、CINⅢ和CINⅡ组进行二维电泳,共制胶3块。使用IPG等点聚焦系统进行双向凝胶电泳第1向,每个胶条的上样量均为 150 μg,总体积 450 μL,水平电泳仪电泳(24 cm IPG固向胶条、线性、pH3~10),聚焦参数(30、60V 各 6 h,100、250、500、1 000、10 000V 各 1 h,最后10 000V 8 h)。胶条平衡15 min后进行第2向垂直电泳即十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE):以电流 10 mA 运行 1 h,15 mA 运行15 h,直至溴酚蓝沿前沿移至凝胶底边停止电泳。二维电泳后,用Typhoon9410型扫描仪扫描得到二维荧光差异凝胶电泳的蛋白表达图像,用DeCyderTM2D version 6.5软件对图像进行分析,包括蛋白质点的检测、背景消减、标准化、匹配、建立平均凝胶、进行差异分析等,以确立差异表达的蛋白质点。
3)MALDI-TOF-MS 技术鉴定蛋白质点质谱及蛋白质查询:从荧光染色的制备胶中选取三维丰度比值在1.5倍以上的蛋白质点做质谱鉴定。用人工方法切胶、洗胶、脱色、脱水、原位酶解,然后进行样品萃取、点样。采用美国 ABI-4800 型 MALDI-TOF-MS 进行质谱分析。测定肽质量数和二级序列,并测定整体蛋白质量数,获得肽质量指纹图谱(peptide mass finger printing,PMF)。利用 ABI 4800 GPS软件检索 IPIHUMAN V3.52数据库寻找理论上酶解肽段能与之相匹配的蛋白,以结合蛋白质在胶上的等电点和相对分子质量鉴定蛋白质。
4)免疫组织化学(immunohistochemistry,IHC):将MALDI-TOF/TOF MS检测出差异表达蛋白进行IHC验证。收集标本4%甲醛固定后,石蜡切片脱蜡,梯度乙醇水化,PBS洗,高压柠檬酸6.0修复,3%H2O2灭活内源性酶;滴加一抗(兔抗人PKM2多抗1:100;兔抗人eEF1A1多抗1:200;鼠抗人S100A9单抗1:40),孵育过夜;滴加二抗(非生物素化PV-9000),37℃孵育30 min,DAB显色,苏木素复染脱水、封片,光镜观察。以已判断为正常宫颈组织切片作为阳性对照,以磷酸盐缓冲液(PBS)代替一抗作为阴性对照。定性结果判读:细胞无染色为0分,细胞染色呈浅黄色为1分,呈棕黄色为2分,呈棕褐色为3分。阳性细胞百分率评分标准:高倍视野(400×)下随机观察10个视野,每个视野计数100个细胞,阳性细胞百分率<5%计0分,阳性细胞百分率6% ~25%计1分,阳性细胞百分率为26% ~50%计2分,阳性细胞百分率51%~75%计3分,阳性细胞百分率>75%计4分。将项评分相乘后,0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++)。(-)与(+)为低表达,定义为阴性。(++)与(+++)为高表达定义为阳性。
5)蛋白印记:将 MALDI-TOF/TOF MS检测出差异表达蛋白再进行Western blotting验证。将冷冻组织约20 mg裂解液及离心后,采用BCA蛋白定量试剂盒测定蛋白质浓度。配10%分离胶,4%浓缩胶,上样电泳。浓缩胶电压70V,分离胶电压100V,待溴酚蓝电泳至胶底部时终止电泳;电转膜60 min,蛋白转移到PVDF膜上。5%脱脂奶室温封闭1 h,将PVDF膜孵育稀释的一抗(兔抗人PKM2多抗、兔抗人eEF1A1多抗、鼠抗人S100A9单抗,1:2 000),4℃过夜。加入二抗(相应抗鼠或抗兔第二抗体,1:2 000),与膜共同常温孵育1 h,孵育后LAS 3000曝光观察转移效果,在58 000、50 000、14 000处出现显色带为阳性,无显色带出现为阴性,选取条带最清晰图像储存。半定量结果判读:LAS3000曝光后,将数据导出,应用IMAGE J软件对对照组、CINⅠ~Ⅱ组及CINⅢ组PVDF膜同种蛋白质同时进行灰度扫描,再对同张PVDF膜上β-actin进行灰度扫描。通过灰度计算PKM2、eEF1A1及S100A9 3种蛋白占β-actin的比例进行比较计算。
1.4 统计学方法
所有数据均采用SPSS13.0统计软件进行分析处理,计量资料以均数±标准差(±s)表示,多组计量资料行单因素方差分析,组间比较采用两两比较检验,计数资料采用χ2检验或Fisher确切概率法检验,以P<0.05为差异有统计学意义。
2 结果
2.1 2-D DIGE检测差异蛋白及MALDI-TOF/TOF MS鉴定结果
DeCyder软件分析(设置三维丰度比值在1.5倍以上)结果显示CINⅠ和正常宫颈组、CINⅡ和CINⅠ组及CINⅢ和CINⅡ组组织蛋白图像(图1)。以正常宫颈组织为对照,比较各组CIN组织,有46个显著差异表达的蛋白质点(P<0.05)(图2)。差异蛋白采用MALDI-TOF/TOF MS成功鉴定出25个蛋白质,上调蛋白质点9个,下调蛋白质点15个,1个蛋白质点(PKM2)同时出现于上调及下调组。选出上调显著的S100A9蛋白、下调显著的eEF1A1蛋白及同时出现于上调组与下调组的PKM2蛋白进行了验证。
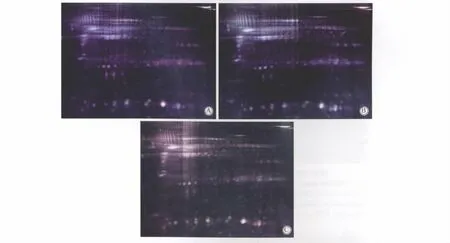
图1 二维荧光差异凝胶电泳图像Fig.1 Two-dimensional fluorescence difference in gel electrophoresis(2-D DIGE)image

图2 DeCyder软件分析得出的46个差异蛋白质点Fig.1 Analysis of the 46 differential proteins by DeCyder software
2.2 免疫组织化学定性验证结果
S100A9蛋白在正常宫颈组织及CIN病变组织中主要表达于细胞质,呈棕黄色颗粒,CIN组织中S100A9蛋白表达阳性高于正常宫颈组织(图3),各组间阳性比较差异有统计学意义(P=0.006)。eEF1A1在正常宫颈组织及CIN病变组织主要表达于细胞质,PKM2蛋白在正常宫颈组织及CIN病变组织主要表达于细胞核,均呈棕黄色颗粒,在CIN组织中eEF1A1及PKM2蛋白表达阳性稍低于正常宫颈组织(图4,5),各组间阳性比较差异均无统计学意义(P>0.05)。


图5 免疫组化染色显示PKM2蛋白在宫颈组织中的表达情况Fig.5 PKM2 protein expression in cervical tissue detected by IHC staining(SP,400×)
2.3 蛋白印记半定量验证结果
应用Western blotting法检测S100A9、eEF1A1及PKM2蛋白在正常宫颈、CINⅠ~Ⅱ、CINⅢ组织中的表达情况(图6)。随宫颈病变加重,S100A9蛋白表达水平明显增高,各组间表达差异有统计学意义(F=5.341,P=0.010)。eEF1A1蛋白的表达有降低趋势,但差异无统计学意义(F=0.151,P=0.861)。PKM2蛋白表达下调,各组间表达差异有统计学意义(F=13.588,P=0.000)。其中在S100A9蛋白和PKM2蛋白中,CINⅢ组和正常宫颈比较差异均有统计学意义(分别为 F=5.402,P=0.030;F=5.903,P=0.024)(表1)。

图6 Western blotting法测定宫颈组织中S100A9、eEF1A1、PKM2蛋白表达Fig.6 S100A9、eEF1A1、PKM2 proteins expression in cervical tissue detected by Western blotting
表1 3组宫颈组织中S100A9、eEF1A1、PKM2差异蛋白表达比较Tab.1 Comparison of different protein expression of S100A9、eEF1A1、PKM2 among three groups of cervical tissue(±s)

表1 3组宫颈组织中S100A9、eEF1A1、PKM2差异蛋白表达比较Tab.1 Comparison of different protein expression of S100A9、eEF1A1、PKM2 among three groups of cervical tissue(±s)
Differences between ① and ③ within group in S100A9/β-Actin and PKM2/β-Actin are both significant,P <0.05(the former F/P=5.402/0.03,the later F/P=5.903/0.024),S100A9:S100 calcium-binding protein A9;PKM2:pyruvate kinase M2;eEF1A1:eukaryotic elongation factor 1-alpha 1;CIN:cervical intraepithelial neoplasia.
Group Number S100A9/β-Actin eEF1A1/β-Actin PKM2/β-Actin①Control(normal cervix)12 0.098±0.092 0.513±0.208 0.630±0.146②CINⅠ~Ⅱ 12 0.142±0.160 0.505±0.253 0.319±0.181③CINⅢ 12 0.551±0.185** 0.551±0.185 0.268±0.215**F/P 36 5.341/0.010 0.151/0.861 13.588/0.000
3 讨论
3.1 CIN组织与正常宫颈组织差异蛋白组学研究意义
CIN是与宫颈浸润癌密切相关的一组癌前病变,它反映了宫颈癌发生发展由量变到质变的过程。CIN患者总体大约有20%~50%恢复正常,CINⅠ中有11.6%逆转,27.8%持续不变,1%癌变;CINⅡ中有36.3%逆转,23.1%持续不变,5.0%癌变;CINⅢ中12.0%~22.0%癌变,总体发展为子宫颈浸润癌的概率为15%[1-4]。蛋白质是实现基因功能表达的最终物质,因此,直接测定蛋白质的水平和活性是了解细胞活动的最佳方法。蛋白质组学的研究主要包括分离技术和鉴定技术,2-D DIGE检测[2]是唯一应用内参照的蛋白质分离技术,蛋白表达水平最快、最灵敏、最准确的方法。MALDI-TOF/TOF MS为代表的质谱技术也已广泛应用于蛋白质分析鉴定[3-4],该技术可得到用于微量样本分类的蛋白质组合。目前已有许多应用上述2种方法对CIN组织、黏液、脱落细胞以及血清血浆蛋白进行诊断性及治疗性研究[5-9]。本研究采用上述2种蛋白质组学研究方法对CIN与正常宫颈组织鉴定出差异蛋白,并应用IHC及Western blotting验证与蛋白组学得到结果一致,为CIN组织中差异蛋白作为新的筛查标志物提供重要证据,并为研究CIN发生的分子机制及临床诊治工作提供新的依据。
3.2 S100A9蛋白表达随CIN级别加重而逐渐升高
S100A9蛋白是S100家族成员,蛋白分子质量为14 000,定位于1q21,该区段染色体稳定性较差,与其他基因构成表皮分化复合物,参与上皮细胞的最终分化,易发生多种染色体重排[10]。Cheng P 等[11]报道S100A8/A9蛋白复合物参与线粒体氧化体系中烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶亚单位细胞色素b558的激活,而NADPH氧化过程异常可以产生细胞内活性氧(ROS)[12]。ROS可以降低线粒体膜电位,释放细胞色素C,激活caspase信号传导通路,导致细胞凋亡[13]。朱雪洁等[14]采用免疫组化SP方法检测S100A9蛋白表达从正常宫颈组织到CIN逐渐增高,且随CIN级别的加重逐渐升高,说明S100A9蛋白参与了宫颈上皮内瘤变的发生发展。Qin F等[15]报道S100A9蛋白在宫颈上皮内瘤变表达与正常宫颈组织比较下调。本研究中应用蛋白组学技术发现随CIN级别升高,S100A9蛋白表达水平逐渐增高,与朱雪洁等[14]报道相一致。本研究IHC示S100A9蛋白表达于各组子宫颈组织细胞质中,在CIN组织中蛋白表达高于正常宫颈组织,各组比较差异有统计学意义(P=0.006)。由正常宫颈组→CINⅡ组表达阳性逐渐升高,但CINⅢ组稍低于对照组及CINⅠ~Ⅱ组,考虑S100A9蛋白的表达可能与上皮或癌的角化程度有关,由于样本量较小,只能定性的验证S100A9蛋白在各组子宫颈组织中均有表达及表达位置,因此应进一步扩大样本量进行检测。Western blotting的半定量法验证提示从正常宫颈组→CINⅢ组S100A9蛋白表达上调,差异有统计学意义(P=0.010),CINⅢ组表达率远高于对照组及CINⅠ~Ⅱ组 (P=0.005),定量与定性验证均与2-D DIGE结果基本相符。S100A9表达水平的升高可能提示宫颈病变的严重程度。进一步研究S100A9蛋白表达水平与子宫颈病变组织角化程度的相关性将有助于明确这种蛋白对CIN诊断的参考价值。
3.3 eEF1A1蛋白表达随CIN级别加重有降低趋势
真核翻译延长因子1A(eukaryotic translation elongation factor 1 alpha,eEF1A)是人类基因,而 eEF1A1蛋白是其表达产物。eEF1A1蛋白基因位于染色体6q14,广泛存在于正常人体组织细胞,作为延长因子直接与氨基酰-tRNA结合,将其运至核糖体A位,使肽链延长,具有GTP酶活性,保证蛋白质合成的准确性和速度。eEF1A1参与多种细胞活动,包括胚胎发生、致癌性转化、细胞增生及细胞支架形成等[16]。目前Leclercq T M 等[17-18]报道在许多肿瘤组织中eEF1A1 蛋白为过表达,但eEF1A1蛋白在宫颈上皮内瘤变中研究较少。本研究应用蛋白组学技术发现eEF1A1蛋白在正常宫颈组→CINⅢ组表达呈下调趋势。IHC结果显示eEF1A1蛋白表达于各组子宫颈组织细胞质中,由正常宫颈组→CINⅢ组表达阳性有下降趋势,差异无统计学意义(P=0.550)。进一步行Western blotting实验验证eEF1A1蛋白的表达水平与CIN的相关性,结果示eEF1A1蛋白随病变程度加重表达水平有下调趋势,但差异无统计学意义(P=0.861),定量与定性验证均与2-D DIGE结果基本相符。
3.4 PKM2蛋白随CIN级别升高逐渐降低
丙酮酸激酶(pyruvate kinase,PK)是糖酵解途径中的关键酶,有4种同工酶:L、R、M1、M2型,这4种同工酶的分布具有组织特异性。PKM2蛋白表达于一些分化组织,如肺脏、脂肪组织、视网膜及核酸合成旺盛的所有细胞,这些细胞都是增生细胞,包括正常增生细胞、胚胎细胞、干细胞,尤其是肿瘤细胞[19-20]。PKM2蛋白存在三聚体和二聚体2种形式,前者对底物磷酸烯醇式丙酮酸(phosphoendpyruvate,PEP)的亲和力高,决定了PKM2蛋白同工酶的动力学特点;后者也称为Tu M2-PK(pyruvate kinase tumor M2)与PEP的亲和力弱,在细胞正常PEP浓度时无活性,细胞内的葡萄糖可合成核酸、磷脂以及氨基酸,大量的谷氨酰胺转变成乳酸,此相对于糖酵解的过程,可称之为谷氨酸酵解过程,以保证细胞中能量的供给高水平1,6 - 二磷酸果糖(fructose-1,6-bisphosphate,FPBP)以及色氨酸的产生又可使PK由二聚体向三聚体转化,通过糖酵解过程,PK作用下导致能量净生成,从而抑制DNA合成和细胞增生。Landt S等[21]对子宫颈癌前病变Tu M2-PK进行了检测分析,采用定量的免疫分析法发现Tu M2-PK在CINⅠ~Ⅲ组间,差异无统计学意义,并采用免疫组织化学验证了上述结论。白晓卉等[22]应用蛋白质组学质谱技术筛选宫颈黏膜上皮细胞株H8与人子宫颈癌细胞株Caski中差异表达的蛋白质,发现PKM2蛋白在Caski中的表达显著高于H8,并采用免疫印迹方法检测了由正常宫颈组→CINⅢ组,PKM2蛋白的表达水平逐渐增高。本研究中应用蛋白组学技术发现正常宫颈组→CINⅢ组,PKM2蛋白同时见于差异蛋白表达上调组及下调组,应用IHC定性检测PKM2蛋白的表达情况,发现PKM2蛋白在各组子宫颈组织细胞核中均有表达,正常宫颈组→CINⅢ组表达阳性下调,但差异无统计学意义(P=0.550),需扩大样本进行统计。而Western blotting半定量验证提示PKM2蛋白表达水平由正常宫颈组→CINⅢ组逐渐降低,各组间表达差异有统计学意义(P=0.000),定量与定性验证均与2-D DIGE结果基本相符。本研究结果提示PKM2蛋白的表达水平下调与宫颈上皮内瘤变发生及病变加重发生密切相关,与Landt S 等[21]和白晓卉等[22]报道结果不一致,考虑PKM2蛋白可能同时以二聚体及三聚体的形式存在,尚需进一步扩大样本量研究。
本研究通过2-D DIGE 与MALDI-TOF/TOF MS 结合,筛选出CIN与正常宫颈组织中25种差异表达蛋白,选取鉴定差异蛋白上调组中的S100A9、下调组中的eEF1A1及同时出现于上调及下调组中的PKM2。应用免疫组化及蛋白印迹进行验证了质谱分析结果。上调蛋白S100A9可能作为CIN的相关标志物,下调蛋白PKM2则可能为抑制CIN发生发展的蛋白质,为进一步深入研究正常宫颈发展为CIN的差异蛋白质组学奠定了基础。进一步深入研究相关蛋白变化机制,为寻找具有普遍性意义的CIN筛查肿瘤标志物提供前期研究和候选蛋白,进而为CIN的早期诊断、防治以及预测疾病的发展提供依据,为CIN从分子水平找到新治疗靶点提供理论依据。
[1]张为远,武明辉,张凇文.2007—2008年北京地区25~54岁已婚妇女宫颈上皮内瘤变的流行病学现状调查[J]. 中华妇产科杂志,2010,45(3):161-164.
[2]Alban A,David S O,Bjorkesten L,et al.A novel experimental design for comparative two-dimensional gel analysis:twodimensional difference gel electrophoresis incorporating a pooled internal standard[J].Proteomics,2003,3(1):36-44.
[3]胡家,李燕英,孙丽翠,等.Hela细胞蛋白质分离和肽质量指纹谱鉴定方法的建立[J].首都医科大学学报,2009,30(3):331-335.
[4]Ostör A G.Natural history of cervical intraepithelial neoplasia:a critical review[J].Int J Gynecol Pathol,1993,12(2):186-192.
[5]Honma H,Kanda T,Ito H,et al.Squamous cell carcinoma-antigen messenger RNA level in peripheral blood predicts recurrence after resection in patients with esophageal squamous cell carcinoma[J].Surgery,2006,139(5):678-685.
[6]Piyathilake C J,Oelschlager D K,Meleth S,et al.Plasma protein profiles differ between women diagnosed with cervical intraepithelial neoplasia(CIN)1 and 3[J].Cancer Inform,2007,27(2):345-349.
[7]Rader J S,Malone J P,Gross J,et al.A unified sample preparation protocol for proteomic and genomic profiling of cervical swabs to identify biomarkers for cervical cancer screening[J].Proteomics Clin Appl,2008,2(12):1658-1669.
[8]Schwamborn K,Krieq R C,Uhliq S,et al.MALDI imaging as a specific diagnostic tool for routine cervical cytology specimens[J].Int J Med,2011,27(3):417-421.
[9]Yim E K,Lee K H,Namkoonq S E.Proteomic analysis of ursolic acid-induced apoptosis in cervical carcinoma cells[J].Cancer Lett,2006,235(2):209-220.
[10]Salama I,Malone P S,Mihaimeed F,et al.A review of the S100 proteins in cancer[J].Eur J Surg Oncol,2008,34(4):357-364.
[11]Cheng P,Corzo C A,Luetteke N,et al.Inhibition of dendritic cell differentiation and accumulation of myeloid-derived suppressor cells in cancer is regulated by S100A9 protein [J].J Exp Med,2008,205(10):2235-2249.
[12]De Lorenzo B H,Godoy L C,Novaes e Brito R R,et al.Macrophage suppression following phagocytosis of apoptotic neutrophils is mediated by the S100A9 calcium-binding protein[J].Immunobiology,2010,215(5):341-347.
[13]Benedyk M,Sopalla C,Nacken W,et al.HaCaT keratinocytes overexpressing the S100 proteins S100A8 and S100A9 show increased NADPH oxidase and NF-kappaB activities[J].J Invest Dermatol,2007,127(8):2001-2011.
[14]朱雪洁,郑飞云,邹双微,等.S100A9在宫颈鳞癌癌变过程中的表达及意义[J].实用医学杂志,2010,26(8):1350-1352.
[15]Qin F,Song Y,Li Z,et al.S100A8/A9 induces apoptosis and inhibits metastasis of CasKi human cervical cancer cells[J].Pathol Oncol Res,2010,16(3):353-360.
[16]Lamberti A,Caraglia M,Longo O,et al.The translation elongation factor 1A in tumorigenesis,signal transduction and apoptosis:review article[J].Amino Acids,2004,26(4):443-448.
[17]Leclercq T M,Moretti P A,Pitson S M,et al.Guanine nucleotides regulate sphingosine kinase 1 activation by eukaryotic elongation factor 1A and provide a mechanism for eEF1A-associated oncogenesis[J].Oncogene,2011,30(3):372-373.
[18]Al-Maghrebi M,Anim J T,Olalu A A.Up-regulation of eukaryotic elongation factor-1 subunits in breast carcinoma[J].Anticancer Res,2005,25(3c):2573-2577.
[19]Mazurek S.Pyruvate kinase type M2:a key regulator of the metabolic budget system in tumor cells[J].Int J Biochem Cell Biol,2011,43(7):969-980.
[20]Gupta V,Bamezai R N.Human pyruvate kinase M2:a multifunctional protein[J].Protein Sci,2010,19(11):2031-2044.
[21]Laudt S,Jeschke S,Koeninger A,et al.Tumor-specific correlation of tumor M2 pyruvate kinase in pre-invasive,invasive and recurrent cervical cancer[J].Anticancer Res,2010,30(2):375-381.
[22]白晓卉,孔丽,张爱荣,等.M2-PK蛋白在宫颈及癌变组织中的差异表达[J].山东大学学报,2006,44(10):981-984.
