波纹唇鱼微卫星分子标记的筛选及适用性分析
2012-10-23彭艳辉尹绍武朱晓平刘志亮齐兴柱胡亚丽
彭艳辉, 骆 剑, 尹绍武, 朱晓平, 胡 静, 刘志亮, 祝 斐,齐兴柱, 胡亚丽
(1. 海南大学 海洋学院, 海南大学热带生物资源教育部重点实验室, 海南 海口 570228; 2. 南京师范大学生命科学学院, 江苏 南京 210046)
波纹唇鱼微卫星分子标记的筛选及适用性分析
彭艳辉1, 骆 剑1, 尹绍武2, 朱晓平1, 胡 静1, 刘志亮1, 祝 斐1,齐兴柱1, 胡亚丽2
(1. 海南大学 海洋学院, 海南大学热带生物资源教育部重点实验室, 海南 海口 570228; 2. 南京师范大学生命科学学院, 江苏 南京 210046)
采用磁珠富集法及利用生物素标记的(CA)15寡核苷酸探针从波纹唇鱼(Cheilinus undulatus)基因组 DNA Bsp143Ⅰ酶切位点的 400~1000 bp片段中筛选 CA/GT微卫星位点。洗脱的杂交片段克隆到PMD18-T载体上构建富集微卫星基因组文库后, 通过PCR筛选出阳性克隆进行测序。在120条序列中有88条序列包含有重复次数不少于5次的微卫星位点, 阳性序列比例达到73.33%。其中完美型(perfect)类型微卫星最多的重复次数为26次。在88条非冗长序列中, 共有28条(31.82%)微卫星重复序列两端有侧翼序列能够进行引物设计。用波纹唇鱼3个个体的混合基因进行引物筛选, 其中的24对具有清晰的扩增条带。将筛选的24对引物对波纹唇鱼1个群体的39个个体进行遗传多样性分析, 其中4对引物扩增产物为单态, 20对扩增产物呈多态性; 20对扩增多态的引物在39个个体中扩增出等位基因数为2~12, 平均有效等位基因数为3.5。该波纹唇鱼群体的PIC、Ho、He的平均值分别为0.0782、0.8513、0.5667。这20个微卫星位点适于波纹唇鱼群体遗传结构的研究分析。
波纹唇鱼(Cheilinus undulatus); 微卫星分子标记; 筛选; 磁珠富集法
波纹唇鱼(Cheilinus undulatus), 俗称苏眉, 分类上属硬骨鱼纲(Osteichthyes), 鲈形目(Pereifomes),隆头鱼亚目(Labroidei), 隆头鱼科(Labridae), 唇鱼属(Cheilinus), 是一种大型的珊瑚礁鱼类[1-2]。在世界范围内, 波纹唇鱼主要分布于非洲东岸、红海以及印度洋至太平洋中心, 在中国主要分布在南海与东海的南部。波纹唇鱼以其鱼唇深受亚洲人喜爱, 仅仅几年的时间, 波纹唇鱼已濒临绝种, 被世界自然保护联盟(IUCN)、世界自然基金会(WWF)等组织和《濒危野生动植物种国际贸易公约》(CITES)列入濒危物种名单[3-4]。国内外对波纹唇鱼的研究主要集中在地理分布、分类学、形态学鉴定、生态习性、繁殖和保护等方面[5-15],但未见对波纹唇鱼种质资源和遗传多样性的研究报道, 特别是在分子水平上, 目前还是空白。而了解波纹唇鱼种群遗传结构及遗传分化对于该鱼资源调查与人工繁殖是十分重要和基础性的工作。
微卫星标记(Microsatellite, SSR)作为一种分子遗传标记, 具有分布广、遗传信息含量高、共显性和便于 PCR检测等优点[16-17], 已成为鱼类种质资源保护、群体遗传结构、生物进化、分类学研究最主要的手段, 已广泛用于研究鱼类遗传多样性和遗传结构分析、亲缘关系鉴定、品系家系鉴别、构建遗传连锁图谱和数量性状定位[18-24]等方面。本研究开发、鉴定了波纹唇鱼微卫星分子标记, 旨在为波纹唇鱼及唇鱼属其他鱼类的遗传多样性、群体遗传结构、种群的时空分布动力学等方面的研究奠定基础。
1 材料与方法
1.1 材料
波纹唇鱼群体的39个野生样本采自南海海域。Bsp143I内切酶购自 Fermentas公司, 磁珠购自Promega公司, T4DNA连接酶、质粒pMD18-T载体购自TaKaRa公司, 大肠杆菌 (Escherichia coli) Top10感受态细胞、琼脂糖凝胶回收试剂盒购自天根生物科技(北京)有限公司; Linker AB、生物素标记的(CA)15探针由上海生物工程技术服务有限公司合成, M13、RV由上海捷瑞生物工程有限公司合成。
1.2 方法
1.2.1 波纹唇鱼总基因组DNA提取
采用常规“酚-氯仿”抽提法[25]提取波纹唇鱼总基因组DNA, 测定DNA浓度, -20℃保存备用。
1.2.2 DNA酶切、胶回收和接头连接
取波纹唇鱼基因组DNA(约10μg)用Bsp143Ⅰ内切酶在37℃酶切5 h。酶切产物在1%琼脂糖凝胶上电泳后, 用胶DNA回收试剂盒回收400~1000 bp的 DNA片段。将回收的片段与磷酸化接头 Linker AB(表1)在16℃连接过夜。连接反应体系20 μL, 含2 μL 10×Buffer T4DNA ligase, 1 μL T4酶, 0.3 μL磷酸化接头Linker AB, 500~1000 ng酶切DNA片段。
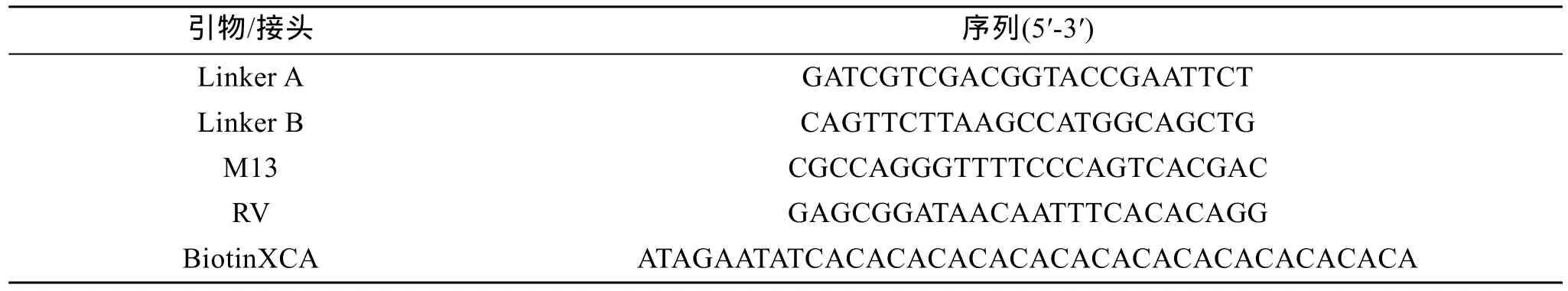
表1 实验的接头、引物及生物素探针Tab. 1 The sequence of primers, adaptors and biotin-labeled probes in the experiment
1.2.3 PCR扩增和磁珠富集
以连接产物进行 PCR扩增。PCR反应体系为25 μL, 含 2.5 μL 10×PCR Buffer、1.5 μL 25 mmol/L MgCl2、1.5 μL 2.5 mmol/L dNTP、1U Taq DNA polymerase, 引物 Bsp143Ⅰ(A) 10 pmol, 2 μLDNA 连接产物。94℃预变性5 min 后, 15 个循环, 每个循环包括94℃变性30 s, 65℃退火45 s, 72℃延伸1 min。最后72℃延伸5 min。PCR产物以试剂盒回收, 并测定浓度。
将PCR扩增产物与生物素标记的(CA)15探针进行杂交。将上一步收集到的DNA加dd2H2O至500 μL , 65 ℃水浴 10 min 后, 加入 1.5 μL 50 μmol/L BiotinX(CA)15探针, 13 μL 20×SSC Buffer, 混匀后静置10 min。期间洗涤磁珠, 先吸去磁珠管中缓冲液,加入 0.5×SSC Buffer洗涤磁珠两次。加入 500 μL DNA, 混匀, 吸出溶液, 存留。再以0.1×SSC Buffer洗涤磁珠4次。在磁珠管中加入100 μL ddH2O洗脱DNA并测定浓度。
以洗脱液为DNA模板进行PCR扩增。20个循环, 每个循环包括 94℃变性 30 s, 56℃退火 30 s,72℃延伸1 min。最后72℃延伸5 min。PCR产物以试剂盒回收, 并测定浓度。
1.2.4 DNA片段克隆、筛选和序列测定
胶回收的目的DNA片段插入pMD18-T载体后转化到感受态大肠杆菌Top10中。转化的细菌37℃,100 r/min培养1 h后涂布到添加了IPTG和X-Gal的氨苄青霉素AMP LB平板上, 37℃培养12~15 h。挑取白色单菌落于LB培养基中, 150 r/min振荡培养3~5 h。4℃作为PCR筛选的模板。
M13和RV被用来筛选阳性菌落。PCR反应体系为 10 μL, 含 1.0 μL 10×PCR Buffer、0.8 μL 25 mmol/L MgCl2、0.5 μL 2.5 mmol/L dNTP、1U Taq DNA polymerase, 引物 M13, RV 各 10 pmoL, 0.5 μL DNA模板(菌液)。94℃预变性5 min后, 25个循环, 每个循环包括94℃变性30 s, 56℃退火40 s, 72℃延伸1 min。最后72℃延伸5 min。PCR产物以1%琼脂糖凝胶电泳检测, 筛选出片段>500 bp且单一亮带的菌液。以上一步筛选出的片段大于500 bp且单一亮带的菌液为模板, 分别用M13/RV与(CA)15进行2次筛选, 筛选出有单条亮带的菌液, 送上海生物工程有限公司测序。
1.2.5 测序结果分析和统计
以软件SSRHunter、Chroms、Jellyfish等对测序结果进行微卫星搜索、峰图验证、载体去除等操作,最后按微卫星的核心重复序列次数进行统计。
1.2.6 引物设计
以软件primer premier 5.0对非冗长微卫星位点两端均有>150 bp的侧翼序列的序列设计引物, 设计原则为: 退火温度 50~60℃, GC 含量 45%~55%, 引物长度18~24, 产物预期长度50~300 bp。送上海生物工程有限公司合成。
1.2.7 引物筛选及特性的分析
用39个波纹唇鱼样本对合成的引物进行检测评估。观测杂合度(Observed heterozygosity,Ho)、期望杂合度(Expected heterozygosity,He)等由 PopGen32计算获得, 多态信息含量(Average polymorphism information content, PIC)由PIC-CALC计算获得。
2 结果
2.1 阳性克隆的筛选与测序
本研究共计挑取 697个单菌落, 以通用引物M13/RV和微卫星核心序列引物(CA)15 对其进行 2次PCR扩增筛选, 得到132个阳性菌落, 测序, 共计获得120个序列的测序结果。
2.2 微卫星位点的分析和引物设计
对120个测序结果以软件SSRHunter查找, 共计获得88个重复次数不少于5的微卫星位点序列, 阳性序列达到 73.33%, 其中两端侧翼序列均>150 bp的微卫星位点序列有56个, 占阳性序列的63.64 %。经软件Jellyfish的Alignments功能分析未发现冗长序列(同一序列测序两次)。
根据 Weber[26]的微卫星重复序列分类原则, 88个微卫星序列中各类型比例依次为完美型 69.32%,非完美型 7.95%, 复合型 22.73%, 其中完美型微卫星序列最多重复次数为 26次(图 1)。按核心序列重复次数统计, 重复次数为5~10次的微卫星序列有45条(占 51.14%), 11~15次的微卫星序列有 20条(占22.73%), 16~20次的微卫星序列有21条(占23.86%),重复序列在 20以上的有 2条(占 2.27%)。以软件Primer primer 5.0设计引物, 共设计出引物28对, 引物命名与克隆编号相对应(表2)。
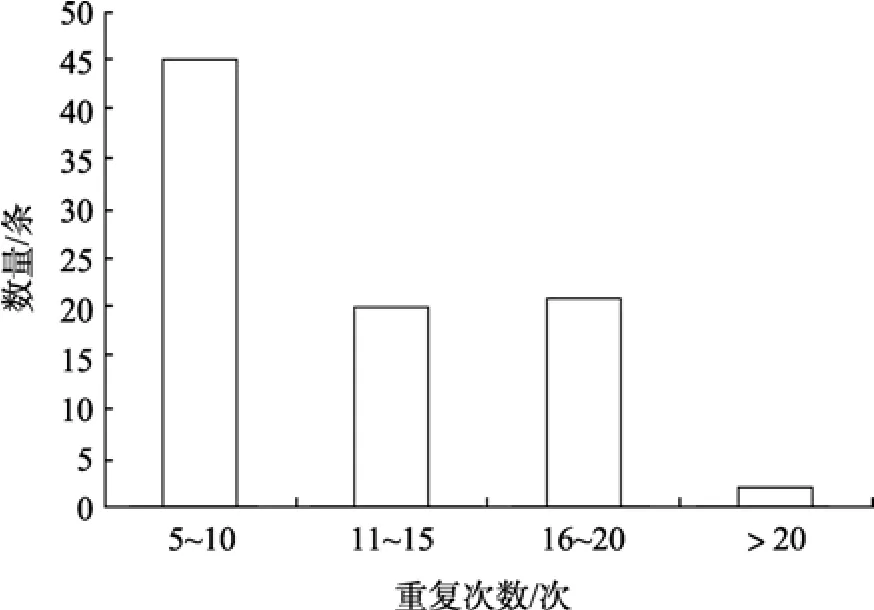
图1 波纹唇鱼微卫星大小分布Fig. 1 Microsatellite size distribution of C. undulatus
2.3 引物的筛选与评估
用波纹唇鱼的基因组DNA 3个样本, 对引物的扩增条件, 包括 Mg2+浓度、退火温度、循环次数等进行摸索, 确定最适合的 PCR扩增反应条件。结果显示, 28对引物中有24对有较好的扩增, 条带清晰且重复性高, 4对引物(B4、A44、T258和T462)未能扩增(表2)。然后用这24对引物对波纹唇鱼39个样本进行扩增。以8%聚丙烯酰胺变性凝胶电泳结合银染法[27]检测扩增产物的多态性。如图 2所示引物T462对39个波纹唇鱼样本扩增产物的多态性效果。
位点 A137、B30(3)、T90、T282扩增的条带仅1条, 无多态性, 不做进一步分析。其他20对引物共获得70个有效等位基因, 从2到12不等, 平均数为3.5。观测杂合度(Ho)的范围为 0.2308~1.0000, 平均值为 0.8513, 期望杂合度(He)的范围为0.2068~0.8442, 平均值为 0.5667, 多态性信息含量(PIC)范围为 0.1833~0.8160, 平均值为 0.4733(表 3)。根据 Bostein等[28]等提出的理论, 位点 B22、A67、A75、A106、A112、A120、T462属于高度多态性位点; 位点 A18、A3、A63、A65、A66、A101、A119、A148、A151、B30、B30(2)、T63属于中度多态性位点; 位点 T302属于低度多态性位点。由此, 可以认为该波纹唇鱼群体为中高度多态性群体, 遗传多样性比较丰富。
3 讨论
3.1 微卫星的筛选
目前, 对于没有充足基因组序列信息物种的微卫星筛选主要采用小片段克隆法(快速 PCR法)和文库富集法两种方法[28-31]。文库富集方法相对于小片段克隆法具有方法步骤简单、减少了非目的片段, 筛选效率高、筛到的微卫星数目多的优势, 简略了构建文库与筛选文库的过程[32]。本研究采用生物素探针—磁珠富集法, 并结合2次PCR扩增法筛选微卫星位点, 直接用菌液作为模板, 更是大大提高了微卫星筛选的精确性。本实验所测的序列分析表明, 相当比例的微卫星侧翼序列较短(88个含微卫星位点的序列中有32个出现此现象, 比例达36.36%), 无法筛选到合适的的引物。作者认为发生该现象的原因有两个方面: (1)可能与本实验内切酶在基因组的酶切位点有一定关系, 可以尝试改变酶切体系的方法来改善; (2)文库富集法相对于小片段克隆法, 由于所插入载体的DNA片段长度小, 也可能导致此现象。

表2 28对微卫星引物筛选结果及其特性Tab. 2 Screen results and characterization of 28 primers

图2 波纹唇鱼T462基因位点的PCR产物电泳图Fig.2 Analysis of PCR products for locus T462 in C. undulatus1~39. 波纹唇鱼个体1-39. C. undulatus individuals

表3 波纹唇鱼20个微卫星位点的PCR扩增产物的特征Tab. 3 PCR products and characteristics for 20 microsatellite loci in C. undulatus
3.2 微卫星的检测
动物中微卫星DNA以CA/GT重复最丰富[33-35],因此, 本实验采用(CA)15为探针。实验结果表明: 每100个克隆可以得到近8个微卫星序列, 得率比较高,可以认为波纹唇鱼基因组中含有丰富的CA/GT重复序列。因为实验使用的是(CA)15探针, 所以, 检测出微卫星序列多为(CA/GT)n重复, 另还检测到少量的CT/AG 重复(如位点 A63、位点 B30)以及个别的GTCT、ATCT重复。本研究所得完美型的微卫星占大多数(69.32%), 这与鲤(Cyprinus carpio)[36]、剑尾鱼(Xiphophorus helleri)[37]等鱼类的微卫星的情况相类似。所获得的微卫星序列重复次数几乎都在5~20次,这与青石斑鱼(Epinephelus awoara)[38]、勒氏笛鲷(Lutjanus russelli)[39]、团头鲂(Megalobrama amblycephala)[40]等鱼类的微卫星序列重复次数情况相似,也与 Ellegren[41]对微卫星序列重复次数分析结果是一致的。
3.3 引物适用性分析
本研究设计的28对引物, 24对有较好的扩增效果, 经8%聚丙烯酰胺变性凝胶电泳筛选后, 得到20对可用于波纹唇鱼的遗传分析, 引物的可用性比较高。另外4对引物(B4、A44、T258和T457)没能产生稳定扩增产物, 作者认为原因可能有2种情况: 一是与引物的质量有关, 如引物T258可能本身的质量就不够理想; 二是与重复序列的连续重复次数有关,重复单元连续重复次数过多可能会导致扩增的不稳定性, 影响扩增的效果, 如B4、A44和T457。这与龚小玲等[42]研究澳洲鳗鲡(Anguilla australis)的微卫星引物适用性分析的原因是一样的。本研究开发的微卫星位点及引物在今后的波纹唇鱼的群体遗传多样性分析、遗传连锁图谱构建等方面都会起到一定的作用, 进而为波纹唇鱼的种质资源保护提供理论依据, 为其可持续开发利用提供科学指导。而且, 本研究所开发的波纹唇鱼的微卫星引物也可以尝试被用于隆头鱼科其他属近缘种鱼类的研究。
[1] 沈世杰. 台湾鱼类志[M]. 台北: 台湾大学动物学系,1993, 444-456.
[2] 世界自然基金会. 十大濒临灭绝生物名单[J]. 百科知识, 2005, 6: 2,67.
[3] Russell B. The IUCN Red List of Threatened Species(2004) [EB/OL] http://www.iucnredlist.org/apps/redlist/details/4592/0.html, 2012-02-17.
[4] Sadovy Y. IUCN RedList(2000)[EB/OL]. http://www.cites.org/eng/resources/species.html, 2012-02-17.
[5] 伍汉霖. 有毒、药用及危险鱼类图鉴[M]. 上海: 上海科学技术出版社, 2005: 1-44.
[6] 于宏, 雷霁霖, 陈超, 等. 波纹唇体生物学特性及繁育保护初步研究[C]//全国海水养殖学术研讨会论文摘要集, 舟山: 海洋出版社, 2008: 68.
[7] 区又君, 齐旭东, 李加儿. 波纹唇鱼不同组织 5 种同工酶表达的差异[J].南方水产, 2009, 5(2): 51-55.
[8] 霍蕊, 张本, 陈国华, 等. 波纹唇鱼染色体核型分析[J]. 海洋科学, 2009, 33(4): 94-97.
[9] 周丽青, 杨爱国, 吴彪, 等. 波纹唇鱼染色体制备及核型的初步研究[J]. 渔业科学进展, 2010, 31(1):54-58.
[10] Sluka R D. Grouper and Napoleon wrasse ecology in Laamu Atoll, Republic of Maldives: Part II. Habitat,behavior, and movement patterns[J]. Atoll Res Bull,2000, 491: 1-26.
[11] Sluka R D. Humphead Wrasse (Cheilinus undulatus)abundance and size structure among coral reef habitats in maldives[J]. Atoll Res Bull, 2005, 538: 189-198.
[12] Donaldson T J, Sadovy Y. Threatened fishes of the world: Cheilinus undulatus RÜppell, 1835 (Labridae)[J]. Environmental Biology of Fishes, 2001, 62:428.
[13] Sadovy Y, Kulbicki M, Labrosse P, et al. The humphead wrasse, Cheilinus undulatus: synopsis of a threatened and poorly known giant coral reef fish[J]. Reviews in Fish Biology and Fisheries, 2003, 13: 327-364.
[14] Choat J H, Davies C R, Ackerman J L, et al. Age structure and growth in a large teleost, Cheilinus undulatus,with a review of size distribution in labrid fishes[J].Mar Ecol Prog Ser, 2006, 318: 237-246.
[15] Dorenbosch M, Grol M G, Nagelkerken I, et al. Seagrass beds and mangroves as potential nurseries for the threatened Indo-Pacific humphead wrasse, Cheilinus undulatus and Caribbean rainbow parrotfish, Scarus guacamaia[J]. Biological Conservation, 2006, 129:277-282.
[16] Wright J M, Bentzen P. Microsatellites: genetic markers for the future[J]. Reviews in Fish Biology and Fisheries,1994, 4: 384-388.
[17] 胡则辉, 周志刚. 微卫星 DNA标记技术及其在海洋生物遗传学中的应用[J]. 海洋湖沼通报, 2006, 1(4):37-45.
[18] 尹绍武, 黄海, 雷从改, 等. DNA分子标记技术在海水鱼类遗传育种中的应用与展望[J]. 海南大学学报(自然科学版), 2007, 25(2): 194-199.
[19] 张小谷, 童金苟, 熊邦喜. 微卫星标记在鱼类遗传及育种研究中的应用[J]. 农业生物技术学报, 2006,14(1): 117-121.
[20] Rivera M J, Graham G C, Roderick G K. Isolation and characterization of nine microsatellite loci from the Hawaiian grouper Epinephelus quernus (Serranidae)for population genetic analyses[J]. Marine Biotechnology, 2003, 5: 126-129.
[21] Zatcoff M S, Ball A O, Sedberry G R. Population genetic analysis of red grouper, Epinephelus morio, and scamp, Myceroperca phenax, from the southeastern U.S.Atlantic and Gulf of Mexico[J]. Marine Biotechnology, 2004, 144: 769-777.
[22] Wang C M, Zhu Z Y, Na-Nakorn U, Koedprang W.Study of genetic diversity of orange-spotted grouper,Epinephelus coioides, from Thailand and Indonesia using microsatellite markers[J]. Marine Biotechnology,2005, 8: 17-26.
[23] Chun Ming Wang, Ze Yuan Zhu, Loong Chueng Lo, et al. A microsatellite linkage map of barramundi, Lates calcarifer [J]. Genetics, 2007, 175: 907-915.
[24] Moghadam H K, Poissant J, Fotherby H, et al. Quanti-tative trait loci for body weight, condition factor and age at sexual maturation in arctic charr (Salvelinus alpinus): comparative analysis with rainbow trout (Oncorhynchus mykiss) and Atlantic salmon (Salmo salar)[J]. Mol Genet Genomics, 2007, 277(6): 647-661.
[25] 萨姆布鲁克J, 弗里奇 E F, 曼尼阿蒂斯T. 分子克隆实验指南(第二版)[M].北京: 科学出版社, 1995.464-467.
[26] Weber J L. Informativeness of human (dC-dA)n- (dG-dT)n poly morphisms[J]. Genomics, 1990, 7: 524-530.
[27] Sanguinetti C L, Dias Neto E S A.Rapid silver staining and reeovery of PCR products separated on polyaerylamide gels[J]. Biotechniques, 1994, 17: 915-919.
[28] 曾庆国, 陈艺燕. 微卫星位点筛选方法综述[J].生态科学, 2005, 24(4): 368-372.
[29] 胡维, 向华, 周艳, 等. 用PCR法直接快速筛查重组阳性克隆[J]. 生物技术通报, 1999, 15(6): 39-40.
[30] 徐鹏, 周岭华, 相建海. 用PCR法快速筛选中国对虾含微卫星的重组阳性克隆[J]. 水产学报, 2001, 25(2):127-130.
[31] 宋春妮, 李健, 刘萍, 等. 日本鲟微卫星富集文库的建立与多态性标记的筛选[J]. 水产学报, 2011, 35(1):35-42.
[32] 孙效文, 贾智英, 魏东旺, 等. 磁珠富集法与小片段克隆法筛选鲤微卫星的比较研究[J]. 中国水产科学,2005, 12(2): 126-132.
[33] Botsein D, White R L, Skolnick M, et al. Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J]. American Journal of Human Genetics, 1980, 32(3): 314-331.
[34] Brenner S, Elgar G, Sandford R, et al. Characterization of the pufferfish (Fugu) genome as a compact model vertebrate genome[J]. Nature, 1993, 366: 265-268.
[35] Toth G, Gaspari Z, Jurka J. Microsatellites in different eukaryotic genomes: survey and analysis[J]. Genome Res, 2000, 10: 967-981.
[36] 魏东旺, 楼允东, 孙效文, 等. 鲤鱼微卫星分子标记的筛选[J]. 动物学研究, 2001, 22(3): 238-241.
[37] 李霞, 白俊杰, 吴淑勤, 等. 剑尾鱼微卫星DNA的筛选[J]. 中国水产科学, 2004, 11(3): 197-201.
[38] 刘丽, 刘楚吾, 郭昱嵩, 等. 青石斑鱼微卫星DNA标记的筛选及群体遗传多样性分析[J]. 中国水产科学,2008, 15(1): 22-29.
[39] 郭昱嵩, 王中铎, 刘楚吾, 等. 勒氏笛鲷微卫星位点的筛选及特征分析[J]. 遗传, 2007, 29(3): 355-359.
[40] 李绍戊, 常玉梅, 梁利群, 等. 团头鲂微卫星标记的快速制备[J]. 中国水产科学, 2006, 13(2): 187-192.
[41] Ellegren H. Microsatellite evolutin: a battle between replication slippage and point mutation[J]. Trends Genet, 2002, 18:70.
[42] 龚小玲, 李思发, 蔡完其, 等. 澳洲鳗鲡微卫星分子标记的筛选与检测[J].中国水产科学, 2009, 16(1): 133-138.
Screening and suitability analysis of microsatellite markers in Cheilinus undulatus
PENG Yan-hui1, LUO Jian1, YIN Shao-wu2, ZHU Xiao-ping1, HU Jing1,
LIU Zhi-liang1, ZHU Fei1, QI Xing-zhu1, HU Ya-li2
(1. The Ocean College of Hainan University, Key Laboratory of Tropical Biological Resources of Hainan University,Ministry of Education, Haikou 570228, China; 2.College of Life Sciences,Nanjing Normal University, Nanjing 210046, China)
Feb.,9, 2011
Cheilinus undulatus; microsatellite molecular markers; screening; magnetic-bead enrichment method
Genomic DNA of Cheilinus undulatus was digested by restriction endonuclease Bsp143Ⅰand electrophored on agarose gel. The DNA fragments from 400 to 1000 bp were recovered and ligated to Bsp143Ⅰadaptor.Purified and adaptor ligated fragments were hybridized to biotin-labelled (CA)15probe and captured by Streptavidin-coated magnetic beads. Target fragments were eluted, and PCR amplified, then the purified PCR products were inserted to PMD18-T vector and transformed into Top 10 component cell. Positive clones in the enriched genomic DNA bank were screened out through PCR method and sequenced. Of 120 positive clones, 88 sequences contained repetition that repeated no less than 5 times, none redundant sequences were found after the multiple sequence alignment analysis, and the 88 non-redundant microsatellite-contained sequences, of which about 73.33%contained positive sequence, and the largest repeat number of perfect type microsatellite was 26. Among the 88 non-redundants,28 (or 31.82%) had enough flanking region (>150 bp), which is enough to design microsatellite primer pairs. 28 primer pairs were synthesized and tested with the compound DNA of 3 C. undulatus individuals. 24 loci were produced with clear bands. A population of 39 individuals were tested with the 24 loci. 20 loci revealed polymorphic,while 4 loci was monomorphic. The primer pairs amplified the loci with relatively high numbers of alleles ranging from 2 to 12 with an average of 3.5 per locus among 20 ploymorphic loci. The polymorphism information content (PIC), observed heterozygosity (Ho) and expected heterozygosity (He) were 0.0782, 0.8513, and 0.5667, respectively. The 20 ploymorphic loci could be useful for the analysis of population structure from C. undulatus.
Q31
A
1000-3096(2012)05-0109-08
2011-02-09;
2011-05-10
国家自然科学基金资助项目(40966003); 海南省自然科学基金资助项目(809009); “十一五”国家科技支撑计划重点资助项目(2007BAD29B03)
彭艳辉(1985-), 女, 湖南衡东人, 硕士研究生, 主要从事
鱼类种质资源与遗传育种研究, E-mail: pyh221100@163.com; 尹绍武,通信作者, 教授, E-mail: yinshaowu@163.com
(本文编辑:谭雪静)
