雌鼠母爱剥夺模型在应激反应中的特征
2012-10-22高尚锋阮玲娟包爱民
孙 博,高尚锋,阮玲娟,包爱民
(浙江大学医学院神经生物学系、浙江省神经生物学重点实验室、卫生部医学神经生物学重点实验室,浙江杭州 310058)
下丘脑-垂体-肾上腺(hypothalamo-pituitary-adrenal axis,HPA)轴是神经内分泌系统的重要组成部分,参与调节应激反应。下丘脑室旁核(paraventricularnucleus,PVN)分泌促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)作用于垂体,垂体分泌促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)作用于肾上腺皮质,肾上腺皮质分泌的糖皮质激素(大鼠中为皮质酮)介导应激反应。此外,肾上腺皮质激素还可以作用于大脑前额叶皮层、海马、下丘脑等部位,对HPA轴进行反馈调节。HPA轴活性亢进,尤其是其活性的中枢性驱动因子CRH神经元的过度激活,是抑郁症发病机制中的关键因素[1-4]。我们的前期研究表明,人体下丘脑PVN内CRH神经元活性存在着明显性别差异,并且与外周性激素水平相关,这一生理现象可能是抑郁症发病中性别差异的基础[5]。
性激素是甾体激素,可以直接进入细胞通过与其核受体结合调节目的基因转录。我们的前期研究发现,雄激素(核)受体(androgen receptor,AR)和雌激素(核)受体(estrogen receptor,ER)及下丘脑PVN内CRH神经元均分别存在着共定位[6-7],雄激素与AR结合后可以抑制CRH基因表达,减低HPA轴活性;雌激素和ER结合后可刺激CRH基因表达,提高HPA轴活性[6-7]。抑郁症患者下丘脑PVN内CRH神经元活性增高伴随ER基因表达上调和AR基因表达下调[6]。这些研究提示,性激素及其受体在抑郁症中直接参与HPA轴活性的调节。
早期生活压力(又称童年逆境),例如儿童期遭受虐待、忽视等,可能造成HPA轴活性的持续性改变[4],增加其成年期应激敏感性以及罹患抑郁症的易感性[8]。然而,这种影响存在着性别差异。经历过早期生活压力的女性成年后罹患抑郁症的风险更大[9]。大鼠母爱剥夺模型通过将刚出生的仔鼠与母鼠短暂隔离,模拟由于母爱缺乏造成的早期生活压力,是研究这一类疾病的良好动物模型。已有报道显示,雄性Sprague-Dawley(SD)大鼠在母爱剥夺后HPA轴活性升高[10]。但是,迄今为止尚缺乏对于雌性SD大鼠母爱剥夺模型的研究的报道。由于抑郁症的发病和早期生活压力均与HPA轴活性密切相关,并都存在性别差异,而临床上女性重型抑郁障碍的发病率是男性的两倍[4],因此,研究雌性大鼠母爱剥夺模型的特征具有重要意义。在本研究中我们建立雌性大鼠母爱剥夺模型,探讨母爱剥夺的雌鼠在成年期HPA轴活性和应激反应特征。
1 材料与方法
1.1 母爱剥夺模型建立 母鼠选择正常成年SD大鼠(清洁级),体重220~250 g。根据已报道的雄鼠实验模型造模[10]:母鼠生产仔鼠的当日定义为P0,仔鼠出生后选择雌性仔鼠进行研究。出生后第1天(P1)将出生自同一孕鼠的雌性仔鼠随机分为母爱剥夺组(n=24)和对照组(n=26)。对于母爱剥夺组,出生后第2~5天(P2—P5),每日将仔鼠与母鼠分离4 h,第6~20天(P6—P20),每日分离6 h。对照组仔鼠和母鼠始终共同生活,不做任何特殊处理。第21天,实验组和对照组仔鼠同时断奶,移入标准的实验动物恒温恒湿饲养环境,自由饮食,日夜循环为12 h/12 h。
1.2 急性应激 在雌鼠成年后(P100),通过每日上午9∶00-10∶00阴道涂片,连续观察两个完整动情周期。分别选择处于动情前期和动情期的雌鼠进行直接取材或急性应激后取材。急性应激为轻微足底电击,使用0.8 mA电流每间隔25 s给予5 s电击,连续进行30个循环,共计15 min。在两个动情周期的阶段(动情前期、动情期)分别建立4组:母爱剥夺急性应激组、母爱剥夺非急性应激组、非母爱剥夺急性应激组和非母爱剥夺非急性应激组,每组6~7只大鼠。
1.3 取材 于上午9∶00-11∶00完成对非急性应激组取材之后再完成对急性应激组的足底电击。电击结束后立即断头。使用EDTA抗凝管留取躯干血,温和混匀后,4℃条件下1500 r/min离心20 min,取上层血浆,分装后保存于-80℃冰箱。于冰上快速取出整脑,并置于4%多聚甲醛溶液中4℃固定24 h,之后在20%和30%蔗糖溶液中分别脱水24 h,最终保存在4℃的30%蔗糖溶液中。所有标本保存到相关检测开始时取出。
1.4 激素水平测定 采用放射免疫法测定血浆雌二醇(DSL公司)、睾酮(Immotech公司)、ACTH(Cisbio公司)水平。雌二醇的组内和组间变异系数分别为8.9%和12.2%,睾酮的组内和组间变异系数为8.6%和11.9%,ACTH组内和组间的变异系数分别为10.2%和2.2%。采用酶联免疫吸附法测定血浆皮质酮(IBL公司)水平,组内和组间变异系数分别为4.0%和 6.2%。
1.5 PVN内ER-β和AR免疫组化染色 使用冰冻切片常规免疫组织化学方法检测下丘脑PVN中ER-β和AR的表达。AR抗体来自BD公司(1∶400稀释),ER-β抗体来自 Abcam公司(1∶200稀释),均为4℃孵育过夜,两种抗体均为兔来源的多克隆抗体。二抗为山羊抗兔血清(中彬金桥公司,不稀释直接使用,室温1 h),显色剂为 DAB(Sigma公司)。步骤中,所有除特殊标注外,稀释液和洗涤液均为Tris-HCl缓冲液(TBS 溶液,0.05 mol/L,pH=7.6)。使用 Image Pro Plus 6.2(Media Cybernetics,Bethesda,USA)软件进行免疫细胞化学图像分析。计数细胞时,在高倍镜下(40倍物镜)随机选取下丘脑PVN内5个100 μm×100 μm的视野,对每个视野中阳性染色细胞进行计数,平均后作为计数结果。
2 结果
2.1 正常成年雌鼠血浆性激素水平 未经过母爱剥夺和足底电击的成年雌鼠在不同动情周期血浆性激素水平的变化如图1显示。与动情前期相比,血浆中雌二醇(A)和睾酮(B)水平在动情期和动情间期都显著下降(P<0.001),但二者在动情期和动情间期之间均没有显著差异。

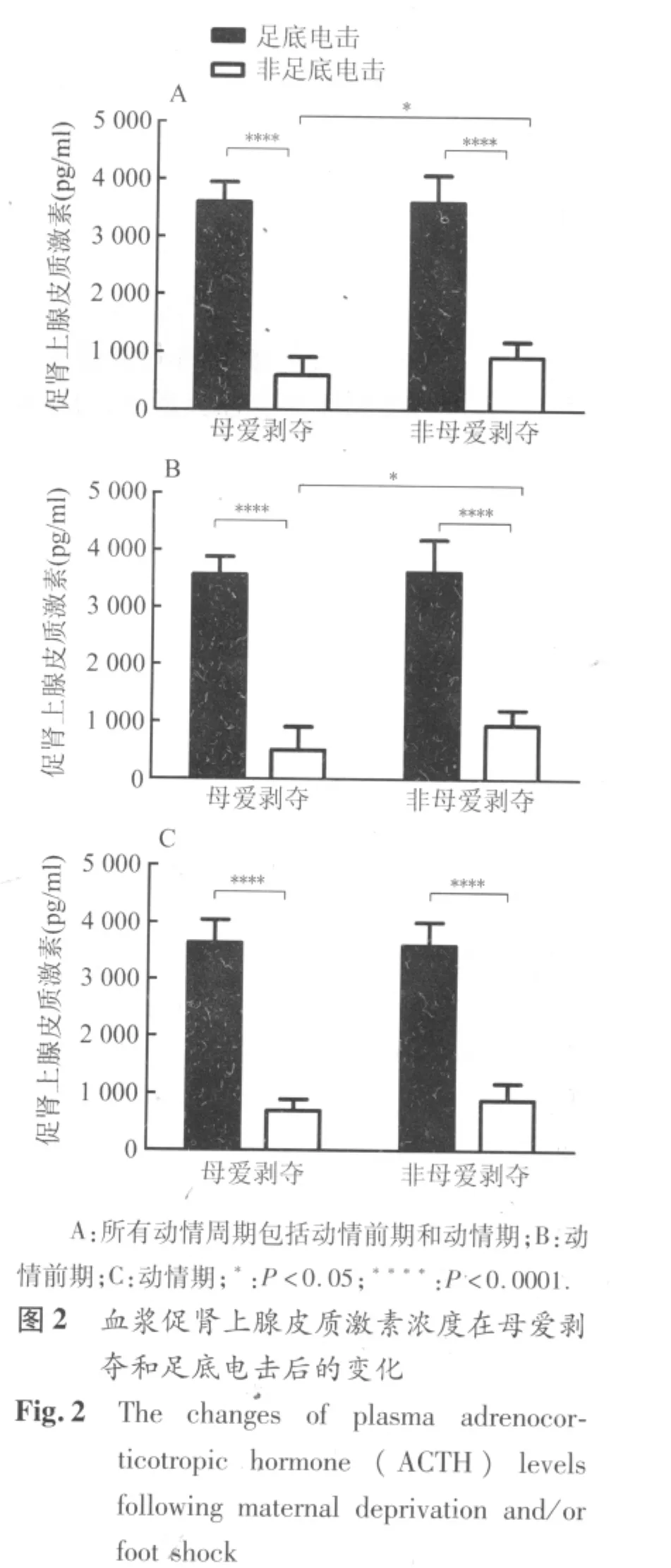
2.2 血浆ACTH水平 正常对照组成年雌性大鼠血浆ACTH水平在动情前期和动情期之间没有明显差异。母爱剥夺导致血浆中基础ACTH水平明显下降 (图2A,P=0.012),但对足底电击引起的ACTH水平变化无显著影响。母爱剥夺引起的ACTH降低主要出现在动情前期(图2B,P=0.047)而不是动情期。足底电击在母爱剥夺和非剥夺雌鼠中均引起血浆中ACTH浓度显著升高(图2,P <0.0001),这种应激反应与大鼠的动情周期无关。
2.3 血浆皮质酮水平 正常对照组成年雌性大鼠血浆皮质酮水平在动情前期和动情期之间没有明显差异。母爱剥夺引起的皮质酮水平在动情前期和动情期均有降低的趋势。足底电击在母爱剥夺和非剥夺雌鼠中均引起血浆中皮质酮浓度显著升高(图3,P<0.05),动情前期对照组和母爱剥夺组雌鼠都比动情期雌鼠对足底电击更为敏感(图3B、C,P <0.01)。母爱剥夺导致血浆中基础皮质酮水平明显下降 (图3A,P=0.019),但对足底电击引起的皮质酮水平变化无显著影响。
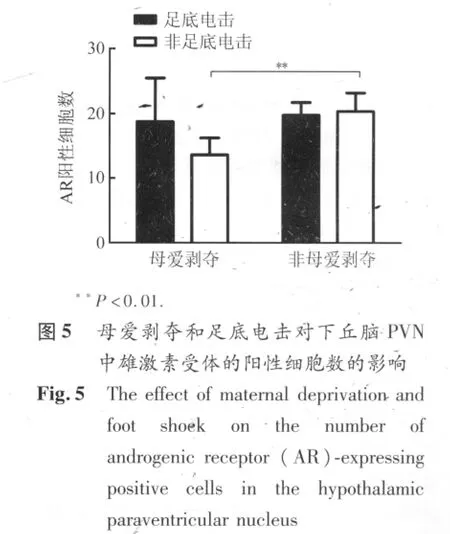
2.4 下丘脑PVN内AR和ER表达 AR和ER-β广泛分布与下丘脑区域,但在PVN中的染色轮廓明显(图4A、B)。AR主要表达在细胞核(图4a),ER-β在细胞核和细胞质内均有染色(图4b)。母爱剥夺显著降低成年雌鼠下丘脑 PVN中 AR阳性细胞数(图 5,P=0.008),这种影响主要表现在动情期。急性足底电击没有导致母爱剥夺鼠和非剥夺鼠下丘脑PVN中AR表达的改变。母爱剥夺和/或足底应激对下丘脑PVN中ER-β阳性细胞数均无显著影响。
3 讨论
本次研究发现,经历母爱剥夺的雌性SD大鼠成年后血浆基础ACTH和皮质酮水平明显下降。母爱剥夺引起的血浆ACTH基础水平降低主要表现在动情前期,而皮质酮水平的降低同时表现在动情前期和动情期。急性应激(足底电击)在母爱剥夺和非剥夺雌性SD大鼠中均引起血浆中ACTH和皮质酮浓度显著升高。这与前人应用其它急性应激模型得到的结果相符[10],同时也说明成年后的急性应激并不能使母爱剥夺雌鼠的HPA轴活性敏化。下丘脑PVN内ER-β阳性细胞数在雌鼠母爱剥夺和急性应激后无显著改变,但是AR阳性细胞数在母爱剥夺后显著降低。这说明AR表达明显受到母爱剥夺的影响,并参与调节HPA轴活性。


成年健康雌性SD大鼠在动情周期的不同阶段血浆性激素水平存在明显波动,从动情前期向动情期过渡中雌二醇和睾酮水平均显著降低,而在动情期和动情间期之间这些激素水平波动并不显著。因此,我们选择连续的两个阶段(动情前期和动情期),对经受过早期母爱剥夺的雌鼠进行HPA轴活性及其在急性应激反应中的变化的研究。在动情前期血浆中性激素的水平最高,因此,动情前期ACTH的水平改变提示其更依赖于性激素对于HPA轴功能的调节。在血浆性激素高水平的动情前期和血浆性激素水平下降的动情期,皮质酮水平均发生改变,提示皮质酮水平受到性激素之外的其它因素的调节。
Nemeroff等[10]在使用雄性SD大鼠进行母爱剥夺实验时发现,经历母爱剥夺的雄鼠成年后HPA轴基础活性上升,表现为下丘脑正中隆起处CRH浓度增加和血清ACTH水平升高[10]。在本实验中,经历相同母爱剥夺过程的SD雌鼠的HPA轴基础活性降低,表现为血浆ACTH和皮质酮水平下降。这提示母爱剥夺模型的HPA轴活性存在着性别差异。在其他母爱剥夺模型和其他品系的大鼠中,也存在类似的性别差异。例如在Long-Evans大鼠中,母爱剥夺只对雌鼠造成影响[11],而在单次长时间母爱剥夺模型中,雄性Wistar大鼠的抑郁样反应的易感性更高[12]。这种性别差异提示,在进行对于动物母爱剥夺效应的研究中,要注意甄别动物品系和性别差异,所得出的研究结论要注意限定动物品系和性别范畴。
SD雌性大鼠母爱剥夺后的HPA轴活性“降低”也提示该模型中的母爱剥夺很有可能引发了雌鼠的类似创伤后应激障碍(Posttraumatic Stress Disorder,PTSD)反 应。PTSD是人类的早期生活压力或生活中创伤性经历造成的精神疾病之一[8]。PTSD的典型表现之一就是HPA轴活性减低[13],这与本研究的研究结果相符。PTSD患者海马功能紊乱,糖皮质激素受体和盐皮质激素受体的敏感性增强,使得HPA轴负反馈增强,最终使患者基础HPA 轴活性减低[13]。
本研究发现母爱剥夺引起雌性SD大鼠下丘脑PVN内AR表达下调,而AR对CRH神经元活性具有直接抑制作用[6],因此,这种“去抑制”状态引起的HPA轴活性“增加”,可能表现于PVN内向脑干自主神经系统投射而不是经典地向垂体分泌的CRH增加。向脑干自主神经系统投射的CRH的效应是通过该系统增加肾上腺皮质对于ACTH的敏感性而产生的[14]。这符合本研究所发现的SD雌性大鼠母爱剥夺模型具有类似于PTSD患者的皮质激素受体敏感性增强,HPA轴负反馈增强而最终导致ACTH、皮质酮等基础水平减低现象。因此,可以推测母爱剥夺可能至少通过两条通路影响神经内分泌系统:一条通过下调PVN中AR的表达而“增加”HPA轴基础活性[6];另一条通过增加糖皮质激素受体的敏感性而“减低”HPA轴基础活性[13],其最终结果都是导致动物在成年后HPA轴基础活性和应激反应的易感性改变。值得注意的是,这两条通路调节的最终结果可能具有动物品系差异和性别差异,研究时需要进行甄别。
本研究建立的雌性SD大鼠母爱剥夺模型,为研究生活早期不良应激对成年后应激反应和/或抑郁症等疾病的易感性及其性别差异机制提供了有益的研究工具。母爱剥夺可以使雌性SD大鼠HPA轴基础活性降低,该变化与外周性激素水平波动相关联。下丘脑内雄激素比雌激素对于CRH活性的调节作用可能更为显著。
[1]BANKI C M,KARMACS L,BISSETTE G,et al.Cerebrospinal fluid neuropeptides in mood disorder and dementia[J].J Affect Disord,1992,25(1):39-45.
[2]RAADSHER F C,VANHEERIKHUIZE J J,LUCASSEN P J,et al.Corticotropin-releasing hormone mRNA levels in the paraventricular nucleus of patients with Alzheimer's disease and depression [J].Am J Psychiatry,1995,152(9):1372-1376.
[3]GAO S F,BAO A M.Corticotropin-Releasing Hormone,Glutamate,and γ-Aminobutyric Acid in Depression [J].Neuroscientist,2011,17(1):124-144.
[4]BAO A M,MEYNEN G,SWAAB D F.The stress system in depression and neurodegeneration:Focus on the human hypothalamus[J].Brain Res Rev,2008,57(2):531-553.
[5]BAO A M,SWAAB D F.Gender difference in agerelated number of corticotropin-releasing hormoneexpressing neurons in the human hypothalamic paraventricular nucleus and the role of sex hormones[J].Neuroendocrinology,2007,85(1):27-36.
[6]BAO A M,FISCHER D F,WU Y H,et al.A direct androgenic involvement in the expression of human corticotropin-releasing hormone [J]. Mol Psychiatry,2006,11(6):567-576.
[7]BAO A M,HESTIANTORO A,VAN SOMEREN E J W,et al.Colocalization of corticotropin-releasing hormone and oestrogen receptor-α in the paraventricular nucleus of the hypothalamus in mood disorders[J].Brain,2005,128(6):1301-1313.
[8]GUTMAN D A,NEMEROFF C B.Persistent central nervous system effects of an adverse early environment:clinical and preclinical studies[J].Physiol Behav,2003,79(3):471-478.
[9]MacMILLAN H L,FLEMING J E,STREINER D L,et al.Childhood abuse and lifetime psychopathology in a community sample [J].Am J Psychiatry,2001,158(11):1878-1883.
[10]LADD C O,OWENS M J,NEMEROFF C B.Persistent changes in corticotropin-releasing factor neuronal systems induced by maternal deprivation[J].Endocrinology,1996,137(4):1212-1218.
[11]MOURLON V,BAUDIN A,BLANC O,et al.Maternal deprivation induces depressive-like behaviours only in female rats[J].Behav BrainRes,2010,213(2):278-287.
[12]VIVEROS M P, LLORENTE R, LOPEZGALLARDO M,et al.Sex-dependent alterations in response to maternal deprivation in rats [J].Psychoneuroendocrinology,2009,34(Supplement 1):S217-S226.
[13]SECKL J R,MEANEY M J.Glucocorticoid“Programming”and PTSD Risk[J].Ann N Y Acad Sci,2006,1071(1):351-378.
[14]BUIJS R M,KALSBEEK A.Hypothalamic integration of central and peripheral clocks[J].Nat Rev Neurosci,2001,2(7),521-526.
