阿尔茨海默病转基因小鼠不同脑区老年斑的观测
2012-10-21朱元贵赵小贞
林 仁 王 玮 朱元贵 赵小贞△
1(福建医科大学 人体解剖学与组织胚胎学系,福州 350122)
2(福建医科大学 附属协和医院老年病研究所,福州 350001)
阿尔茨海默病是常见的中枢神经退行性疾病,老年斑是其的重要病理征之一[1-3]。本实验采用七月龄雌性转基因小鼠模型,分别应用Aβ免疫组织化学染色法与改良Bielshowsky镀银染色法观察小鼠大脑皮质第一运动区(primary motor cortex,M1)、大脑皮质第二运动区(secondary motor cortex,M2)、齿状回(gyrus dentatus,GD)、海马CA1区(field CA1of hippocampus,CA1)、海马CA3 区(field CA3of hippocampus,CA3),尾壳核(caudate putamen nucleus,CPu)以及小脑(cerebellum,Cb)等七个脑区老年斑的分布,以期探讨二种方法检测老年斑的可靠性。
1 材料与方法
1.1 实验动物及分组
七月龄阿尔茨海默病转基因雌性小鼠7只(体质量:40±3g,由美国Mary Jo Ladu教授惠赠),其中野生型小鼠3只,突变型4只。
1.2 Morris水迷宫检测学习记忆能力
实验历时6天,记录从进入水中到找到平台的时间定为逃避潜伏期,取四个象限逃避潜伏期均值作为平均逃避潜伏期,进入水中后搜索平台的路径定为搜索策略。
1.3 实验鼠处理
小鼠经灌注取脑、石蜡包埋,进行5μm 与10 μm 交替连续冠状切片,10张5μm 和5张10μm 计为一个模块,共3模块。5μm 切片备做酶免疫组织化学染色,10μm 切片备做改良Bielshowsky镀银染色。
1.4 酶免疫组织化学染色
具体步骤参照迈新生物科技公司UltraSensitiveTM S-P超敏试剂盒说明书。一抗:兔抗Aβ(北京博奥森生物技术有限公司),加PBS 1∶400稀释。阴性片以PBS代替一抗。
1.5 改良Bielshowsky镀银染色
切片常规脱蜡脱水,经3%硝酸银水溶液、10%甲醛水溶液、氨银乙醇液、8%甲醛水溶液后5%硫代硫酸钠液固定,脱水透明,中性树胶封片。
1.6 体视学计量
应用每小格1.5×1.5的测试网格计数阳性物数量。
1.7 统计应用
SPSS 11.5 统计软件包,秩和检验分析改良Bielshowsky镀银染色与Aβ酶免疫组织化学染色的老年斑计数,并分析二者计数结果的相关性。
2 结果
2.1 水迷宫实验结果
秩和检验结果显示,野生型小鼠和突变型小鼠小鼠平均逃避潜伏期差异无统计学意义(P>0.05);卡方检验分析小鼠的搜索策略,结果显示两组的差异有统计学意义(P<0.05,见表1)。

表1 野生型小鼠与突变型小鼠搜索策略的比较Table 1 Comparison of search strategy between wild type mice and mutant
2.2 Aβ酶免疫组织化学染色结果
AD 转基因小鼠不同脑区均可见棕黄色均质状物的细胞质中,且在突变型小鼠的M1、M2、CA1、CA3、GD、CPu的细胞外聚积成大小不一的棕黄色老年斑(见图1)。统计分析显示,Aβ在突变型小鼠与野生型小鼠脑内的分布差异有统计学意义(MWU=6361,P<0.05)。在M1、M2、CA1、CA3、GD 及CPu脑区,野生型与突变型小鼠Aβ的分布差异有统计学意义(见表2)。但在Cb中,两组的表达差异无统计学意义。
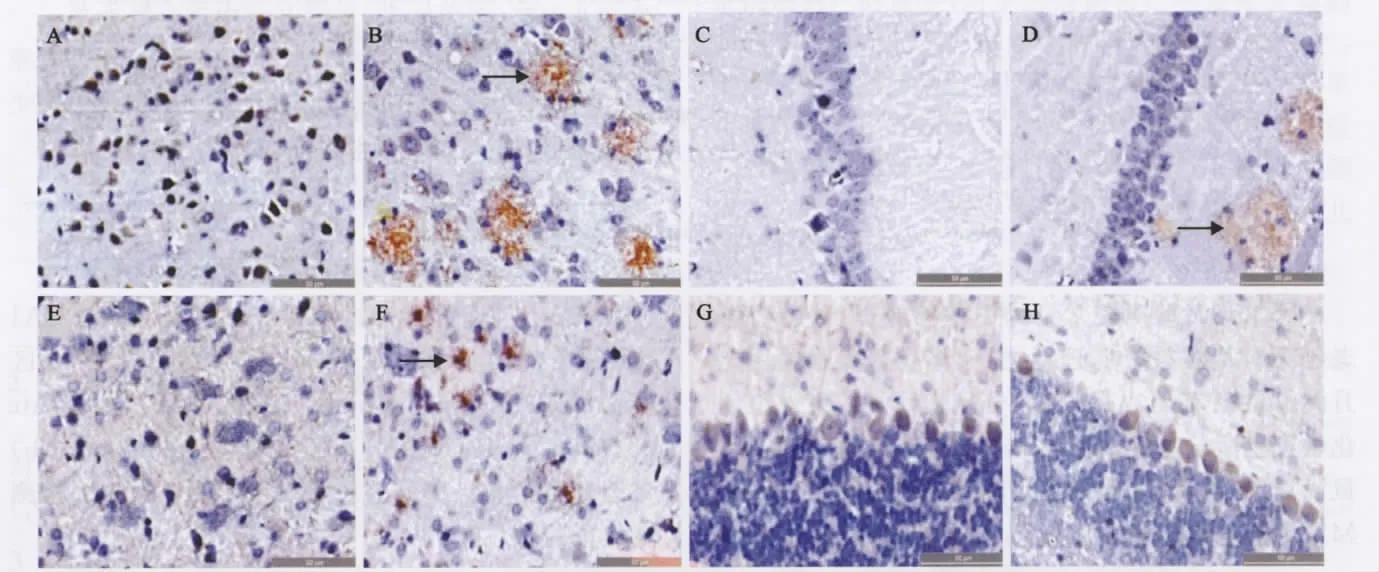
图1 Aβ免疫反应阳性物在阿尔茨海默病转基因小鼠不同脑区的分布(Aβ免疫组织化学染色,×400)Fig 1 Immunohistochemical stains were positive for Aβin the different brain regions of AD transgenic mice
2.3 改良Bielshowsky镀银染色结果
除Cb外,突变型小鼠各脑区均可见类圆形的棕黑色斑块,斑块大小、数量不一。秩和检验分析显示,棕黑色斑块在突变型小鼠与野生型小鼠脑内分布差异有统计学意义(MWU=2597.5,P<0.05)。其中,突变型小鼠M1、M2、CA1、CA3、GD 可见大量类圆形的棕黑色斑块;而在Cpu仅少量出现,且斑块较小。野生型小鼠M1、M2、CA1、CA3、GD 及Cpu只有少量不典型、体积较小的棕黑色类圆形斑块出现(见图2)。突变型小鼠和野生型小鼠在上述区域中均未发现典型神经元纤维缠结。经体视学计数后统计分析显示,棕黑色斑块在突变型小鼠与野生型小鼠的M1、M2、CA1、CA3、GD 及Cpu等相应脑区中的分布有差异有统计学意义(见表2)。

图2 老年斑在阿尔茨海默病转基因小鼠脑内的分布 改良Bielshowsky染色(bar=50μm)Fig 2 The distribution of senile plaque in cerebral region of AD transgenic mice(bar=50μm)

表2 突变型小鼠与野生型小鼠的相应脑区的老年斑及Aβ比较的MWU值Table 2 MWU value of the comparison of senile plaques and Aβin the different brain regions of wild-type mice and mutant type
2.4 Aβ与老年斑的相关性
经相关性散点图分析,Aβ免疫组化阳性反应物与改良Bielshowsky染色老年斑在阿尔茨海默病转基因小鼠脑内表达量可能存在相关性(见图3)。经相关分析结果显示二者表达量呈正相关(r=0.228,P<0.01)。

图3 改良Bielshowsky染色与Aβ免疫组织化学染色阳性物散点图Fig.3 The scatter diagram shows correlation analysis results of Aβ immunohistochemistry and senile plaque
3 讨论
阿尔茨海默病是一种以记忆力衰退、判断力和理解力下降为主要表现神经退行性疾病,其发病机制尚不清楚。为进一步探究其发病机制,研究者根据其发病机制假说,建立多种动物模型,如慢性缺血性痴呆模型、转基因模型、胆碱能功能损伤模型等。模型建立的成功与否直接决定后续研究的成败。老年斑与神经纤维缠结的形成是阿尔茨海默病的二个重要病理特征。Aβ聚积引起细胞外老年斑的形成,被认为在阿尔茨海默病的发病过程中起着核心作用[4]。此外,Aβ还促使Tau蛋白的磷酸化,后者是神经纤维缠结的重要原因[5-6]。
已有临床流行病学研究表明,AD 的发病具有明显的性别差异,更年期后的女性AD 的患病率明显升高[7]。本实验采用七月龄雌性AD 转基因小鼠,分别应用Morris水迷宫检测学习记忆能力、应用改良Bielshowsky镀银染色法与Aβ免疫组织化学染色法检测病理特征老年斑。Morris水迷宫检测结果显示,野生型小鼠的搜索策略较突变型小鼠好,提示未发生AD 的小鼠学习记忆能力强于AD小鼠。此外,本实验发现野生型小鼠与突变型小鼠在平均逃避潜伏期无明显差异,其原因可能是由于小鼠的运动能力存在差异(本实验未对两组小鼠进行运动能力检测,对此感到遗憾)及本实验的实验小鼠数目较少引起的统计偏差有关。
改良Bielshowsky镀银染色法及Aβ酶免疫组织化学染色法检测实验小鼠脑内老年斑或神经纤维缠结的发生情况。结果发现,在突变型小鼠的脑内均有大量阳性物出现,而野生型小鼠脑内只偶见少数阳性物出现。其中,Aβ酶免疫组织化学染色结果可见野生型小鼠和突变型小鼠脑的细胞质内有均质状Aβ分布,且在突变型小鼠脑内可见Aβ聚积形成类圆形棕黄色斑块,斑块分布广泛,大小不一。改良Bielshowsky染色可见突变型小鼠脑内有大量类圆形的棕黑色老年斑,老年斑大小不一,分布广泛。经统计分析显示,老年斑在野生型小鼠与突变型小鼠脑的M1、M2、CA1、CA3、GD、Cpu区的分布存在差异。两种染色方法均显示老年斑在Cb中的分布差异无统计学意义。改良Bielshowsky染色的阳性反应物与Aβ酶免疫组织化学染阳性物经体视学计数相关性分析,结果显示二者呈正相关性。提示Bieshowsky染色结果与Aβ免疫组织化学染色结果一致。在由此可见,改良Bielshowsky银染法和Aβ免疫组织化学染色法均可做为AD 模型可靠的检测方法。当然,改良Bielshowsky镀银染色法和免疫组织化学法各有利弊,改良Bielshowsky镀银染色法在器械与容器的清洁方面要求较高,否则易产生假阳性或假阴性。但成功的改良Bielshowsky镀银染色结果能清晰观察到典型老年斑的形态特征。且改良Bielshowsky镀银染色法具有稳定性较好,敏感度高,重复性好等特点,可作为检测老年斑的良好手段。Aβ免疫组织化学染色结果不但观察免疫反应物的位置和形态,还具有针对性地反映了Aβ在阿尔茨海默病中的作用。但有出现假阳性的可能,因而必需同步设置阴性对照组、找出抗体的最佳稀释比例、避免标本干燥以及注意将洗涤液冲洗干净。
综上所述,老年斑在AD 脑的海马及躯体运动区等脑区均有广泛分布,我们通过应用AD 转基因小鼠证实了改良Bielshowsky镀银染色法与Aβ免疫组织化学染色法均可作为检测AD 病理征老年斑的可靠方法,为后续实验提供良好基础。
[1]Serrano-Pozo A,Mielke ML,Gómez-Isla T,et al.Reactive Glia not only Associates with Plaques but also Parallels Tangles in Alzheimer’s Disease[J].The American Journal of Pathology,2011,179(3):1373-1384.
[2]Howlett DR,Richardson JC.The pathology of APP transgenic mice:a model of Alzheimer's disease or simply overexpression of APP?[J].Histol histopathol,2009,24(1):83-100.
[3]Daniel P,Perl MD.Neuropathology of Alzheimer’s Disease[J].Mount sinal journal of medicine,2010,77:32-42.
[4]Roberts BR,Ryan TM,Bush A,et al.The role of metallobiology and amyloid-βpeptides in Alzheimer’s disease[J].Journal of Neurochemistry,2012,120(s1):149-166.
[5]Morales-Corraliza J,Berger JD,Mazzella MJ,et al.Calpastatin modulates APP processing in the brains of beta-amyloid depositing but not wild-type mice[J].Neurobiol Aging,2012,33(6):1125.e9-1125.e18.
[6]Li N,Yu ZL,Wang ZL,et al.Increased tau phosphorylation and beta amyloid in the hipocampus of mouse pups by early life lead exposure[J].Acta Biol Hung.2010,61(2):123-134.
[7]Henderson VW,Brinton RD.Chapter 3-Menopause and Mitochondria:Windows into Estrogen Effects on Alzheimer’s Disease Risk and Therapy[J].Progress in Brain Research,2010,182:77-96.