皮下埋置卡马西平致中毒性表皮坏死松解症型药疹一例
2012-10-20刘建军吕世超杨鹤鸣刘军连夏天保
刘建军,吕世超,杨鹤鸣,李 斌,刘军连,夏天保
中毒性表皮坏死松解症(TEN)型药疹是药疹中最严重的一型,常见致敏药物有抗生素(头孢菌素、青霉素、磺胺)、解热镇痛药、抗痛风药(别嘌醇)、抗癫痫药(巴比妥类、卡马西平)等,其中卡马西平诱导Stevens Johnson综合征(Stevens Johnson syndrome,SJS)/TEN的发生率为14/10万[1]。以往报道卡马西平诱导的TEN均为口服引起,皮下埋置卡马西平引起的TEN少见文献报道。笔者成功治愈1例由皮下埋置卡马西平致TEN型药疹的患者,现报告如下。
临床资料
患者,女,38岁。主因全身皮肤红斑、水疱、大疱伴黏膜损害4 d,于2011年1月14日来我院就诊。患者8 d前因癫痫病就诊于当地诊所,予以双上臂外侧皮下埋置卡马西平片400 mg治疗, 并口服“丙戊酸钠”。4 d后双下肢出现粟粒至豆粒大的红斑,未予治疗。 皮损迅速累及躯干、面部,部分红斑上出现水疱、大疱,口腔、外阴黏膜糜烂,并伴有发热。1周后就诊于当地医院,诊断为多形红斑型药疹。用镊子取出“残留的卡马西平”,并给予地塞米松15 mg静脉滴注、左西替利嗪口服1 d,皮损无好转。患者既往有癫痫病史2年,共发作5次,未接受过药物治疗。体格检查:T 38.1 ℃,P 88次/min,R 20次/min,BP 100/60 mm Hg,体重52 kg。发育正常,急性病容,巩膜无黄染,全身浅表淋巴结不增大。皮肤科检查:眼结膜充血,口腔和外阴黏膜糜烂、渗出(图1a),面部水肿性暗红斑,躯干、四肢散在大小不等的暗红斑,部分红斑上有松弛性水疱、大疱(图1b)。尼氏征阳性。整个表皮剥脱面积约70%,双侧上臂外侧各有一个约1 cm×0.3 cm大的创口(图1c)。实验室检查:血常规中白细胞5.0×109/L、单核细胞10.74%,尿常规中白细胞、红细胞、上皮细胞及细菌计数均高于正常,粪常规正常;肝功能、肾功能、血电解质、白蛋白均正常。根据病史、临床症状、皮损特征及表皮剥脱面积,诊断为TEN型药疹。
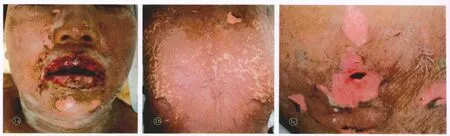
图1 中毒性表皮坏死松解症型药疹患者面部、背部和上肢皮损
入院后给予甲泼尼龙60 mg/d[1.5mg/(kg·d)]静脉滴注,保护胃黏膜、补钾等对症支持治疗及皮肤黏膜护理。2 d后体温降至正常,但皮损继续加重,遂对药物埋置部位进行扩大清创术。清创范围直径约2 cm,深达肱骨深肌层,持刮匙缓慢刮出较多坏死物质,部分呈颗粒状(可能是药物残渣),再以过氧化氢、生理盐水冲洗伤口,油纱条引流,无菌纱布加压包扎。以后每日冲洗伤口和换药。将甲泼尼龙剂量增至80 mg/d,并给予静脉注射用人免疫球蛋白(intravenous immunoglobulin,IVIG)20 g/d,同时加强营养支持和皮肤黏膜护理。鼓励患者口服肠内营养乳剂(瑞素)1 500~2 000 ml/d,保证摄入热量> 6 276 J/d,待病情略有好转后再添加高蛋白流食。定期紫外线消毒病房,更换床单,生理盐水冲洗双眼,外用眼药水及眼药膏,用含有利多卡因和制霉菌素的生理盐水漱口,庆大霉素和硼酸溶液湿敷口唇和外阴黏膜糜烂处。为了减轻因翻身导致的表皮剥脱,鼓励患者尽可能多坐、多站。使用红外线照射糜烂面,并外涂夫西地酸乳膏,该例患者未发生大面积感染及败血症。3 d后原有水疱开始干涸、黏膜糜烂面渗出减少,1周后皮损继续好转,甲泼尼龙减至70 mg/d,以后根据皮损改善情况缓慢减量,1个月后皮损痊愈而出院。患者出院后自服丙戊酸钠,未发生药物不良反应,确证TEN型药疹是由皮下埋置卡马西平所致。
讨论
TEN主要由药物引起,也有报道由肺炎支原体感染引起者[2]。TEN的发病机制还不完全清楚,研究证实TEN是机体针对药物成分发生的一种特异性迟发型超敏反应。免疫组化检查发现皮损内有CD8+T细胞(表皮内)和CD4+T细胞(真皮内)浸润进一步支持该观点[3]。TEN的组织病理学特征是角质形成细胞凋亡引起的大范围表皮坏死,而角质形成细胞的凋亡可能是通过T细胞膜上的FasL与角质形成细胞膜上的Fas结合和细胞毒效应T细胞分泌的颗粒溶素导致的[3,4]。巨噬细胞和角质形成细胞分泌的肿瘤坏死因子(TNF)-α在诱导角质形成细胞凋亡或吸引细胞毒效应T细胞过程中也起一定的作用[5]。本例患者属非常规用药引起的重症药疹,从变态反应学上看,皮下给药较口服更容易致敏,对于卡马西平类药,不宜推荐皮下给药。
目前对于TEN还没有标准化的治疗方案,首先停用或清除可疑药物是极其重要的。本例患者是由皮下埋置卡马西平片引起的,药物在局部能存留2周左右,因此局部清创是早期治疗的关键,仅用镊子等器械取出药物是不够的。治疗TEN的药物包括糖皮质激素、IVIG、TNF抑制剂、环孢素、环磷酰胺、沙利度胺等,但这些药物的有效性还存在争议,需要进一步研究明确。一项回顾性的比较研究结果表明,糖皮质激素和IVIG联合治疗相对于单用糖皮质激素有降低病死率的趋势[6]。本例患者经糖皮质激素和IVIG联合治疗取得了满意的效果。IVIG的作用机制可能与其阻止Fas-FasL介导的细胞凋亡有关[7]。
加强营养支持和皮肤黏膜护理,防治继发感染,对成功治疗TEN和减少后遗症的发生也起着非常重要的作用。国外TEN患者一般被送往烧伤中心或重病监护室,按照烧伤原则进行治疗。据文献报道50%以上的TEN患者痊愈后会留下后遗症,主要包括色素沉着和色素减退斑、甲营养不良、眼部并发症(干眼症、倒睫、睑球粘连、睑内翻)、弥漫性脱发,食管狭窄、阴道粘连和包茎等[8]。本例患者除遗留少量色素沉着斑外无其他后遗症。
[1]Roujeau JC, Stern RS. Severe adverse cutaneous reactions to drugs [J]. N Engl J Med, 1994, 331(19):1272-1285.
[2]Fournier S, Bastuji-Garin S, Mentec H, et al. Toxic epidermal necrolysis associated with Mycoplasma pneumoniae infection[J]. Eur J Clin Microbiol Infect Dis, 1995, 14(6):558-559.
[3]Borchers AT, Lee JL, Naguwa SM, et al. stevens-johnson syndrome and toxic epidermal necrolysis [J]. Autoimmunity Reviews, 2008, 7(8):598-605.
[4]Chung WH, Hung SI, Yang JY, et al. Granulysin is a key mediator for disseminated keratinocyte death in Stevens-Johnson syndrome and toxic epidermal necrolysis [J]. Nat Med, 2008,14(12):1343–1350.
[5]Nagy N, McGrath JA. Blistering skin diseases: a bridge between dermatopathology and molecular [J]. Histopathology, 2010,56(1):91-99.
[6]Yang Ys, Xu Jh, Li F, et al. Combination therapy of intravenous immunoglobulin and corticosteroids in the treatment of toxic epidermal necrolysis and Stevens-Johnson syndrome: a retrospective comparative study in China [J]. Int J Dermatol,2009, 48(10):1122-1128.
[7]Paquet P, Jacob E, Damas P, et al. Treatment of druginduced toxic epidermal necrolysis with intravenous human immunoglobulins [J]. Burns, 2001, 27(6):652-655.
[8]Magina S, Lisboa C, Leal V, et al. Dermatological and ophthalmological sequels in toxic epidermal necrolysis [J].Dermatology, 2003, 207(1):33–36.
