C型硅胶与偶联剂KH-560键合反应初探
2012-10-19彭奇均
雷 鸣,王 艳,赵 昊,彭奇均
(江南大学化学与材料工程学院,江苏 无锡 214122)
研究开发
C型硅胶与偶联剂KH-560键合反应初探
雷 鸣,王 艳,赵 昊,彭奇均
(江南大学化学与材料工程学院,江苏 无锡 214122)
运用甲苯回流法制备了3-缩水甘油基丙基硅胶键合相,并通过正交实验及单因素实验,探讨了物料配比、反应温度、反应时间等条件对键合相形成的影响规律。结果表明:KH-560含量的适当增加、反应温度的升高、反应时间的延长均能促进键合相的形成。同时还发现反应温度过高、反应时间过长会导致KH-560的分解。适合硅胶和 KH-560键合的反应条件是:硅胶∶KH-560=1∶2(质量比);反应温度 65~80 ℃;反应时间48~72 h。该条件可避免KH-560的分解。最后通过元素分析法所得氢含量与理论计算氢含量的比较,得出KH-560分子上只有1个甲氧基参与了键合反应。
3-缩水甘油基丙基硅胶;键合相;硅烷偶联剂KH-560
手性配体交换色谱固定相可用于氨基酸、羟基酸、氨基醇等手性化合物的光学拆分,对生命科学、不对称合成以及医药、食品、卫生等领域的研究具有重要意义[1]。目前应用较为广泛的是硅胶键合型固定相,即利用硅胶表面的硅羟基与硅烷偶联剂(如氯代硅烷或烷氧基硅烷)反应,形成键合相。再通过该键合相与某种光学纯的手性化合物(如L-氨基酸)反应,形成满足不同分离目的的固定相[2]。从前人的研究报道中发现,人们对于硅胶和硅烷偶联剂 KH-560的反应(图 1)存在不同的认识,即KH-560上甲氧基参与反应的程度不一致。
Gübitz 等[3]、Wachsmann 等[4]、Pesek 等[5]在合成手性配体交换固定相时,认为偶联剂上只有一个甲氧基参与反应。吴邦桂等[6]、付春梅等[7]、祝馨怡[8]亦支持这一观点。生成的产物结构如图 1中(Ⅰ)所示。
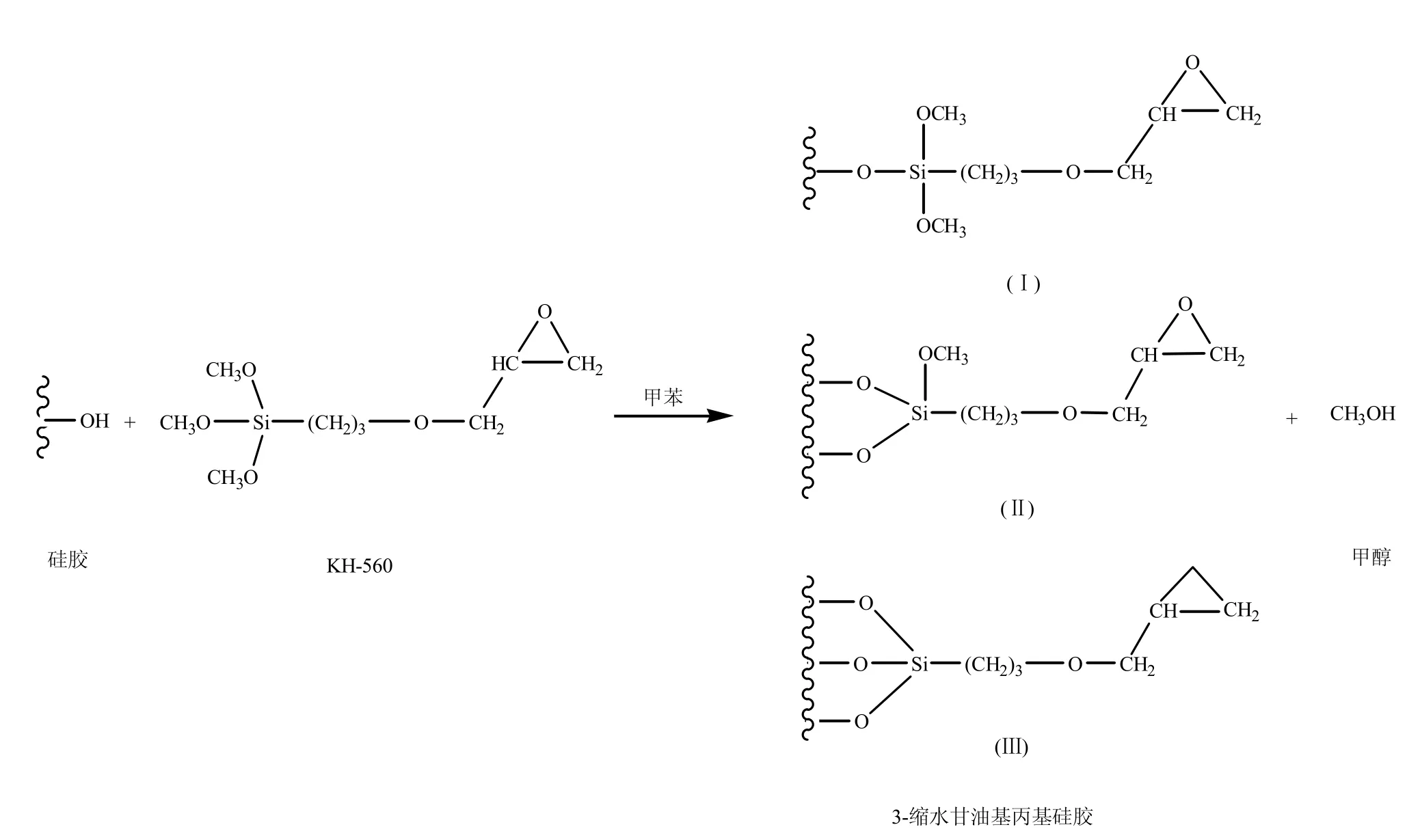
图1 硅胶与KH-560的反应
Pirkle[9]在合成手性固定相分离氨基酸对映体的研究中发现,偶联剂(分子结构与KH-560类似)上有两个乙氧基与硅胶发生了键合反应。Sadeghi[10]在使用水杨酸偶氮磺胺吡啶修饰硅胶从水中提取铀离子的研究中发现,偶联剂有2个甲氧基与硅胶发生键合反应。Song[11]在合成配体交换手性固定相的研究中认为有两个甲氧基参与了键合反应,生成的产物结构如图1中(Ⅱ)所示。
Mayani等[12]在合成手性固定相并探讨其潜在应用的研究中认为偶联剂上3个乙氧基都参与了键合反应,生成的产物结构如图1中(Ⅲ)所示。
本文欲通过正交实验和单因素实验,探索各反应条件对反应产物生成的影响规律。再通过元素分析法研究KH-560上甲氧基参与反应的程度。
1 实验部分
1.1 试剂与仪器
硅胶,C 型,目数 100~200,粒度 75~150 μm,孔径 80~100 Å,(1 Å =0.1 nm),比表面积 300~400 m2/g,青岛海洋化工有限公司生产;偶联剂KH-560,纯度 98%,上海耀华有限公司生产;甲苯、环己酮,AR,钠粒干燥,国药集团化学试剂有限公司生产;元素分析仪,型号Vario EL Ⅲ,德国Elementar公司生产;气相色谱仪,型号9790型,福立分析仪器有限公司生产;电子天平,型号JA1203,上海精科天平厂生产;搅拌器,型号GS12-Ⅱ,上海医械专机厂生产。
1.2 KH-560的定量分析
对于图1的反应过程,反应结束后,溶液中应含有 KH-560、甲苯及甲醇。因甲醇易挥发,不宜定量分析;KH-560不挥发,可以定量分析。采用气相色谱-内标法,可测定溶液中含有的KH-560。
1.2.1 内标物的选取
气相色谱条件:SE-54弱极性柱(30 m×0.32 mm,0.4 μm),N240 m L/m in,H245 m L/min,空气600 m L/min,灵敏度100,程序升温40 ℃/m in,从45 ℃(3min)升至 280 ℃(2 m in),汽化室 300 ℃,氢火焰检测器300 ℃。
分别测定备选内标物环己酮、二甲亚砜、乙二醇及反应后溶液中组分甲醇、甲苯、KH-560的保留时间。
1.2.2 标准曲线的绘制
准确称量6份KH-560标准样品,每份样品均加入1 m L内标物,并称量,甲苯定容至10 m L,气相色谱测定KH-560和内标物的峰面积。
1.2.3 相对标准偏差和回收率的测定
配制 5份含有甲醇、甲苯、KH-560和内标物的样品10 m L,其中KH-560和内标物需准确称量。气相色谱测得KH-560和内标物的峰面积,代入标准曲线方程计算得出KH-560的测出量,重复测定5次,计算相对标准偏差(RSD)。再向样品中添加一定量的KH-560,将测出量与实际含量相比,得回收率。
1.3 反应条件
由于前人制备3-缩水甘油基丙基硅胶的反应条件存在较大差别,故本文先通过正交试验对反应条件进行优化,在较优的反应条件基础上,通过单因素实验,考察各反应条件对反应产物生成的影响规律。
1.3.1 反应条件的优化
正交实验考察物料配比、反应温度、反应时间等因素。定义键合量为每克原料硅胶反应后质量增加的克数[式(1)]。以键合量为考察指标,键合量高为优。各因素水平分布如表1所示。

表1 考察因素水平分布

根据正交表L9(34)安排实验。反应前,原料硅胶在150 ℃干燥至恒重。每组反应均在带搅拌及回流装置的烧瓶中进行,50 m L甲苯作溶剂,氮气保护。反应结束,过滤。为去除产物对KH-560和甲苯的吸附,固体产物用20 m L 甲苯浸泡15 m in,过滤、洗涤,至气相色谱检测洗涤液中不含KH-560,再将洗涤后的产物在 45 ℃真空干燥(5 mbar,1bar=105Pa)至恒重,冷却、称重、计算键合量。
1.3.2 单因素实验
根据正交实验各因素水平趋势图,安排实验点,实验条件同上,考察各因素对反应产物生成的影响规律。
不加硅胶,其余条件同单因素实验条件,作为对照,测定KH-560含量,计算转化率,考察KH-560自身是否发生变化。
1.4 甲氧基的参与程度
元素分析仪测原料硅胶含氢量 T[H]硅胶、产物的含碳量 T[C]产物及含氢量 T[H]产物,由 T[C]产物值计算不同个数的甲氧基参与反应时的理论含氢量A c[H]产物,比较 T[H]产物和 A c[H]产物,可知甲氧基参与反应的程度。
假设有x mol的KH-560(C9H20O5Si)发生反应,根据元素守恒原则,KH-560分子上 n个甲氧基参与反应的含碳量如式(2)所示。

由此计算得x 。
理论含氢量的计算如式(3)所示。

2 结果与讨论
2.1 内标物的选取
图2显示该色谱条件下,备选内标物(3#、5#、6#)与反应后溶液中组分(1#、2#、4#)能完全分离。但实验发现乙二醇与甲苯不能互溶。二甲亚砜凝固点较高(18.4 ℃),在室温较低时,不便于操作。且两者峰型不理想,因此不能作为内标物。环己酮不存在上述问题,化学性质稳定,故以环己酮作为测定KH-560的内标物。
2.2 标准曲线的绘制
气相色谱测得KH-560和环己酮的峰面积如表2所示。

图2 反应组分与备选内标物气相色谱图
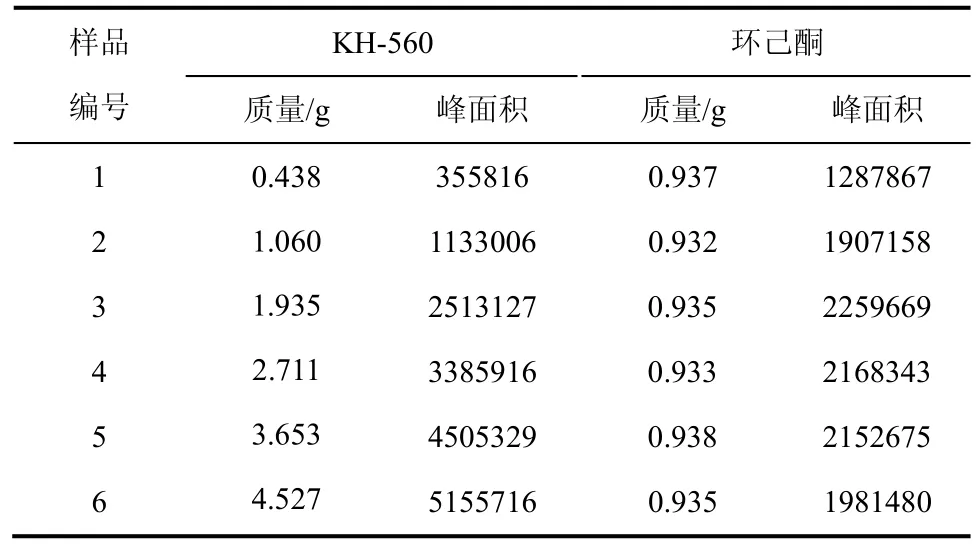
表2 KH-560和环己酮的质量和峰面积
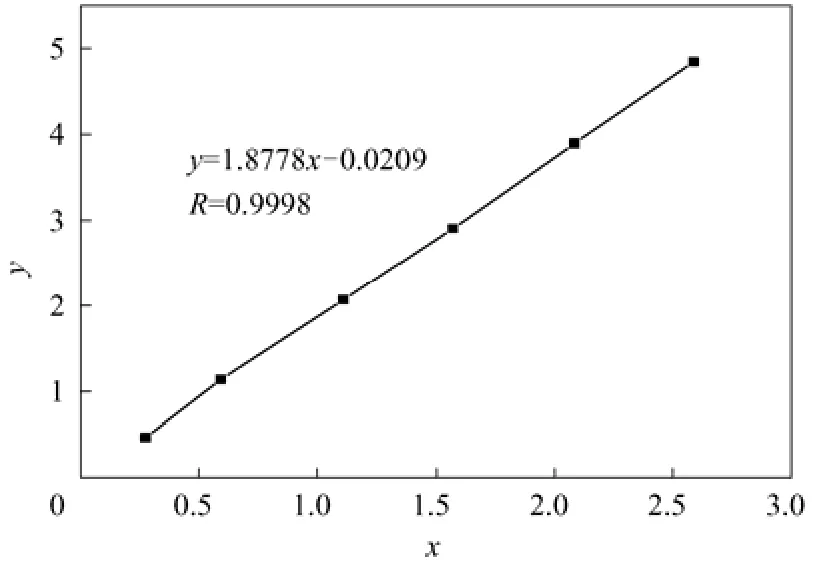
图3 内标法测KH-560标准曲线
以AKH-560/A环己酮为横坐标,mKH-560/m环己酮为纵坐标,绘制标准曲线,如图3所示。KH-560浓度为0.04~0.45 g/m L,该标准曲线满足方程y=1.8778x-0.0209,相关系数为0.9998,拟合很好。
2.3 相对标准偏差和回收率的测定
表3显示,气相色谱-内标法测KH-560,测量结果的相对标准偏差为0.3%~1.5%。当KH-560含量>10%时(3~5组),相对标准偏差<1%,平均回收率 100%。表明本分析方法的精密度和准确度均较高,可以作为检测反应液中KH-560的定量分析方法。
2.4 反应条件的筛选
正交实验结果表明(表4),第9组反应产物键合量最高,其反应条件最有可能为较优条件。因此,以第9组反应条件作为单因素研究的初始条件。从反应后溶液颜色比较,第8、第9两组溶液变黄,怀疑是KH-560自身发生了化学变化。从极差大小判断,在3个被考察因素中,影响硅胶键合量大小的主次顺序是:物料配比>反应时间>反应温度。
根据各水平键合量之和(Σ键合量)及水平分布,画水平趋势图,如图4所示。

表3 测定KH-560的RSD和回收率
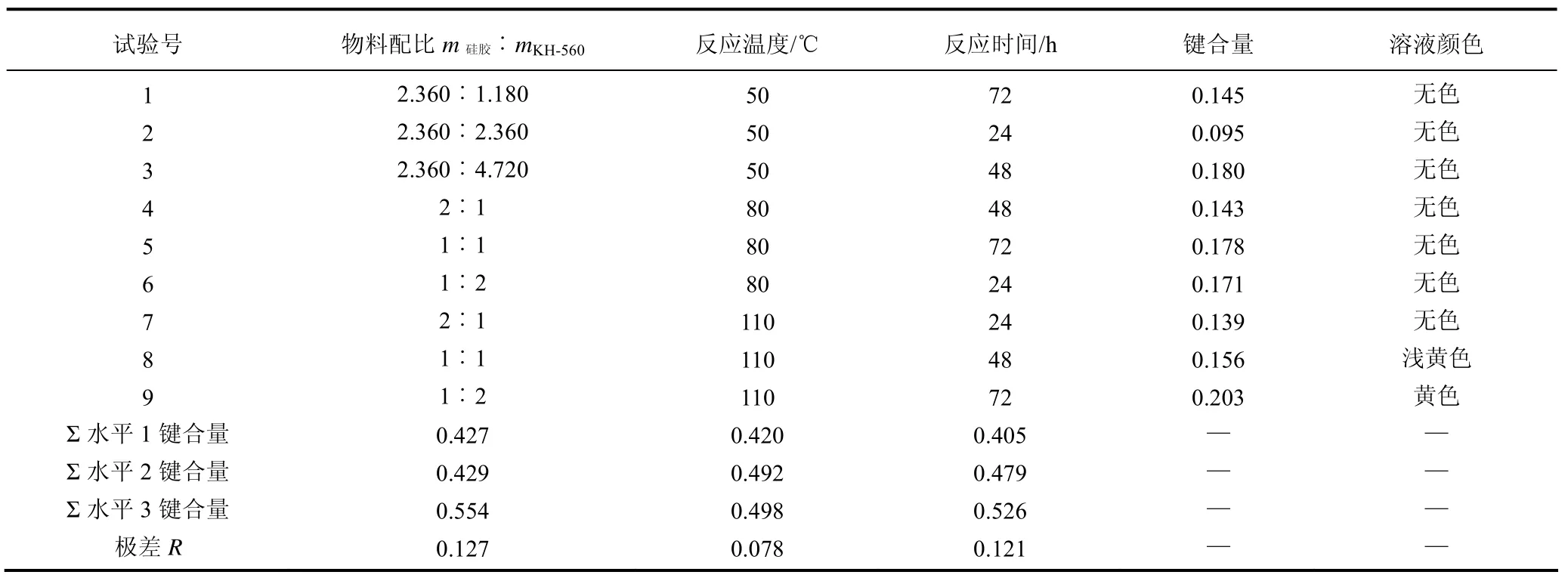
表4 正交实验结果
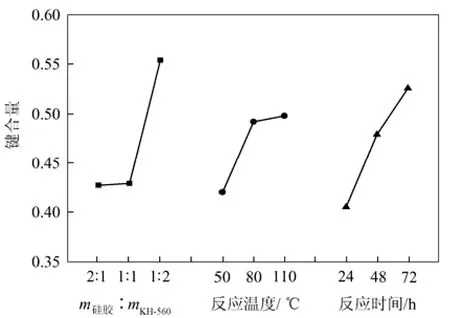
图4 各因素水平趋势图
图 4显示,在考察的水平范围内,KH-560用量的增加、反应温度的升高、反应时间的延长均能促进Σ键合量的增加。
当KH-560用量>1∶1时,Σ键合量增加显著,因此单因素实验主要考察KH-560用量>1∶1的条件,即考察 m硅胶∶mKH-560=1∶0.5、1∶1、1∶1.5、1∶2、1∶2.5、1∶3六个实验点。
当反应温度<80 ℃时,Σ键合量增加显著,但从表4的结果分析,溶液颜色变化主要跟温度有关,因此单因素实验考察40 ℃、50 ℃、60 ℃、70 ℃、80 ℃、90 ℃、100 ℃、110 ℃八个实验点。
反应时间在24~72 h之间对Σ键合量的影响近似直线。因此单因素实验考察12 h、24 h、36 h、48 h、60 h、72 h六个实验点。
2.5 单因素实验
2.5.1 KH-560用量对产物生成的影响
图5所示为硅胶2.360 g,按上述配比逐渐增加KH-560用量,在反应温度为110℃,反应时间为72 h条件下,硅胶键合量的变化规律(曲线a)及对照反应中KH-560分解转化率的变化规律(曲线b)。

图5 KH-560用量对键合量及自身分解转化率的影响
当m硅胶∶mKH-560<1∶2时,原料KH-560的增加对反应起促进作用,硅胶键合量随KH-560用量增加而增加;当m硅胶∶mKH-560<1∶2时,原料KH-560的增加对反应的促进作用不明显,硅胶键合量基本保持不变。
KH-560在110 ℃、反应72 h的条件下均发生了分解反应,如图6所示。但其转化率并不随用量的增加而发生变化,基本保持在5%~6%。
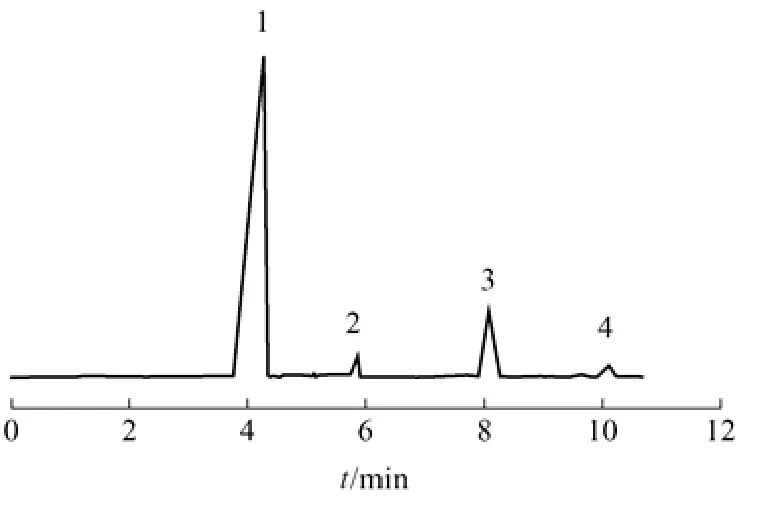
图6 对照反应KH-560的热分解气相色谱图
2.5.2 反应温度对产物生成的影响
图7所示为m硅胶∶mKH-560=1∶2、反应时间72 h时,在不同的温度下反应,硅胶键合量的变化规律(曲线a)及对照反应中KH-560分解转化率的变化规律(曲线b)。
图7曲线a显示,随着反应温度的升高,硅胶键合量在60 ℃之前及70 ℃以后增长缓慢,在60~70 ℃之间增长显著。这是因为甲醇沸点为64.8 ℃,当反应温度大于此温度时,反应生成的甲醇能迅速随氮气从反应体系挥发,从而促进了反应的进行。
图7曲线b显示,当温度<80 ℃时,作为对照的KH-560没有发生变化;当温度>90 ℃时,KH-560开始发生热分解反应,分解转化率随着反应温度的升高而升高。

图7 反应温度对键合量及KH-560分解转化率的影响
2.5.3 反应时间对产物生成的影响
图8所示为m硅胶∶mKH-560=1∶2,反应温度为110 ℃,在不同反应时间条件下,硅胶键合量的变化规律(曲线a)及对照反应中KH-560分解转化率的变化规律(曲线b)。

图8 反应时间对键合量及KH-560分解转化率的影响
图8曲线a显示,随着反应时间的延长,硅胶键合量逐渐增大。当反应时间低于36 h以及高于60 h 时,键合量的增长趋于平缓;当反应时间在36~60 h 时,键合量的增长显著。
图8曲线b显示,在反应温度为110℃条件下,反应时间低于36 h,作为对照的KH-560没有发生变化;反应时间高于48 h,KH-560发生分解,其转化率随反应时间的延长而升高。
综上所述,为避免KH-560发生热分解反应,又要有利于硅胶与KH-560的键合,其反应条件应控制:物料配比 m硅胶∶mKH-560=1∶2;反应温度控制在65~80 ℃;反应时间控制在48~72 h。考虑到反应温度的升高及反应时间的延长均可促进KH-560的分解,因此还应尽量避免反应温度高同时反应时间长的情况。
2.6 甲氧基参与程度的分析
分别以m硅胶∶mKH-560=1∶2,在65 ℃ 、反应72 h得产物A 2.787 g;以m硅胶∶mKH-560=1∶1,在80 ℃、反应48 h得产物B 2.749 g。通过元素分析仪测得原料硅胶、产物A和产物B的含碳量T[C]及含氢量T[H],再根据式(2)和式(3)计算产物在各种假设情况下的理论含氢量A c[H],列于表5。
表5表明,在不同的反应条件下所得硅胶键合产物含氢量,与1个甲氧基参与反应的理论含氢量非常接近。从数值上看,理论含氢量略微偏大,这是因为所得固体产物在过滤、洗涤等步骤中有少许损失,从而使代入计算的产物质量偏小所致。因此,可以确定硅胶与KH-560发生键合反应时,KH-560分子上只有1个甲氧基参与了反应。

表5 原料硅胶及产物C、H元素的分析结果
3 结 论
(1)气相色谱-标法用于本文检测 KH-560的定量分析方法是可靠的,当KH-560含量>10%时,测量结果的相对标准偏差<1%。同时 KH-560的平均回收率为100%。
(2)KH-560用量的增加、反应温度的升高、反应时间的延长均能促进硅胶和KH-560的键合。但反应温度过高、反应时间过长会导致KH-560的分解。
(3)适合硅胶和KH-560键合的反应条件是:m硅胶∶mKH-560=1∶2;反应温度65~80 ℃;反应时间48~72 h。该条件可避免KH-560的分解。
(4)通过元素分析所得含氢量与理论计算的氢含量比较,可以确定硅胶与KH-560发生键合反应时,KH-560分子上只有1个甲氧基参与了反应。
[1] 黄晓佳,王秋泉,王俊德,等.L-异亮氨酸型配体交换固定相对DL-氨基酸的拆分研究[J].色谱,2005,23(2):172-175.
[2] 阎国芳,李先国,沙春洁,等.键合硅胶的制备和应用研究进展[J].化工进展,2010,29(2):577-581.
[3] Gübitz G,Juffmann F.Direct separation of am ino enantionmers by high performance ligand exchange chromatography on chemically bonded chiral phases[J].Chromatographia,1982,16(12):103-106.
[4] Wachsmann M,Brückner H.Ligand-exchange chromatographic separation of DL-amino acids on aminopropylsilica-bonded chiral S-triazines[J].Chromatographia,1998,47(6):637-642.
[5] Pesek J J,Matyska M T. Evaluation of the silanization/hydrosilation process for the synthesis of chiral stationary phases[J].Chromatographia,2001,6:635-640.
[6] 吴邦桂,旷昌渝,黄天宝,等.高效配体交换色谱法直接拆分α-氨基酸对映体[J].分析化学,1991,19(3):291-296.
[7] Fu Chun Mei.Preparation of novel chiral stationary phase based on click chem istry for ligand exchange chromatography[J].Chinese Chemical Letters,2009,20:1345-1347.
[8] 祝馨怡.α-氨基酸在L-苯丙氨酸手性配体交换色谱固定相上的分离研究[J].化学试剂,2003,25(2):65-68.
[9] Pirkle William H. Useful and easily prepared chiral stationary phases for the direct chromatographic separation of the enantiomers of a variety of derivatized am ines, am ino acids, alcohols, and related compounds[J]. J. Org. Chem.,1986,51:4991-5000.
[10] Sadeghi Susan. Solid phase extraction using silica gel funcionalized w ith Sulfasalazine for preconcentration of uranium(Ⅵ) ions from water samples[J]. Microchim Acta,2008,163:313-320.
[11] Song Juan Rui. Preparation of new hybrid organic/inorganic polymeric chiral stationary phases for ligand-exchange chromatography[J]. Chinese Chemical Letters,2007,18:1250-1252.
[12] Mayani Vishal J,Abdi S H,Kureshy R I,et al. Synthesis and characterization of mesoporous silica modified w ith chiral auxiliaries for their potential application as chiral stationary phase[J] . Journal of Chromatography A,2008,1191(1-2):223-230.
Study on the reaction of type C silica gel and KH-560 coupling agent
LEI Ming,WANG Yan,ZHAO Hao,PENG Qijun
(School of Chemical and Material Engineering,Jiangnan University,Wuxi 214122,Jiangsu,China)
The bonded phase, 3-glycidoxypropyl silica gel, was prepared by the method of toluene reflux. The reaction conditions, including material ratio, reaction temperature and reaction time on the formation of bonded phase, were investigated through orthogonal test and one-factor test. The results indicated that the proper increasing of the content of KH-560, the reaction temperature and reaction time could promote the formation of bonded phase. But the results also showed that the overhigh reaction temperature and the overlong reaction time w ill cause the dissociation of KH-560. The suitable reaction conditions for the formation of silica gel and KH-560 bonded was:silica gel:KH-560 = 1:2 ( mass ratio); reaction temperature 65—80 ℃; reaction time 48—72 h. The decomposition of KH-560 can be avoided under this condition. Finally,compared w ith the hydrogen content between elemental analysis and theoretical calculation, it could be identified that there was only one methoxy group of the KH-560 molecule involved in the bonded reaction.
3-glycidoxypropyl silica gel;bonded phase;KH-560
TQ 031.2
A
1000-6613(2012)06-1263-06
2011-12-10;修改稿日期:2012-03-03。
雷鸣(1986—),男,硕士研究生。E-mail leim ing_213@126.com。联系人:彭奇均,教授。E-mail qjpeng@yahoo.com。
