丙烷催化脱氢反应宏观动力学模型
2012-10-19张海娟李江红张舒冬王振宇张喜文
张海娟,李江红,张舒冬,王振宇,张喜文
(中国石油化工股份有限公司抚顺石油化工研究院,辽宁 抚顺113001)
研究开发
丙烷催化脱氢反应宏观动力学模型
张海娟,李江红,张舒冬,王振宇,张喜文
(中国石油化工股份有限公司抚顺石油化工研究院,辽宁 抚顺113001)
在温度580~640 ℃、压力0.1 MPa、原料气空速1000~6000 h-1条件下,采用Pt-Sn催化剂,在固定床积分反应器中进行了丙烷催化脱氢实验,建立了脱氢反应宏观动力学模型。根据实验数据,采用多元线性回归分析得到宏观动力学模型的参数,丙烷脱氢反应的活化能约为 78.4 kJ/mol。经统计检验,结果表明所建立的丙烷催化脱氢宏观动力学方程是可靠的。
Pt-Sn催化剂;丙烷;脱氢反应;丙烯;宏观动力学模型
西气东输、川气东送等工程的实现,使天然气民用普及化,导致原来民用液化气逐渐向炼厂回笼。而且随着我国乙烯产能和炼油规模的不断扩大,液化气的总量也在持续的增长之中。因此,液化气的有效利用越来越受到人们的关注,现已成为石油化工领域的热点问题[1-2]。目前,C3和C4的综合利用是企业增效的有力途径和必要手段,也是寻求特色化工的最佳路线之一。而在诸多C3和C4的利用技术中,丙烷脱氢制丙烯技术尤显重要。
Pt-Sn催化剂和Cr-A l催化剂是丙烷催化脱氢常用催化剂。目前,Pt-Sn催化剂体系的丙烷脱氢动力学的研究相对很少[3-6]。本工作使用Pt-Sn催化剂,在固定床积分反应器中测定了丙烷催化脱氢反应速率,得到了丙烷催化脱氢反应宏观动力学模型,对丙烷脱氢反应催化剂的研发、反应器的选型和生产装置实现最佳化操作具有指导意义。
1 实验部分
1.1 试剂及催化剂
丙烷,纯度为99.9%,大连大特气体有限公司;氢气,纯度 99.99%,抚顺新港气体工业有限公司;Pt-Sn催化剂,自制,氧化铝为载体,Pt和Sn的负载量(质量分数)分别为1%和2%,采用浸渍法制备。
1.2 实验方法
反应器为φ10 mm×500 mm的石英管式固定床积分反应器,内插3 mm热电偶套管,外用电炉加热。由数显调节仪自动调节反应温度,控温精度±1℃。反应器内装催化剂 1.71~5.13 g,反应温度580~640 ℃,压力0.1 MPa。氢烃比(0.5∶1)~(2∶1)(摩尔比)的原料气经质量流量计计量后,进入反应器,反应产物经由气相色谱在线分析。丙烷的转化率、丙烯选择性及各组分分压由尾气各组分含量计算得到。
1.3 实验结果
动力学数据正式测定前,考察600 ℃、0.1 MPa条件下,催化剂装量分别为1.71 g、3.42 g、5.13 g时,1000~6000 h-1空速下丙烷转化率,结果显示转化率平均相对偏差为0.68%。由此说明,在选定的空速区,外扩散的影响基本消除,反应器壁效应对反应的影响不大。因此动力学实验条件选择在空速1000~6000 h-1,催化剂装量3.42 g。
Pt-Sn催化剂上丙烷催化脱氢生成丙烯反应的实验数据见表1。

表1 丙烷转化率、丙烯选择性和各分压的计算值
2 宏观动力学模型
2.1 丙烷脱氢反应体系
丙烷脱氢反应在热力学上是强吸热、分子数增加的可逆反应。在较高温度、没有催化剂存在的条件下,其结果接近热力学平衡状态。催化剂的存在使反应加速进行,但是逆反应仍然存在,因此主反应式考虑为可逆反应。而副反应则偏离平衡较远,按不可逆反应处理。所以反应系统简化为式(1)和式(2)为平行反应,式(2)和式(3)为连串反应。

同时,热力学分析结果显示,乙烯加成反应在实验温度内的反应平衡常数较丙烯加成反应大一个数量级,反应更易进行,因此将裂解产物作为一个整体进行分析,1mol丙烷生成2mol的裂解产物,这样反应式(2)和式(3)可以合并为式(4),代表所有碳原子数小于2的产物之和。

反应图式可简化为:
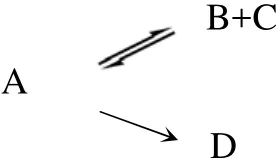
A、B、C、D分别代表体系中的丙烷、丙烯、氢气和裂解产物。
2.2 宏观动力学模型
由反应系统物料衡算可知,各分压与总压P、氢烃比n、转化率x和选择性s之间有如下关系:

系统共a-ax+axs+na+axs+2ax(1-s)=a(1+x+n)
当总压为P时,各组分分压见式(5)~式(8)。

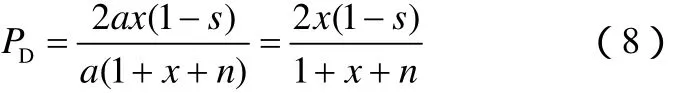
丙烷脱氢反应是可逆反应。根据反应式,可以写出速率方程,见式(9)~式(12)。
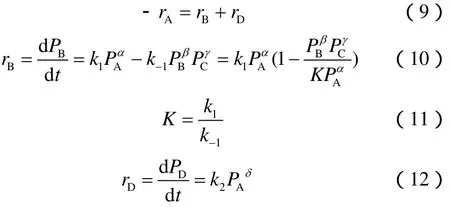
式中,rA是丙烷的消耗速率,rB是脱氢产物丙烯的生成速率,rD是裂解产物的生成速率,α是脱氢反应中对丙烷的反应级数,β是对丙烯的反应级数,γ是对氢气的反应级数,δ是裂解反应中对丙烷的反应级数。根据动态平衡原理,k1/k-1比即为平衡常数k,k只是温度的函数,取决于起始和最终状态,与反应进行过程无关。故如已知k1值,便可求出k-1。
式中系统压力P为0.1 MPa,氢烃比n为1,反应平衡常数k的值可由HSC5.0热力学计算软件计算得到。x和s为实验测量结果,α、β、γ、δ、k1、k2为待定参数。
3 模型参数估计与校验
3.1 脱氢反应动力学方程的非线性回归
由表1中的实验数据对模型参数进行估值,以x对W/F作图,使用指数衰减Exponential Decay1函数拟和,用Origin工具栏中的分析工具,analysis→mathmatics→differentiate,系统自动绘出拟合曲线的微分曲线,并给出各个点的微分值。各点斜率即为该点的速率值。拟合曲线见图1,拟合各参数值和标准差见表2。
3.2 参数拟合
在表1中可以看出,丙烯选择性均在97%以上,简化起见,动力学方程建立仅考虑主反应,不考虑丙烷裂解反应。方程回归采用七维高科公司开发的1stOpt1.0软件,它规避了非线性方程初值若选取不当,出现无法收敛,对拟合结果带来的不利影响。用1stOpt软件编写代码本进行拟合。
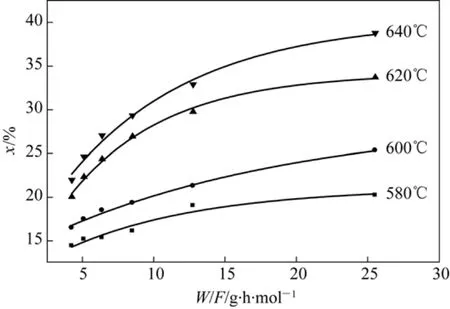
图1 不同温度的等温线形式

将Variable中的值依次复制到代码表中,按F9运行,结果见表3。
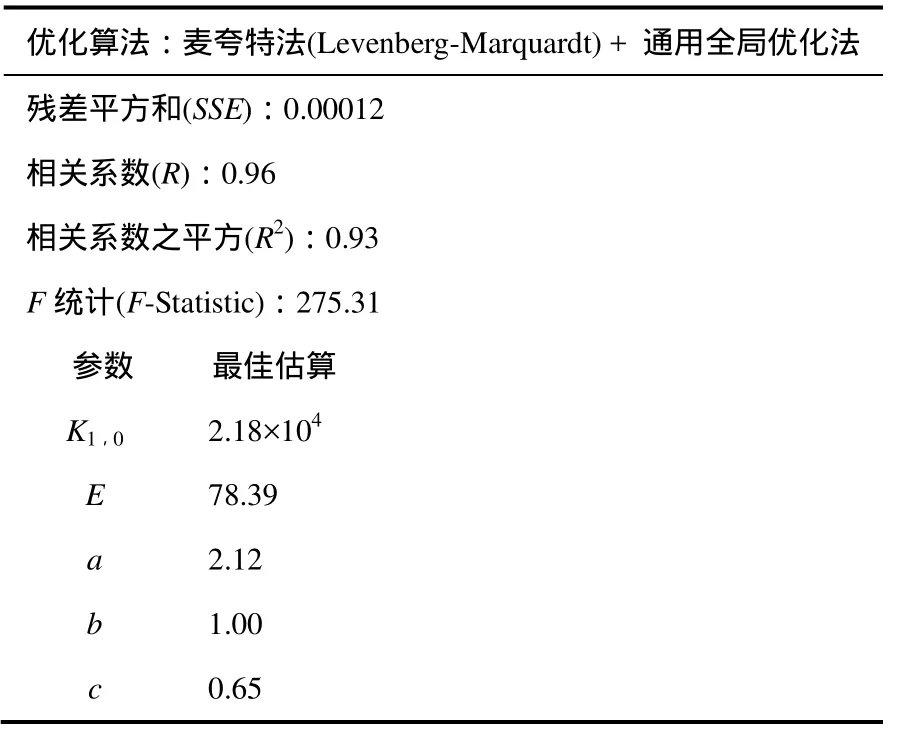
表3 动力学方程回归结果汇总
将参数进行圆整,即可得到动力学方程式(13)。


表2 不同温度下丙烯分压拟合曲线的参数值和标准差
3.3 参数检验
建立的模型要进行相关系数R2、FC方差检验及残差分布检验,以考察模型是否显著,残差分布是否合理,见式(14)、式(15)。一般认为相关系数R2>0.9,F检验值FC大于Fα(m,N-m-1),说明得到的模型在α水平上是显著可信的,其中N为实验点数,m为待估参数数目[7-11]。对于非线性方程,进行F检验需要加以安全系数,一般取10,即FC>10Fα,α一般取0.05、0.01对应于95%、99%的置信度,在本实验条件下,查得F0.05=2.55,F0.01=3.73。对实验点做残差分布,它们应随机落在模型计算值的两侧,或实验值与计算值呈对角线分布。
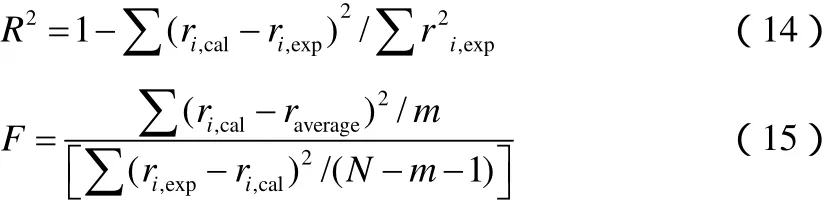
表2中已给出模型的相关系数R2=0.9260,满足R2>0.9的要求。F检验值FC=275.31,FC>10F0.05,FC>10F0.01。对实验点做残差分布,见图2。由图可见,所有数据点都分布在对角线附近,说明模型以及参数估值都是可靠的。
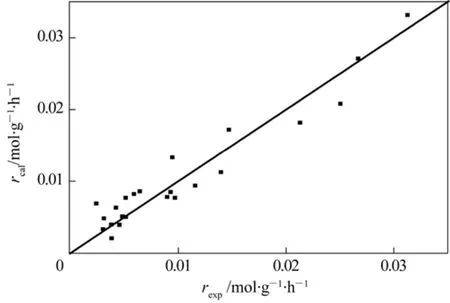
图2 非线性回归模型的残差分析
4 结 论
经过参数检验,丙烷脱氢反应模型有较好的可靠性。对丙烷裂解副反应进行动力学研究较少,对丙烷脱氢反应进行研究则较多。与文献资料计算的活化能数据进行对比,文献[5]在Pt-Sn系催化剂上进行丙烷脱氢反应本征动力学研究,获得活化能数值为40.6 kJ/mol。文献[6]在Pt-Sn系催化剂上进行宏观动力学研究,获得活化能数值为62.7 kJ/mol。本实验在Pt-Sn系催化剂上进行宏观动力学研究,获得活化能数值为78.4kJ/mol,与文献值相差不大,可视为合理。
符 号 说 明
E——Arrhenius方程中的活化能,kJ/mol
F——丙烷进料的摩尔流量,mol/h
K1,0——Arrhenius方程中的频率因子
PA——丙烷的分压,kPa
PB——丙烯的分压,kPa
PC——氢气的分压,kPa
r——反应速率,mol·h-1·g-1
S——丙烯的选择性,%
W——催化剂质量,g
x——丙烷的转化率,%
α——丙烷脱氢反应的指数项
β——丙烯的指数项
γ——氢气的指数项
δ——丙烷裂解反应的指数项
[1] 刘淑鹤,方向晨,张喜文,等. 丙烷脱氢催化反应机理及动力学研究进展[J]. 化工进展,2009,29(2):259-266.
[2] 谭晓林,马波,张喜文,等. Cr 系丙烷脱氢催化剂研究进展[J]. 化工进展,2010,29(1):51-56.
[3] Airaksinen S M K,Elina Harlin M,Krause A O I. Kinetic modeling of dehydrogenation of isobutane on chromia/alumina catalyst [J].Ind. Eng. Chem. Res.,2002,41(23):5619-5626.
[4] 陈海松,余立新,徐海升,等. 稀土助剂改良的铬铝催化剂上丙烷脱氢宏观动力学[J].高校化学工程学报,1999,13(1):38-43. [5] 陈光文,阳永荣,戎顺熙. 在Pt-Sn/Al2O3催化剂上丙烷脱氢反应动力学[J]. 化学反应工程与工艺,1998,14(2):132-137.
[6] Suttichai A. Kinetics for dehydrogenation of propane on Pt-Sn-K/Al2O3catalyst [J].J. Chem. Eng. Jap.,2000,33(2):529-532.
[7] 李宏燕,丁莉君.气固相催化反应动力学方程的推导新思路[J]. 石油与天然气化工,2008,37(3):191-195.
[8] 张文彬,权霞,墨玉欣,等. Ti-MWW催化烯丙醇环氧化制环氧丙醇的动力学研究[J]. 福州大学学报:自然科学版,2004,34(4):607-611.
[9] 张卿,李涛,郑起,等. FBD变换催化剂反应动力学Ⅰ. 本征动力学研究[J]. 华东理工大学学报,2003,29(3):217-220.
[10] 吴倩,王弘轼,朱炳辰,等. 甲醇催化重整制氢的宏观反应动力学[J]. 石油化工,2003,32(6):483-486.
[11] 卢定强, 涂清波,凌岫泉,等. 响应曲面法优化(salen)Co(Ⅲ)(OAc)拆分手性环氧氯丙烷的制备工艺[J]. 化工进展,2010,29(2):313-318.
M acro kinetics of catalytic dehydrogenation of propane on p latinum-stannum catalyst
ZHANG Haijuan,LI Jianghong,ZHANG Shudong,WANG Zhenyu,ZHANG Xiwen
(Fushun Research Institute of Petroleum and Petrochem icals,SINOPEC,Fushun 113001,Liaoning,China)
The experiment of catalytic dehydrogenation of propane on platinum-stannum catalyst was performed w ith integral fixed-bed reactor,under the reaction conditions of temperature of 580—640 ℃,pressure of 0.1 MPa and space velocity of 1000—6000 h-1. The rate equation on macro kinetics of catalytic dehydrogenation of propane was obtained. Through fitting experimental results,the parameters of macro kinetic were determ ined by the method of multiple liner regression. The activation energy of dehydrogenation of propane reaction was about 78.4 kJ/mol. The results of statistic test on macro kinetics model showed that the rate equation was rational and reliable.
Pt-Sn catalyst;propane;dehydrogenation;propylene;macro kinetics model
TQ 203.2
A
1000–6613(2012)07–1464–04
2012-02-02;修改稿日期:2012-02-29。
及联系人:张海娟(1973—),女, 博士,高级工程师。E-mail zhanghaijuan.fshy@sinopec.com。
