温莪术不同溶剂提取物体外抗氧化活性评价
2012-10-18娄依依陈瑞峰李丽丽高红昌李校堃
娄依依,向 铮,陈瑞峰,李丽丽,高红昌*,李校堃
(温州医学院药学院,浙江 温州 325035)
温莪术不同溶剂提取物体外抗氧化活性评价
娄依依,向 铮,陈瑞峰,李丽丽,高红昌*,李校堃
(温州医学院药学院,浙江 温州 325035)
目的:探讨温莪术不同溶剂提取物体外的抗氧化活性。方法:分别用蒸馏水、95%乙醇、乙酸乙酯等不同极性溶剂提取温莪术中活性物质,采用清除1,1-二苯基-2-三硝基苯肼(DPPH)自由基、羟自由基(·OH)、亚铁离子螯合和还原能力等方法考察温莪术不同提取物的抗氧化活性。同时用Folin-Cioeaile法测定不同提取物中的总酚含量,考察总酚含量与抗氧化清除率的关系。结果:DPPH自由基、·OH清除能力及还原能力结果表明95%乙醇及乙酸乙酯提取物在较低的质量浓度显示了较高的清除率;同时总酚含量测定结果显示95%乙醇和乙酸乙酯提取物所含总酚含量较高,这表明这两种溶剂提取物的抗氧化性与其提取物含有较高的酚类密切相关;亚铁离子螯合实验结果显示水提物的螯合效果优于其他溶剂提取物。结论:不同溶剂提取物抗氧化能力差别较大,总酚含量与抗氧化清除率具有相关性。
温莪术;DPPH自由基;羟自由基;亚铁离子螯合;还原能力;Folin-Cioeaile
人体内产生的活性氧/氮是许多老年性疾病产生的重要原因,例如癌症、动脉粥样硬化、心血管疾病、免疫系统衰退及大脑功能障碍等疾病都与人体产生的活性氧自由基密切相关[1]。人体在新陈代谢过程中会产生大量的自由基,如超氧阴离子自由基(O2·)、羟自由基(·OH)、过氧化氢自由基等,它们具有强氧化性,损害机体的组织和细胞[2]。有报道称,一些蔬菜和水果可以降低老年性疾病的发生率和死亡率,这可能与它们含有的抗氧化成分有关[3]。目前大部分人工合成抗氧化剂如丁羟苯甲醚(BHA)和丁羟甲苯(BHT)作为食品添加剂使用。近年来,世界卫生组织(FAO/WHO)、欧共体儿童保护组织(HACSG)、日本、美国政府和相关国际组织的研究表明,合成抗氧化剂存在诸多副作用,如对人体的肝、脾、肺均有不利影响,甚至会诱发恶性肿瘤等[4],因此美国食品药品管理局(FDA)建议在一般认为安全的物质中删去BHT;日本卫生部门也曾禁止使用BHA。事实也表明,在人们长期食用的食品中,天然抗氧化剂成分的毒性远远低于人工合成抗氧化剂的毒性。因此,近年来从自然界寻求天然、安全的抗氧化剂已引起各国科学家的高度重视。
温莪术为姜科植物温郁金(Curcuma wenyujin)的根茎,是著名的浙八味之一。近年来研究发现,温莪术中主要成分之一姜黄素能有效抑制糖尿病大鼠的脂质过氧化和蛋白质氧化,改变其抗氧化酶活性,减少氧化应激对糖尿病的影响[5];姜黄根茎己烷及水提物在清除1,1-二苯基-2-三硝基苯肼(DPPH)自由基上表现出较强的抗氧化活性[6-7];蓬莪术挥发油也具有较好的清除DPPH自由基能力和抑制脂质过氧化作用[8];莪术多糖对·OH和O2·有一定的清除作用,且能显著增加SOD的活性[9]。温莪术与姜黄、蓬莪术同属姜科植物,且含有较多的姜黄素、莪术多糖等成分,因此有必要研究其抗氧化能力以考察其在食品工业中的应用潜力。本实验运用DPPH自由基、Fenton、亚铁离子螯合和Fe3+还原等方法考察温莪术不同极性溶剂提取物体外抗氧化能力,为从温莪术中提取天然安全的抗氧化活性物质提供理论依据。
1 材料与方法
1.1 材料与试剂
温莪术药材于2010年1月采自温州瑞安沙洲温郁金GAP示范基地,经温州医学院药学院中药学教研室鉴定为姜科植物温郁金(Curcuma wenyujin)的干燥根茎,药名为温莪术。
没食子酸对照品(纯度≥98%) 中国药品生物制品检定所; Folin-Ciocalteu、丁羟基茴香醚(BHA)、亚铁嗪、脱氧核糖 美国Sigma公司;FeSO4·7H2O、铁氰化钾、乙二胺四乙酸(EDTA)、磷酸氢二钠、磷酸二氢钠、三氯醋酸、氯化铁、H2O2、硫代巴比妥酸(均为国产分析纯试剂) 国药集团化学试剂有限公司。
1.2 仪器与设备
SpectraMax M2/M2e多功能酶标仪 美国分子仪器公司;AL204精密电子天平 梅特勒-托利多仪器(上海)有限公司;DK-98-11电热恒温水浴锅 天津市泰斯特仪器有限公司;BUCHI R205-V800旋转蒸发仪 瑞士Buchi公司;SK8210HP超声波振荡仪 上海科导超声仪器有限公司;XW-80A旋涡混合器 上海医科大学仪器厂。
1.3 提取与制备
温莪术干燥粉碎,取25g,分别用蒸馏水、95%乙醇、乙酸乙酯各100mL索氏提取4h(煮沸后)。减压浓缩至10mL,得到不同溶剂提取物。置于-4℃冰箱中保存备用。
1.4 总酚含量测定[10]
总酚含量用Folin-Ciocalteu试剂测定。标准液的配制:准确称取2.5mg没食子酸标准品,蒸馏水溶解并定容至25mL,得质量浓度为0.1mg/mL的标准液。
标准曲线的建立:分别准确量取上述标准液0.2、0.4、0.6、0.8、1.0mL于10mL棕色容量瓶中,加6mL水,摇匀,再加0.5mL Folin-Ciocalteu试剂,充分摇匀。1min后,加入1.5mL 20g/100mL Na2CO3溶液,混匀定容,室温下反应2h(避光)。得没食子酸质量浓度为0.002、0.004、0.006、0.008、0.010mg/mL的对照品溶液,于波长760nm波长处检测,以蒸馏水为空白,用吸光度对没食子酸质量浓度绘制标准曲线,得回归方程。
样品的测定:用移液枪移取制备好的样品溶液1mL于10mL容量瓶中,加6mL水,摇匀,再加0.5mL Folin-Ciocalteu试剂,充分摇匀。1min后,加入1.5mL 20g/100mL Na2CO3溶液,混匀定容,室温下反应2h(避光),于760nm波长处测定样品的吸光度,根据标准曲线得出相应的没食子酸质量浓度,按式(1)计算出样品中总酚的含量,结果用mg 没食子酸/g(以干基计)表示。

式中:C为总酚含量/(mg/g);ρ为没食子酸质量浓度/(mg/mL);V为取样体积/mL;n为稀释倍数;m为样品总的取样量/g。
1.5 抗氧化活性测定
1.5.1 清除DPPH自由基测定[8]
2mL不同质量浓度样品溶液 (0~40mg/mL) 与1mL 0.2mmol/L DPPH甲醇溶液混合,剧烈振荡后置暗处30min,在517nm波长处测得样品吸光度。以样品本身溶剂为空白样本,每个样品质量浓度平行3次,取平均值。以丁羟基茴香醚(BHA)为阳性对照,对DPPH自由基的清除率按式(2)计算。
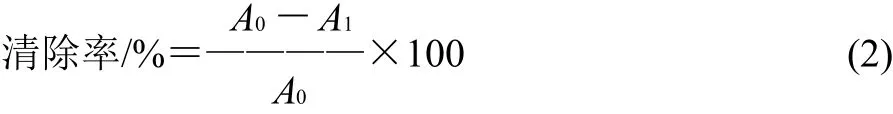
式中:A0为空白样本吸光度;A1为测试样本吸光度。
EC50值定义为清除50%自由基所需的样品质量浓度,其计算是通过获得的抑制DPPH自由基回归方程所得。
1.5.2 清除·OH测定[11]
取0.2mL 3mmol/L FeSO4-EDTA混合液于试管中,依次加入0.5mL 5mmol/L 脱氧核糖,1.5mL不同质量浓度样品溶液 (0~5mg/mL),0.6mL 20mmol/L pH 7.4 磷酸缓冲液(PBS),0.2mL 3mmol/L H2O2,混合均匀后置于37℃恒温水浴中反应1h,然后加入1mL 2.8g/100mL三氯醋酸(TCA)溶液和1mL 1%硫代巴比妥酸(TBA)溶液,混匀后置于沸水浴中反应15min,冷却后于波长532nm处测得样品吸光度。以样品本身溶剂为空白样本,每个样品平行3次,取平均值。以丁羟基茴香醚(BHA)为阳性对照,对·OH的清除率按式(2)计算。
1.5.3 亚铁离子螯合实验[12]
1mL不同质量浓度样品溶液 (0~40mg/mL) 与3.7mL甲醇和0.1mL 2mmol/L FeSO4·7H2O混合,反应30s后,加入0.1mL 5mmol/L 亚铁嗪,混合均匀后室温下反应10min,在波长562nm处测得样品吸光度。以样品本身溶剂为空白样本,每个样品平行3次,取平均值。以乙二胺四乙酸(EDTA)为阳性对照,对亚铁的螯合率按式(3)计算。

式中:A0为空白样本吸光度;A1为测试样本吸光度。
1.5.4 Fe3+还原力实验[13]
于试管中依次加入2.5mL 1%铁氰化钾溶液,2.5mL 200mmol/L、pH 6.6的磷酸缓冲液,2.5mL不同质量浓度样品溶液(0~10mg/mL),混合均匀后置于50℃恒温水浴中反应20min,快速冷却,加入2.5mL 10%三氯醋酸溶液,充分混匀在3000r/min离心10min,取5mL上清液与等量的蒸馏水,1mL 0.1%氯化铁溶液混匀,10min后于700nm波长处测得样品吸光度,吸光度越大则还原能力越强。以样品本身溶剂为空白样本,每个样品平行3次,取平均值。以丁羟基茴香醚(BHA)为阳性对照。
1.6 统计学分析
应用SPSS13.0软件进行统计学处理,重复实验所得数据采用独立样本t检验分析,结果以表示。抗氧化活性和总酚含量间的相关性采用Spearman秩相关进行分析。
2 结果与分析
2.1 总酚含量测定
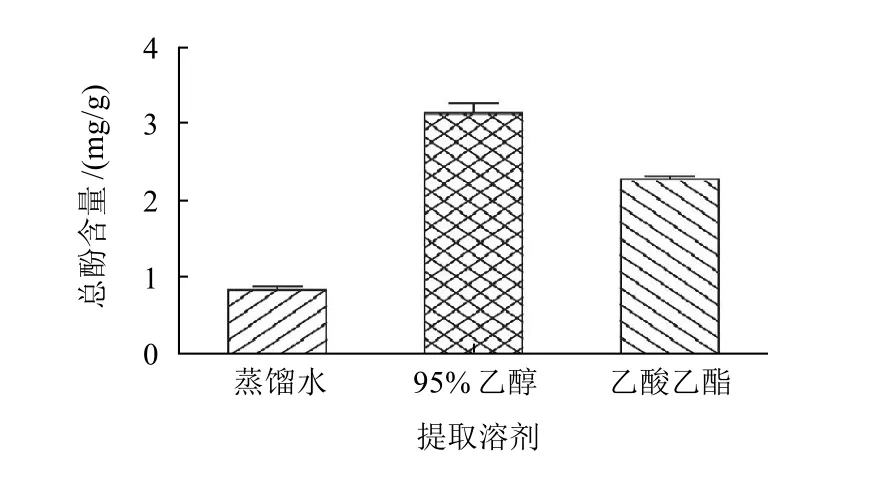
图1 不同溶剂提取物的总酚含量Fig.1 Total phenol contents in different solvent extracts from C. wenyujin root tubers
以吸光度为纵坐标,没食子酸质量浓度为横坐标,建立标准曲线。 结果表明,没食子酸在质量浓度0~0.01mg/mL内与其吸光度呈线性关系,线性回归方程为Y=43.0230X+0.0024(R2=0.9998)。
由图1可知,温莪术提取物的总酚含量随提取溶剂的不同而有所变化。95%乙醇提取物的总酚含量最高(3.11mg/g),水提取物的总酚含量最低(0.84mg/g)。
2.2 温莪术提取物对DPPH自由基及·OH的清除作用
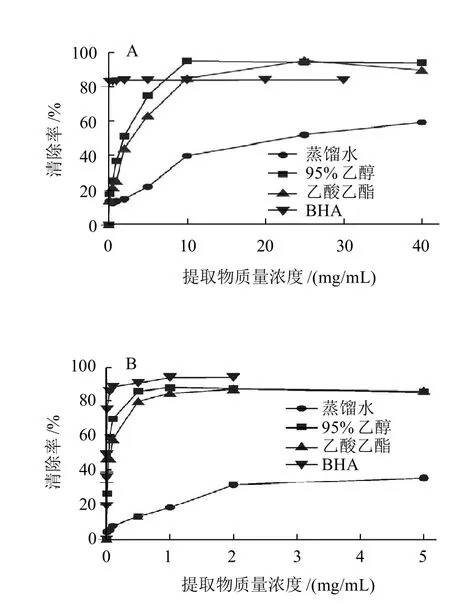
图2 不同溶剂提取物对DPPH自由基(A)及·OH(B)的清除能力Fig.2 Scavenging capacity of different extracts from C. wenyujin root tubers against DPPH and hydroxyl free radicals
DPPH自由基是一种比较稳定的氮中心的自由基,广泛用于筛选蔬菜水果、植物提取物及食品的体外抗氧化活性[14]。由图2A可知,不同极性提取物对DPPH自由基表现出的清除能力强弱不一,其中95%乙醇提取物对DPPH自由基的清除能力最强。在0~5mg/mL时,BHA的清除能力要远远大于3种提取物;当质量浓度升高到10mg/mL时,95%乙醇提取物对DPPH自由基的清除率达到了95%,且高于BHA;乙酸乙酯提取物的清除能力稍低于95%乙醇,但比水提取物高。各提取物及BHA的EC50值范围为0.004~20.856mg/mL。95%乙醇提取物的EC50值要小于其他提取物,且在高质量浓度时,其对DPPH自由基的清除能力要比BHA好;水提物的EC50值最大。EC50值越大,表明清除能力越小。因此,各提取物对DPPH自由基的清除能力大小依次为:95%乙醇提取物>乙酸乙酯提取物>水提取物。
·OH是已知的最活泼的活性氧自由基,也是毒性最大的氧自由基,具有攻击大多数生物底物(如DNA、多不饱和脂肪酸、蛋白质等)的能力,会引起脂质过氧化作用及造成生物损伤[15-16]。由图2B可知,在较低质量浓度下,95%乙醇和乙酸乙酯提取物均对·OH均表现出较好的清除能力,稍低于BHA。95%乙醇提取物在0.5mg/mL时清除率达到了85%;乙酸乙酯提取物清除能力在0~2mg/mL稍低于95%乙醇提取物,但在2~5mg/mL与95%乙醇提取物清除能力相当,均远高于水提取物。各提取物及BHA的EC50值范围为0.003~6.948mg/mL。95%乙醇提取物与乙酸乙酯提取物的EC50值相近,但高于BHA;水提取物的EC50值最大。因此,各提取物对·OH清除能力大小依次为: 95%乙醇提取物>乙酸乙酯提取物>水提取物。
2.3 温莪术提取物对亚铁离子的螯合作用和对Fe3+还原力
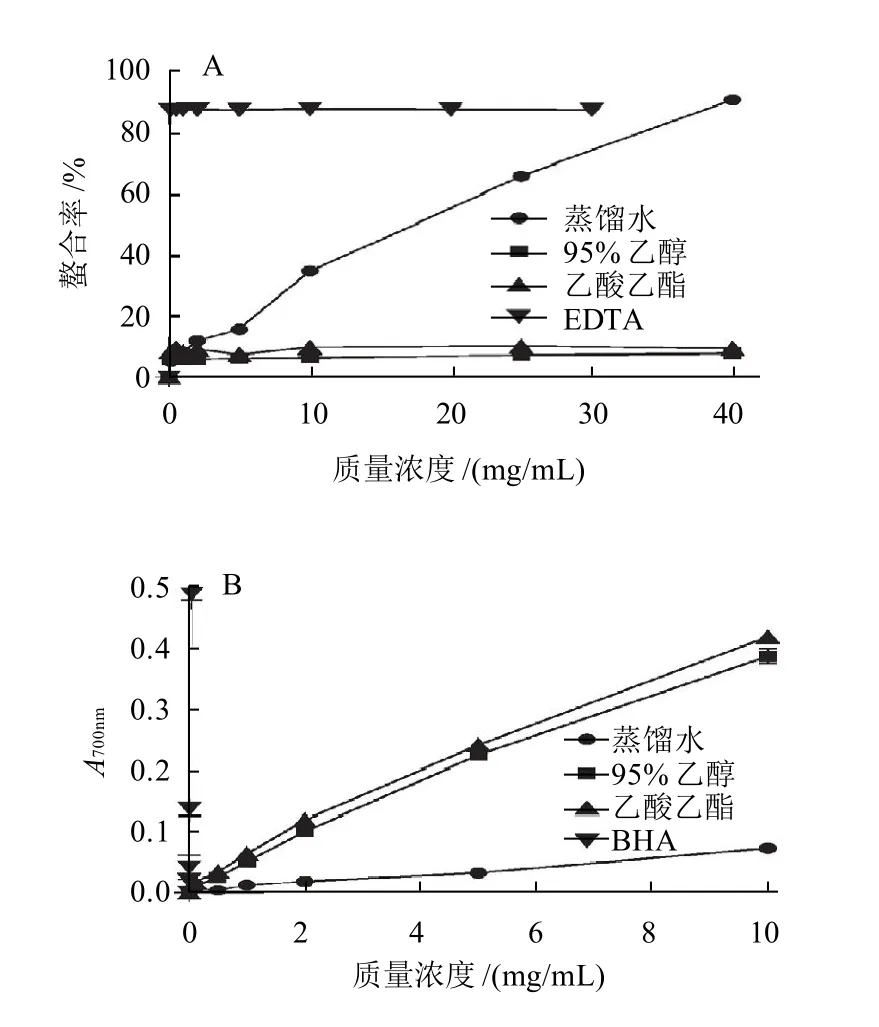
图3 不同溶剂提取物对亚铁离子的螯合作用(A)及对铁离子的还原能力(B)Fig.3 Ferrous ion-chelating capacity and reducing power of different extracts from C. wenyujin root tubers
铁因其高反应活性,被认为是脂质氧化的重要促进剂。对亚铁离子的螯合,可以保护因铁引起的氧化损伤[17]。由图3A可知,各提取物中只有水提取物对亚铁离子表现出较好的螯合作用,95%乙醇及乙酸乙酯提取物几乎没有作用。这可能与水提取物中含有较多的多糖类等水溶性成分有关。有研究表明,多糖能通过与产生活性氧(ROS)所必需的金属离子发生螯合作用,对ROS起间接清除作用,从而达到抗氧化目的[18]。
还原能力的测定可检验化合物是否为良好的电子供体,体系中Fe3+还原为Fe2+,使溶液颜色从黄色变为绿色,即表明体系中的氧化还原状态。吸光度越大,还原力越强,抗氧化效果越好。由图3B可知,BHA在极低的质量浓度下就有较好的还原能力;95%乙醇和乙酸乙酯提取物的还原能力相近,均远高于水提取物;并且在实验质量浓度范围内,3种提取物均表现出一定程度的量效关系。各提取物的还原能力大小依次为:乙酸乙酯提取物>95%乙醇提取物>水提取物。
2.4 温莪术提取物抗氧化活性和总酚含量间的相关性
抗氧化活性和总酚含量的相关性采用SPSS软件中的Spearman秩相关进行分析,结果显示两者的相关系数为0.792(P<0.01),这表明温莪术各提取物抗氧化活性的强弱与其酚类含量有着显著的相关性,即提取物中总酚含量的多少直接反映了提取物的抗氧化能力的强弱。95%乙醇及乙酸乙酯提取物总酚含量较高,因此也具有较高的抗氧化活性。这可能主要是由于这两种提取物中含有较多的酚类化合物。酚类是植物抗氧化活性的主要化合物之一,已有报道指出,不同蔬菜提取物中酚类含量与抗氧化活性有着显著的相关性[19]。酚类化合物的抗氧化活性主要是由于其氧化还原性质[20],酚类化合物具有较强的清除自由基能力,是通过提供氢原子作为自由基的受体,以此阻断连锁氧化反应来达到抗氧化作用[21]。
3 结 论
4种体外抗氧化活性评价方法的结果表明,在同一个抗氧化评价方法中,不同溶剂提取物的抗氧化能力存在较大差异。从DPPH自由基和·OH的清除率和EC50值看,温莪术各提取物对·OH的清除作用优于DPPH自由基,其中95%乙醇和乙酸乙酯提取物有较强的清除能力,水提取物的清除能力相对较弱;在还原能力大小的测定实验中,95%乙醇与乙酸乙酯提取物的还原能力高于水提取物的还原能力;而在亚铁离子螯合实验中,水提取物的螯合能力则远比其他两者都要强,并在一定程度上高于阳性对照EDTA。此外,总酚含量测定结果显示,95%乙醇及乙酸乙酯提取物的总酚含量高于水提物,各提取物抗氧化活性的强弱与其酚类含量相关性进行分析,证实两者具有显著的相关性,这也说明酚类是植物抗氧化活性的化合物之一。
随着社会的发展,人们越来越注重自身的健康和食品的营养,合成抗氧化剂因其潜在的毒副作用对人类的安全造成威胁,而植物提取物因其天然、安全受到人们的青睐。研究表明温莪术95%乙醇及乙酸乙酯提取物中的活性组分在较低的质量浓度时具有较好的抗氧化活性,能有效清除各种自由基,这表明其提取物中可能含有具有延缓机体衰老、预防心血管疾病的活性成分,这为温莪术开发其药用保健价值提供了重要参考。
[1] ATOUI A K, MANSOURI A, BOSKOU G, et al. Tea and herbal infusions∶their antioxidant activity and phenolic profile[J]. Food Chemistry, 2005,89(1)∶ 27-36.
[2] GULCIN I. Antioxidant and antiradical activities ofL-carnitine[J]. Life Sciences, 2006, 78(8)∶ 803-811.
[3] SZETO Y T, CHU W K, BENZIE I F F. Antioxidants in fruits and vegetables∶ a study of cellular availability and direct effects on human DNA[J]. Bioscience Biotechnology and Biochemistry, 2006, 70(10)∶2551-2555.
[4] TEPE B, SOKMEN M, SOKMEN A, et al. Antimicrobial and antioxidative activity of the essential oil and various extracts ofCyclotrichium origanifolium(Labill.) Manden. & Scheng.[J]. Journal of Food Engineering, 2005, 69(3)∶ 335-342.
[5] SURYANARAYANA P, SATYANARAYANA A, BALAKRISHNA N,et al. Effect of turmeric and curcumin on oxidative stress and antioxidant enzymes in streptozotocin-induced diabetic rat[J]. Medical Science Monitor, 2007, 13(12)∶ 286-292.
[6] CHOI H Y. Antioxidant activity ofCurcuma longaL., novel foodstuff[J]. Molecular & Cellular Toxicology, 2009, 5(3)∶ 237-242.
[7] VANKAR P S. Effectiveness of antioxidant properties of fresh and dry rhizomes ofCurcuma longa(long and short varieties) with dry turmeric spice[J]. International Journal of Food Engineering, 2008, 4(8)∶ 157-160.
[8] MAU J L, LAI E Y C, WANG N P, et al. Composition and antioxidant activity of the essential oil fromCurcuma zedoaria[J]. Food Chemistry,2003, 82(4)∶ 583-591.
[9] 王关林, 宋扬, 罗红梅. 莪术多糖对雏鸡抗氧化能力和免疫功能的影响[J]. 畜牧兽医学报, 2006, 37(11)∶ 1184-1188.
[10] BAJPAI V K, AL-REZA S M, CHOI U K, et al. Chemical composition,antibacterial and antioxidant activities of leaf essential oil and extracts ofMetasequioa glyptostroboidesMiki ex Hu[J]. Food and Chemical Toxicology, 2009, 47(8)∶ 1876-1883.
[11] STOILOVA I, KRASTANOV A, STOYANOVA A, et al. Antioxidant activity of a ginger extract (Zingiber officinale)[J]. Food Chemistry,2007, 102(3)∶ 764-770.
[12] COUSINS M, ADELBERG J, CHEN F, et al. Antioxidant capacity of fresh and dried rhizomes from four clones of turmeric (Curcuma longaL.)grownin vitro[J]. Industrial Crops and Products, 2007, 25(2)∶ 129-135.[13] SHON M Y, LEE J, CHOI J H, et al. Antioxidant and free radical scavenging activity of methanol extract of chungkukjang[J]. Journal of Food Composition and Analysis, 2007, 20(2)∶ 113-118.
[14] SANCHEZ-MORENO C. Review∶ methods used to evaluate the free radical scavenging activity in foods and biological systems[J]. Food Science and Technology International, 2002, 8(3)∶ 121-137.
[15] SASAKI S, OHTA T, DECKER E A. Antioxidant activity of watersoluble fractions of salmon spermary tissue[J]. Journal of Agricultural and Food Chemistry, 1996, 44(7)∶ 1682-1686.
[16] AURAND L W, BOONE N H, GIDDINGS G G. Superoxide and singlet oxygen in milk lipid peroxidation[J]. Journal of Dairy Science,1977, 60(3)∶ 363-369.
[17] KEHRER J P. The Haber-Weiss reaction and mechanisms of toxicity[J].Toxicology, 2000, 149(1)∶ 43-50.
[18] 罗祖友, 吴季勤, 吴谋成. 植物多糖的抗氧化与抗病毒活性[J]. 湖北民族学院学报, 2007, 25(1)∶ 77-81.
[19] VELIOGLU Y S, MAZZA G, GAO L, et al. Antioxidant activity and total phenolics in selected fruits, vegetables, and grain products[J]. Journal of Agricultural and Food Chemistry, 1998, 46(10)∶ 4113-4117.
[20] GALATO D, CKLESS K, SUSIN M F, et al. Antioxidant capacity of phenolic and related compounds∶ correlation among electrochemical,visible spectroscopy methods and structure-antioxidant activity[J]. Redox Report, 2001, 6(4)∶ 243-250.
[21] GRAMZA A, KHOKHAR S, YOKO S, et al. Antioxidant activity of tea extracts in lipids and correlation with polyphenol content[J]. European Journal of Lipid Science and Technology, 2006, 108(4)∶ 351-362.
Antioxidant Activitiesin vitroof Different Solvent Extracts fromCurcuma wenyujinRoot Tubers
LOU Yi-yi,XIANG Zheng,CHEN Rui-feng,LI Li-li,GAO Hong-chang*,LI Xiao-kun
(Pharmacy School, Wenzhou Medical College, Wenzhou 325035, China)
Objective∶ To explore thein vitroantioxidant activities of different solvent extracts from the root tubers ofC. wenyujin.Methods∶ The root tubers ofC. wenyujinwere extracted with solvents of different polarity, such as distilled water, 95% ethanol and ethyl acetate, respectively. The resulting extracts were assessed for antioxidant properties, such as DPPH free radical scavenging activity, hydroxyl free radical scavenging activity, ferrous ion-chelating capacity and reducing power. Meanwhile,the total phenol contents of the extracts were determined by the Folin-Ciocaile method and the correlation between total phenol content and antioxidant properties was analyzed. Results∶ The 95% ethanol and ethyl acetate extracts showed high free radical scavenging activity at low concentrations and had higher total phenol content than the distilled water extract. Therefore, the powerful antioxidant activity of the 95% ethanol and ethyl acetate extracts is immediately linked to their higher total phenol content. However, their ferrous ion-chelating capacity was inferior to that of the distilled water extract. Conclusions∶ The different solvent extracts from the root tubers ofC. wenyujinshow a considerable difference in their antioxidant activities and a correlation between their total phenol content and antioxidant properties.
Curcuma wenyujin;DPPH free radical;hydroxyl radicals;ferrous ion-chelating capacity;reducing power;Folin-Cioeaile method
Q949.71
A
1002-6630(2012)03-0039-05
2011-02-22
温州医学院科研启动经费项目(QTJ08008);浙江省中医药科技计划项目(2009YB021;2010ZB087)
娄依依(1987—),女,硕士研究生,主要从事中药活性成分研究。E-mail:yi1987yi@yahoo.com.cn
*通信作者:高红昌(1979—),男,副教授,博士,主要从事中医药的代谢组学研究。E-mail:gaohc27@gmail.com
