人参皂苷Rg3调控WNT/β-catenin信号通路抑制结肠癌细胞生长的实验研究
2012-10-17何运元赵琳琳徐学军
何运元,王 营,王 黎,赵琳琳,徐学军
(1.徐州医学院,江苏徐州271000;2.郑州大学基础医学院,河南 郑州450052)
人参皂苷Rg3是从天然红参中提取的单体,近年来的研究[1-2]表明人参皂苷Rg3具有抑制肿瘤细胞增殖和血管形成的作用,且可在多种肿瘤细胞株中诱导细胞凋亡,抑制肿瘤细胞的黏附、侵袭,阻止肿瘤转移的发生。目前,人参皂苷Rg3对于肿瘤细胞作用的分子机制仍未完全阐明。但研究[3-4]显示人参皂苷Rg3对Wnt/β-catenin信号通路的调节是其发挥抗肿瘤功能的重要途径,其既能促进β-catenin参与细胞黏附作用,又能抑制β-catenin的核内转移。而异常激活的Wnt/β-catenin信号通路造成大量β-catenin在核内堆积是许多肿瘤组织突出的分子标志之一。β-catenin在细胞中有2个去向。β-catenin可与α-catenin和细胞膜上的E-钙黏素形成复合体,并与细胞内肌动蛋白细丝相连,在细胞 -细胞的黏附中发挥重要作用[5]。游离的β-catenin在没有Wnt信号存在的情况下则进入由糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)和干酪素激酶 Iα(casein kinase Iα,CK Iα)参与组成的降解复合体而被其降解;但如果有Wnt信号存在,后者将阻断β-catenin的降解,使之在胞质中积聚并转移到细胞核内。β-catenin在细胞核内通过与转录因子T细胞因子和淋巴增强因子(T cell factor/lymphoid enhancer factor,TCF/LEF)结合而激活下游靶向基因的转录[6]。其中一些基因的表达具有已知的促进肿瘤生长的作用,如c-myc、c-jun等。因此当Wnt/β-catenin信号通路过度激活时将会导致肿瘤的发生。结直肠癌是最常见的恶性肿瘤之一。在66%~79%的结直肠癌组织中细胞质和细胞核内βcatenin是异常堆积的,而且β-catenin的过表达与肿瘤的浸润深度及局部去分化有关[7-8]。目前,结直肠癌的化疗药物大多数是作为DNA、RNA、微管合成干扰的非选择性的细胞分裂抑制剂。这些药物虽然能有效杀死分裂的恶性细胞,但非选择性抑制正常细胞的分裂,尤其是一些分裂旺盛的细胞,必然引起严重的毒副反应。与此同时,天然小分子药物以其高选择性、低毒副反应和可能提高恶性肿瘤临床疗效的优势,正成为肿瘤治疗研究的热点。而人参皂苷Rg3正是这样一种针对Wnt/β-catenin信号通路的天然小分子物质,并且我们在利用计算机模拟的针对β-catenin蛋白的药物筛选模型中发现,人参皂苷Rg3能与这种蛋白结合,其存在可影响β-catenin中特定氨基酸位点的修饰,从而发挥作用。基于以上研究的提示,本实验通过RT-PCR、Western blot法和流式细胞仪技术来探讨人参皂苷Rg3对肿瘤细胞中β-catenin的表达和磷酸化程度影响,同时检测其对肿瘤细胞增殖和生存的抑制情况,以期为临床上结肠癌的诊治工作提供一定的实验依据。
1 材料与方法
1.1 细胞培养 人结肠癌细胞系HCT116和SW480由第二军医大学海军研究所馈赠。用含体积分数10%胎牛血清的DMEM培养,细胞环境为体积分数5%CO2、37℃的培养箱。
1.2 药品及药物制备 人参皂苷Rg3购自中国药品生物制品检定所。药品用DMSO助溶解,制成原液,-20℃保存。用含体积分数10%胎牛血清的DMEM稀释,使 药 物 终 浓 度 达 到 10、20、40、80、160、320 μmol·L-1。
1.3 流式细胞仪检测β-catenin磷酸化水平 收集2×106个细胞,质量分数4%多聚甲醛室温固定细胞40 min,洗涤离心后用1 mL含体积分数0.2%Triton-X100和体积分数5%血清的PBS重悬细胞,冰上放置10 min;加入饱和剂量FITC标记的一抗,冰上放置40 min,离心去上清,PBS洗涤2次;加入0.5 mL质量分数1%多聚甲醛重悬细胞;流式细胞仪检测荧光值,每管计数10 000个细胞。
1.4 RT-PCR检测基因转录 SW480细胞常规培养至对数生长期,加入不同浓度人参皂苷Rg3(0、20、80、320 μmol·L-1),继续培养 48 h 后,Trizol法提取总RNA,用OD260/OD280鉴定RNA纯度,质量分数1%琼脂电泳鉴定完整性。取2 μg总RNA按TIANGEN公司试剂盒进行逆转录,产物cDNA进行PCR。β-catenin引物序列上游:5'-ATGGCTTGGAATGAGAC-3',下游:5'-AACTGGATAGTCTAGCACC-3',产物大小 235 bp;β-actin引物序列上游:5'-ACTCGTCATACTCCCTGCTG-3',下游:5'-GAAACTACCTTCAACTCCC-3',产物大小285 bp;c-myc引物序列上游:5'-ATCTACACCGACAACTCCATCC-3',下游:5'-GCATTTTGGAGAGGAAGTGTTC-3',产物大小130 bp。扩增条件为:94℃变性2 min,94 ℃变性40 s,62 ℃退火40 s,72 ℃延伸1 min,40个循环,72℃终延伸5 min。PCR电泳,Bio-Rad凝胶成像系统成像,Image Lab 3.0分析其相对分子质量。实验重复3次。
1.5 Western blot法检测蛋白表达 HCT116细胞接种于6孔板中(2×105/孔),药物处理48 h。提蛋白并用BSA试剂盒进行蛋白定量。制胶,加样品和Mark液后通电70 V、40 min,后改为120 V、1 h。转移蛋白质到硝酸纤维素薄膜,按要求浸泡后按下列顺序逐张叠放、精确对齐:3张滤纸、硝酸纤维素膜、凝胶、3张滤纸。插入电极,打开电泳仪开关调至80 mA、4 h。封闭1 h。加入一抗β-catenin 4℃过夜,后加入二抗孵育2 h。最后使用DAB显色试剂盒,目标蛋白显色。使用Bio-Rad凝胶成像系统成像,相对灰度值=目的蛋白灰度值/内参蛋白(β-actin)灰度值。
1.6 MTT法检测细胞增殖 用于研究人参皂苷Rg3对结肠癌细胞增殖的影响。SW480及HCT116细胞种植到96孔板(1×104/孔,密度为60% ~80%)。常规培养24 h后,添加不同药物浓度的人参皂苷Rg3(10、20、40、80、160、320 μmol·L-1)到 96 孔中,并设定实验对照及调零孔。体积分数5%CO2、37℃的培养箱中孵育24、48 h后,添加10 μL MTT染液到每个指定的孔中,孵育4 h。随后每孔加入150 μL DMSO以终止反应和溶解甲臜,最后96孔板在490 nm处测定吸光值。
1.7 流式细胞仪检测细胞凋亡情况 实验使用Annexin-V FITC/PI双染试剂盒。将SW480和HCT116细胞培养至对数生长期,细胞密度约80% ~90%,将细胞培养液换成不同浓度的人参皂苷Rg3(20、40、80、160、320 μmol·L-1),继续培养 24、48 h。消化离心,按试剂盒要求加入Annexin V-FITC和PI染色液。在1 h内用流式细胞仪检测。
1.8 统计学处理 用SPSS 17.0进行统计学分析,定量数据以±s来表示,2组定量数据比较使用t检验,检验水准 α=0.05。
2 结果
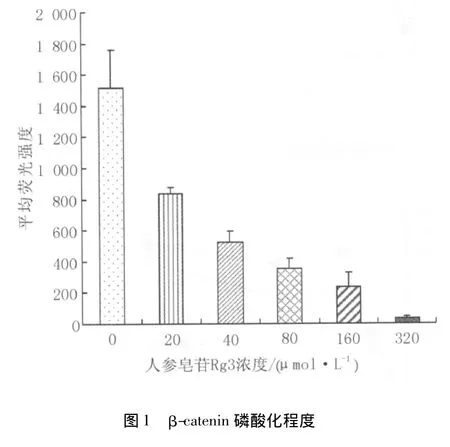
2.1 β-catenin磷酸化程度 各人参皂苷Rg3用药组(20、40、80、160、320 μmol·L-1)均比对照组的 βcatenin磷酸化程度低(P均<0.05),表示随人参皂苷Rg3浓度的增加,β-catenin磷酸化信号强度明显减弱。见图1。
2.2 人参皂苷 Rg3作用48 h后对SW480细胞 βcatenin、c-myc mRNA的影响 随人参皂苷Rg3浓度的增加,β-catenin mRNA表达无明显变化,且各人参皂苷Rg3用药组mRNA相对表达量与对照组比较差异无统计学意义(P均>0.05);c-myc mRNA表达则是:随人参皂苷Rg3浓度的增加,c-myc mRNA相对表达量明显降低,一定浓度的人参皂苷 Rg3(80、320 μmol·L-1)用药组c-myc mRNA相对表达量与对照组比较差异有统计学意义(P均<0.05)。见图2、表1。


表1 Rg3对SW480细胞β-catenin、c-myc mRNA的影响
2.3 人参皂苷Rg3作用48 h后对HCT116细胞βcatenin、c-myc蛋白的影响 随人参皂苷Rg3浓度的增加,c-myc蛋白表达明显降低,各人参皂苷Rg3用药组β-catenin、c-myc蛋白表达量与对照组比较差异均有统计学意义(P均<0.05)。见图3、表2。
2.4 细胞增殖实验结果 不同浓度人参皂苷Rg3处理 SW480 细胞24 h后 IC50为102.027 4 ±3.275 1,48 h后 IC50为 37.096 9 ±0.172 9,下降 64.930 4 ±3.319 2;不同浓度人参皂苷Rg3处理HCT116细胞24 h 后 IC50为 96.591 0 ±0.634 9,48 h 后 IC50为37.445 6 ±1.339 1,下降59.145 4 ±1.498 3。不同时间,同一细胞株各浓度用药组之间比较差异有统计学意义(P均<0.05)。同一时间,不同细胞株各浓度用药组之间比较差异无统计学意义(P均>0.05)。见图4。

2.5 细胞凋亡情况 随人参皂苷Rg3浓度的增加,时间的延长,SW480、HCT116细胞凋亡率显著增加,各人参皂苷Rg3用药组与阴性对照组比较差异有统计学意义(P均<0.05)。不同时间,同一细胞株各浓度用药组之间比较差异有统计学意义(P均<0.05)。同一时间,不同细胞株各浓度用药组之间比较差异无统计学意义(P均>0.05)。见图5。
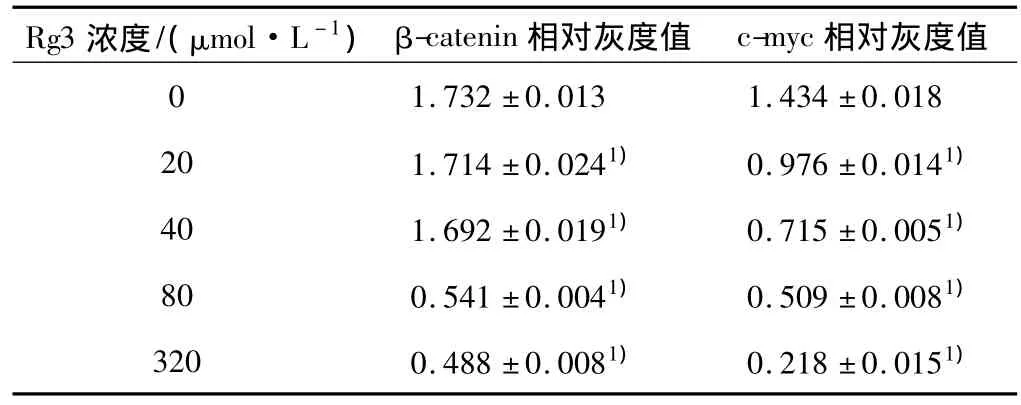
表2 Rg3对SW480细胞β-catenin、c-myc蛋白表达的影响

3 讨论
β-catenin可通过与细胞膜上的钙粘蛋白和细胞骨架的结合发挥重要的维持细胞结构和黏附的作用。那么局限在细胞膜上的β-catenin是否能转变成为游离形式而成为Wnt/β-catenin信号通路的效应因子这一问题引起了广泛的关注。研究[9]证明细胞质中的激酶Fer可通过使 β-catenin第142位酪氨酸残基(Tyr142或Y142)磷酸化而破坏其和α-catenin之间的连接,从而释放β-catenin。因此,Y142位置的去磷酸化将稳定β-catenin的膜结合形式,从而减少其参与Wnt/β-catenin信号通路,以致减少了下游促癌基因的转录。
在本实验中,我们发现人参皂苷Rg3作用后的HCT116和SW480细胞中的游离β-catenin明显减少,并且RT-PCR实验结果也提示这种减少效应并不是发生在转录水平上。我们使用特异识别β-catenin磷酸化Y142的抗体,在人参皂苷Rg3作用后,此位点的磷酸化水平下降。结合我们前期工作中预测到的人参皂苷Rg3可与β-catenin结合的模型,我们推测这种结合可以干扰Fer对于Y142的磷酸化过程,使得β-catenin保持稳定的膜结合形式而不能发挥信号通路中的转录调节作用,而在肿瘤细胞中则能减少下游一些促进肿瘤发生、发展基因的表达,进而抑制肿瘤细胞的增殖和促进凋亡的发生,这些也在我们的实验中得到了证实。另外,在实验中,人参皂苷Rg3的作用呈现剂量依赖和随时间增强的特点,说明人参皂苷Rg3可以使游离的β-catenin不断地转变成膜结合形式而加强效应,但我们注意到人参皂苷Rg3的效应以80 μmol·L-1为界,在此之前,其抑制肿瘤细胞增殖和促进凋亡的效应随浓度增加而迅速上升,而在此之后,随浓度的增加,其效应曲线则趋于平缓,这种现象说明人参皂苷Rg3的效应在80 μmol·L-1时趋于饱和,同时也表明了这种小分子物质是通过与β-catenin结合而影响其功能的。但使游离形式β-catenin转变的具体途径和过程还需要通过进一步的实验进行研究。
人参皂苷Rg3的抗肿瘤作用具有这样的机制使之与其他针对β-catenin的靶向治疗方法相比,就有一定的优势。其中一种方法是试图通过减少β-catenin的表达达到抑制肿瘤细胞生长的目的。例如将干扰RNA分别转染至含有突变型β-catenin的SW480和HCT116细胞中,可减少β-catenin的表达、β-catenin/TCF介导的转录以及很好抑制肿瘤细胞的生长[10]。但这种方法的主要缺陷就是通过抑制β-catenin的表达,不仅减少其游离形式,同时也减少了参与细胞黏附的膜结合形式的数量,从而使得肿瘤组织容易发生浸润和转移。而人参皂苷Rg3则是在β-catenin总量不变的情况下,使参与信号通路的游离形式转变成为膜结合形式,在达到降低β-catenin和靶基因转录的同时,还稳定了细胞黏附而减少肿瘤细胞转移。另外一些方法集中在对β-catenin降解复合体的改造上,这些方法克服了前述方法的缺点,仅减少游离形式的βcatenin,而不影响细胞的黏附作用[11-12]。不过这些方法的复杂给药方式则阻碍其应用。因此人参皂苷Rg3简单的给药方式和便捷的给药途径也成为其应用优势。
综上所述,人参皂苷Rg3具有一定的抗肿瘤活性,可有效抑制HCT116和SW480细胞生长,且这种作用可能是通过下调β-catenin磷酸化来实现的。相信不久的将来,随着人们对Wnt/β-catenin信号通路的抗肿瘤机制的深入研究,针对该信号通路的不同靶点和高度特异性的天然小分子药物的开发将为肿瘤的诊治提供一个崭新的研究领域。
[1]Rice PL,Kelloff J,Sullivan H,et al.Sulindac metabolites induce caspase-and proteasome-dependent degradation of beta-catenin protein in human colon cancer cells[J].Mol Cancer Ther,2003,2(9):885-892.
[2]Danilkovitch-Miagkova A.Oncogenic signaling pathways activated by RON receptor tyrosine kinase[J].Curr Cancer Drug Targets,2003,3(1):31 -40.
[3]Kim YJ,Kwon HC,Ko H,et al.Anti-tumor activity of the ginsenoside Rk1 in human hepatocellular carcinoma cells through inhibition of telomerase activity and induction of apoptosis[J].Biol Pharm Bull,2008,31(5):826 -830.
[4]He BC,Gao JL,Luo X,et al.Ginsenoside Rg3 inhibits colorectal tumor growth through the down-regulation of Wnt/β-catenin signaling[J].Int J Oncol,2011,38(2):437 -445.
[5]Nelson WJ,Nusse R.Convergence of Wnt,beta-catenin,and cadherin pathways[J].Science,2004,303(5663):1483 - 1487.
[6]Clevers H.Wnt/beta-catenin signaling in development and disease[J].Cell,2006,127(3):469 - 480.
[7]Qi J,Zhu YQ.Targeting the most upstream site of Wnt signaling pathway provides a strategic advantage for therapy in colorectal cancer[J].Curr Drug Targets,2008,9(7):548 - 557.
[8]Labianca R,Beretta GD,Kildani B,et al.Colon cancer[J].Crit Rev Oncol Hematol,2010,74(2):106 -133.
[9]Piedra J,Miravet S,Casta˜no J,et al.p120 Catenin-associated Fer and Fyn tyrosine kinases regulate beta-catenin Tyr-142 phosphorylation and beta-catenin-alpha-catenin Interaction[J].Mol Cell Biol,2003,23(7):2287 -2297.
[10]Verma UN,Surabhi RM,Schmaltieg A,et al.Small interfering RNAs directed against beta-catenin inhibit the in vitro and in vivo growth of colon cancer cells[J].Clin Cancer Res,2003,9(4):1291-1300.
[11]Cong F,Zhang J,Pao W,et al.A protein knockdown strategy to study the function of beta-catenin in tumorigenesis[J].BMC Mol Biol,2003,4:10.
[12]Su Y,Ishikawa S,Kojima M,et al.Eradication of pathogenic betacatenin by Skp1/Cullin/F box ubiquitination machinery[J].Proc Natl Acad Sci U S A,2003,100(22):12729 -12734.
