南阳黄牛CD14基因扩增及序列分析
2012-10-15马蓓蓓赵战勤
马蓓蓓,龙 塔,薛 云,周 峰,赵战勤
(河南科技大学 a.动物科技学院;b.医学技术与工程学院,河南洛阳471003)
0 前言
牛白细胞分化抗原14(CD14)是一种存在于单核细胞、巨噬细胞、树突状细胞等免疫细胞表面的分化抗原。CDl4是一种模式识别受体蛋白,它能识别多种革兰氏阳性菌和阴性菌的细胞壁成分,如磷酸脂多糖、肽聚糖等,将其传递给Toll样受体蛋白,激活单核巨噬细胞,引起一系列炎症促进因子和炎症抑制因子的表达。因此,CD14是天然免疫系统的重要成分之一,是启动和介导病原微生物抗原信号转导途径的关键分子,与多种传染病的发生、发展和预后密切相关[1-3]。CD14对研究感染与免疫的发生机理意义重大。南阳黄牛是分布在南阳地区的地方特有品种,是中国五大良种之一,且是分布最广的品种。南阳黄牛肉质好,生产周期短,其抗病性尤其引人关注[4],研究表明:南阳黄牛对如结核病等传染病的抵抗力远优于奶牛,但其遗传分子机制未明。近些年来,国际上已在DNA水平上对奶牛进行了一些研究,主要涉及到奶牛的分子群体遗传特征及起源进化、经济性状分子遗传标记及相关功能基因多态性研究等[5]。但对南阳黄牛的基因研究仍鲜见报道。CD14是重要的病原微生物识别受体蛋白,但南阳黄牛CD14基因的生物学信息分析还从未有过详尽研究。
本文通过扩增南阳黄牛CD14基因完整编码区和近端非编码区,对基因结构及其编码的氨基酸进行了生物信息学分析,了解中原地区南阳黄牛CD14基因的生物信息学特点,获得的参数为今后研究南阳黄牛的抗病性提供试验依据,也为进一步的群体遗传学的研究奠定基础。
1 材料与方法
1.1 材料
采用南阳黄牛中心产区典型群随机抽样的方法在河南省南阳地区采集黄牛血样。颈静脉采血10 mL,用ACD抗凝剂1∶6(体积比)抗凝,-70℃冰箱冻存[6]。用盐析法进行基因组DNA的提取。
1.2 主要试剂和仪器
基因组提取试剂盒、Taq DNA聚合酶、dNTPs、D16000-DNA Marker及有关缓冲液等均购自上海Sagon公司。GeneAmp PCR仪、Tanon 1600凝胶成像系统、北京市六一仪器厂DYY-10C型电泳仪等。
1.3 引物序列设计
参照GenBank上已发表的荷斯坦奶牛的CD14基因序列(登录号:D84509.1),使用Premier5.0软件设计扩增CD14基因编码区的引物,分4段扩增,引物由上海Sagon公司合成,序列见表1。
1.4 PCR扩增
PCR 反应体系为 30 μL,包括:3 μL 10 × PCR Buffer,1 μL Taq 酶,2 μL MgCl2,10 μmol的上下游引物各 1 μL,1 μL 模 板 DNA,2μL dNTPs,然后加灭菌双蒸水 19 μL 至30 μL。PCR反应程序为:94℃预变性5 min,94 ℃变性 30 s,58.5 ℃退火30 s,72 ℃延伸 50 s,30 个循环,最后72℃总延伸10 min,4℃保存。PCR产物通过1%(质量分数)琼脂糖凝胶电泳鉴定后进行序列测定(由上海Sagon公司完成)。
1.5 序列的分析与结构预测
利用DNAstar软件将扩增的序列与GenBank上已发表的荷斯坦奶牛、水牛、猪、山羊、绵羊、人、猕猴、大猩猩、小鼠的CD14基因序列进行同源性比较,制作进化树;用NCBI中的ORF Finder软件进行开放阅读框的识别,翻译成氨基酸序列;TMHMM Server v.2.0预测跨膜结构[7]。

表1 引物序列
2 结果
2.1 南阳黄牛CD14基因的PCR扩增结果
电泳结果表明PCR产物特异性良好(见图1)。4段产物长度分别为:1 578 bp(见图1a),832 bp(见图1b)、825 bp(见图1c)、747 bp(见图1d),电泳结果与预期片段大小相符。
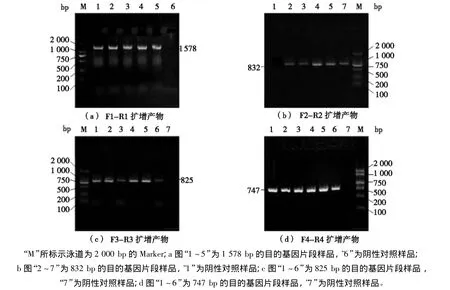
图1 CD14基因PCR扩增
2.2 南阳黄牛CD14基因测序结果和氨基酸序列推导
CD14基因PCR产物经纯化后,送生物公司进行DNA测序。拼接4段扩增片段结果,获得牛CD14基因的完整序列。碱基组成的含量分别为 A(18.4%)、T(18.4%)、C(32.9%)、G(30.2%)。通过NCBI的ORF Finder软件进行开放阅读框的识别,得到南阳黄牛的CD14基因编码区共966 bp,与GenBank已公布的荷斯坦奶牛CD14基因序列(登录号:D84509.1)比较,有2个碱基突变;5’端非编码序列长度为1 543 bp,发生了2个碱基突变;3’端非编码序列长460 bp,发生了5个碱基突变(见表2)。南阳黄牛CD14基因核苷酸共编码321个氨基酸,与荷斯坦奶牛相比,南阳黄牛位于编码区的2个DNA突变并没有引起氨基酸序列的改变。

表2 南阳黄牛与荷斯坦奶牛CD14基因核苷酸序列的比对结果
2.3 南阳黄牛CD14基因的同源性比对
通过MegAlign软件得到南阳黄牛CD14基因的序列与GenBank中荷斯坦奶牛、水牛、绵羊、山羊、猪、猕猴、大猩猩、人、小鼠的同源性分别为 99.8%、98.2%、96.8%、92.8%、83.5%、79.8%、79.7%、79.5%、71.9%,如图2所示。
2.4 南阳黄牛CD14进化树构建
利用DNAStar中的MegAlign软件对物种间的系统发生树进行构建(见图3)。系统发生树总体分为两支,小鼠单独为一支,南阳牛、荷斯坦奶牛、水牛、猪、山羊、绵羊、人、猕猴、大猩猩为另一独立的大支。南阳黄牛与荷斯坦奶牛聚在一起,再与水牛聚为一类,山羊和绵羊先聚在一起,再与南阳牛、荷斯坦奶牛、水牛聚为一类,然后再与猪聚为一类。人和猩猩先聚在一起,再与猕猴聚为一类,然后再与南阳牛、荷斯坦奶牛、水牛、山羊、绵羊和猪共同聚为一支。
2.5 南阳黄牛CD14跨膜结构预测
通过TMHMM Server v.2.0在线分析发现CD14蛋白没有跨膜结构域,见图4。

图2 南阳黄牛与其他动物的CD14基因同源性比较
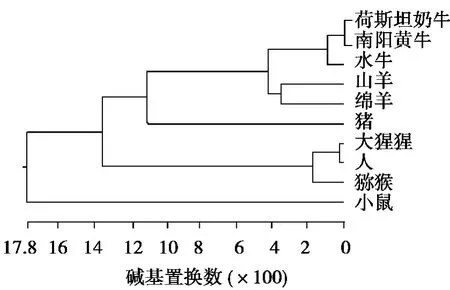
图3 南阳黄牛CD14基因进化树
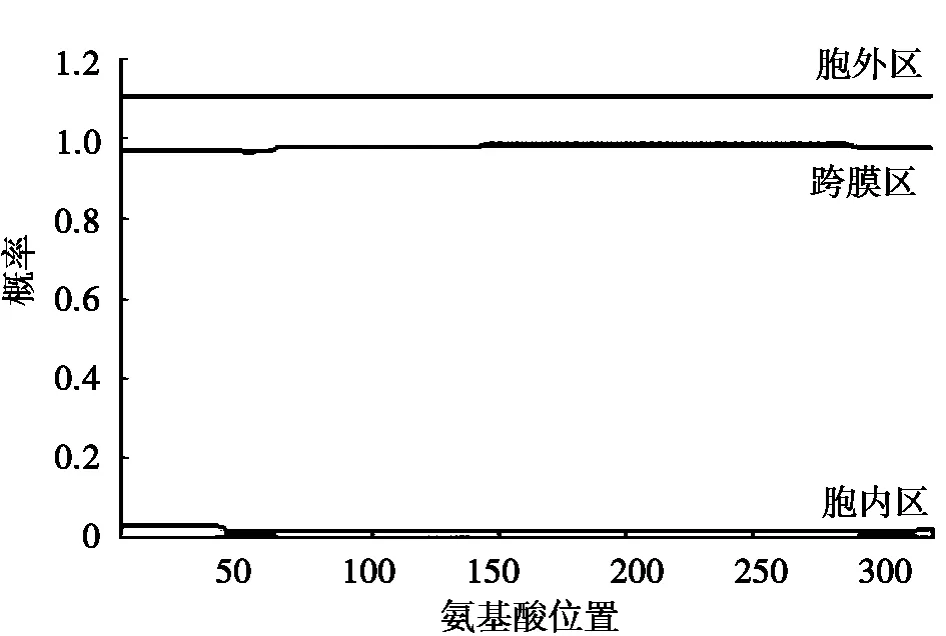
图4 南阳黄牛CD14跨膜结构预测分析图
3 讨论
参照GenBank上已发表的荷斯坦奶牛的CD14基因序列(登录号:D84509.1),设计了4对引物,扩增了涵盖南阳黄牛CD14基因非编码区和完整编码区的目的片段,之后进行序列测定和拼接,成功获得了CD14基因的全部序列。通过NCBI的ORF Finder软件进行开放阅读框的识别,得到南阳黄牛CD14基因开放阅读框全长966 bp,共编码321个氨基酸。碱基组成为A(18.4%)、T(18.4%)、C(32.9%)、G(30.2%)。A+T的含量(36.8%)显著低于G+C含量(63.1%),这一模式与水牛、野牛等其他品种的牛CD14基因相似,但与其他动物具有一定差异[8]。
在南阳黄牛CD14基因的5’端发现了长1 543 bp的非编码区,与已发表的荷斯坦奶牛CD14基因序列相似度很高[9],经比对有2个接近编码区的碱基发生突变;南阳黄牛CD14基因的编码区966 bp,与荷斯坦奶牛相比发生了2个碱基突变;在3’端也发现了一段较长的非编码区,长460 bp,与荷斯坦奶牛对比发生了5个碱基突变。尽管发现数个碱基突变,南阳黄牛CD14氨基酸序列与荷斯坦奶牛完全一致。通过TMHMM Server v.2.0分析发现南阳黄牛CD14基因编码的氨基酸序列没有跨膜结构域(见图4),验证了CD14确属细胞表面糖蛋白家族成员之一,可能作为一种特异性的单核细胞和巨噬细胞表面标记物,在机体免疫、防御系统引起的一系列病理反应中起关键作用[10]。
通过MegAlign软件将南阳黄牛CD14基因的序列与GenBank中荷斯坦奶牛、水牛、猪、山羊、绵羊、人、猕猴、大猩猩、小鼠等物种同源核苷酸序列进行比对。结果表明:南阳黄牛与荷斯坦奶牛的同源性最高,达到99.8%,与水牛、绵羊和山羊的同源性较高,分别为98.2%、96.8%、92.8%,由此证明了CD14基因在反刍动物间的高度保守性。由图3进化树分析图表明:南阳黄牛与荷斯坦奶牛、水牛、绵羊、山羊、猪、猕猴、大猩猩、人、小鼠的亲缘关系依次变远。与猪、猕猴、大猩猩、人的同源性分别为83.5%、79.8%、79.7%、79.5%,与小鼠同源性最低,仅为71.9%。通过MegAlign构建的进化树(见图3)可以看出:各物种的分化与物种进化规律一致,牛和羊同为反刍类动物,因此聚为一支,而人与大猩猩和猕猴同为灵长类动物,因此聚为一支,符合物种遗传距离远近的实际情况。
CD14基因系统发生关系上与各物种间的亲缘关系密切,说明了该基因在物种进化过程中保守性很高,在动物生命活动中起到很重要的作用[11]。本试验再一次证明了CD14基因在反刍动物之间进化过程中保守性很高,从而可以推测反刍动物CD14基因转录、翻译及其作用机制等都可能是相似的。另外,研究还发现不同物种间的牛CD14基因序列存在一定程度的差异。结合牛CD14基因的功能来推测,这可能与不同物种的遗传差异性、生长环境等都有很大的关系。
目前,对人CD14基因的结构和功能研究已经比较深入,在细菌、病毒、真菌感染以及抗肿瘤作用方面表现出巨大的应用前景[2,12-13]。但是对于牛CD14基因的研究方面,仅有国外少量报道,尤其对中国南阳黄牛这一中原地区主要地方品种的研究更为鲜见。本文对南阳黄牛CD14基因进行了扩增和序列分析,为研究南阳黄牛抗病性强的分子机制,与其他牛种的分子遗传学差异,为中国进一步开发、应用南阳黄牛优秀的品种资源打下了基础。
4 结论
利用生物信息学技术对南阳黄牛CD14基因的核苷酸和推导氨基酸序列进行了分析和预测,初步了解该基因的结构特点,这对于进一步开展南阳黄牛CD14分子的结构功能、揭示病原微生物入侵宿主的致病机制以及设计免疫预防控制技术和抗病育种策略等方面都有重要的理论价值。
[1]薛云.CD14和TLR2基因多态性与中国汉族人群结核病易感性的关联研究[D].杭州:浙江大学,2010.
[2]陈敏,吴斌,李文.CDl4基因-159 C/T位点多态性对哮喘患者血浆IL-5的影响[J].山东医药,2009,49(5):13-15.
[3]张海邻.TLR4和CD14基因多态性和儿童特应性疾病的相关性研究[D].杭州:浙江大学,2006.
[4]梁子安,鲁云风,文祯中,等.南阳黄牛可持续发展探讨[J].安徽农业科学,2006,34(18):4592-4596.
[5]吴波,张书环,邓铨涛,等.四种牛分枝杆菌特异性蛋白融合表达及在牛结核病诊断中的临床应用[J].中国奶牛,2007(10):16-19.
[6]李兴芳,柏学进,龚宜超,等.渤海黑牛H-FABP基因外显子2的序列测定与分析[J].安徽农业科学,2009,37(10):4436-4438.
[7]巨向红,徐汉进,雍艳红,等.巴马香猪Toll样受体4基因cDNA的克隆及生物信息学分析[J].中国实验动物学报,2010,18(3):185-190.
[8]韦叶生,蓝艳,刘运广,等.广西地区汉族人群CDl4基因启动子-159C/T多态性研究[J].广东医学,2006,27(2):179-181.
[9]Ibeagha-Awemu E M,Lee J W,Ibeagha A E,et al.Bovine CD14 Gene Characterization and Relationship Between Polymorphisms and Surface Expression on Monocytes and Polymorphonuclear Neutrophils[J].BMC Genetics,2008,9:50.
[10]刘振华.牛可溶性CD14基因的克隆表达及对脂多糖毒性的保护作用的初步研究[D].扬州:扬州大学,2008.
[11]白洁,王威,荫俊,等.可溶性CD14基因克隆及序列分析[J].生物技术通讯,2001,12(2):94-95.
[12]董蕻.CD14基因启动子区SNP分析及其与LPS反应的关系[D].重庆:第三中医大学,2004.
[13]许长琼,王伟,王怀宁,等.CD14基因多态性与严重感染患者炎症介质及预后的关系[J].中国医师杂志,2009,11(1):45-47.
