梅山与杜洛克母猪发情前期卵巢中差异表达基因的分离与鉴定
2012-10-14赵志超孙敬礼黄涛李大全王宵燕宋成义刘丽娟杨飞
赵志超,孙敬礼,黄涛,李大全,王宵燕,宋成义,刘丽娟,杨飞
(1石河子大学动物科技学院,石河子832003;2扬州大学动物科技学院,扬州225000)
梅山与杜洛克母猪发情前期卵巢中差异表达基因的分离与鉴定
赵志超1,孙敬礼1,黄涛1,李大全1,王宵燕2,宋成义2,刘丽娟1,杨飞1
(1石河子大学动物科技学院,石河子832003;2扬州大学动物科技学院,扬州225000)
为了探讨梅山与杜洛克母猪卵巢差异表达基因对猪排卵与繁殖性状的影响,采用mRNA差异显示技术对梅山猪与杜洛克猪卵巢中基因表达的差异性进行了研究。结果显示:利用DDRT-PCR在梅山与杜洛克猪卵巢中分离了1条差异表达的表达序列EST142,并用半定量RT-PCR鉴定。通过GenBank/BLAST比对,发现该EST142与BCL-2/BNiP3L具有较高的同源性。组织表达谱分析揭示了该EST142在梅山猪心、肝、肺、肾、肌肉、脂肪、小肠、大脑、卵巢、子宫、脾、输卵管等各个组织中的表达有不同程度的差异。这表明该基因在梅山与杜洛克猪卵巢中差异表达,可能在某种程度上影响卵泡发育。本研究为研究影响猪排卵数的分子调控网络奠定了基础。
梅山猪;杜洛克猪;卵巢;半定量;组织表达谱
从遗传学和综合经济效益的角度出发,猪繁殖性状是具有微效多基因效应的低遗传力和限性遗传性状,而产仔数又是其中最重要的性状[1-2]。在欧美国家含25%梅山猪血液的青年母猪比大白×法国
长白母猪每窝约多产1.6个活仔[3],这在一定程度上证明了梅山猪相对国外一些猪种具有较高的产仔数的生产性能。因此,取繁殖力较高的梅山和肉质型较好而繁殖力低的杜洛克作为研究对象则具有很大的意义。
梅山与杜洛克为著名的优良猪种,梅山猪属我国优良的地方猪种太湖猪的一种,具有繁殖力高的特点,经产母猪平均窝产仔数为15~16头,是世界著名的高产猪种。杜洛克猪原产美国,是最优良的瘦肉型猪种之一,在世界范围内广泛分布,在我国的存栏数也很大,但其产仔数却很低,经产母猪窝产仔数仅为9~10头[4]。国内外研究者从激素、细胞因子、营养、管理、环境等方面对中外猪种繁殖力差异形成的原因与机理进行了广泛的研究与探讨,发现排卵数多是我国太湖猪高产的基础之一[5]。中外猪种发情母猪的排卵数有很大的差异。梅山经产母猪每个情期排卵数为25~29个[5],而杜洛克猪每个情期排卵数只有12.3个[6],二者差异很大,这是形成两猪种产仔数差异的重要原因。因此,从排卵特异基因的角度来进行研究有助于更好的理解排卵的分子机制,有助于发展新的途径以提高繁殖力和繁殖控制。
mRNA差异显示(differential display reverse transcription polymerase chain reaction,DDRTPCR)技术能快速筛选差异表达基因,并已在人、动物和农作物的研究中取得了一些可信成果[7]。本研究利用DDRT-PCR的方法从基因转录水平研究发情前期梅山与杜洛克母猪卵巢之间差异表达的基因进行分离和鉴定,通过研究,分离得到了在梅山猪卵巢中表达而在杜洛克猪卵巢中不表达的BCL2基因,并对该基因进行了组织表达谱分析。
1 材料与方法
1.1 材料
选取发情正常、符合品种特征的梅山猪和杜格克母猪各3头。Trizol Reagent、三羟甲基氨基甲烷(Tris)、丙烯酰胺(Acrylamide,Acr)、N-N′-亚甲基丙烯酰胺(Bisacrylamide,Bis)、TEMED、PGM-T载体连接试剂盒、DNA胶回收试剂盒;高速冷冻离心机、梯度PCR仪、电泳凝胶成像系统、DNA/RNA浓度测定仪。
1.2 方法
1.2.1 样品的采集和总RNA的提取
每天2次观测猪的发情表现,以发情出现静立反应时为发情周期第0天。在发情周期第14天耳根静脉注射兽用氯前列烯醇注射液1支。48h(第2天)取其卵巢和其他组织样(包括肌肉、肝脏、肺脏、心脏、脾脏、子宫、输卵管、小肠、胃等),用锡纸包裹,用液氮速冻(宰杀后30-40min),提取RNA后迅速置于-80℃保存。组织样品总RNA的提取参照TRIzol试剂盒(Invitrogen公司)的操作说明书提取。DnaseI处理后用1.0%普通琼脂糖凝胶电泳和分光光度计法检测RNA的抽提质量和浓度。提取后的总RNA置于-80℃保存,备用。
1.2.2 DDRT-PCR
RNA反转录和第一链cDNA合成。总体积50 μL:2μL 10mmol/L的dNTP,模板 RNA 5μL,2 μL的Oligo(dT)混匀离心PCR上75℃变性5min立即放冰上冷却,再加入10μL 10×Reaction Buffer,0.5μL RNasin,29.5μL DEPC 水,1μL MMLV反转录酶,混匀后37℃反应60min,95℃灭活5min。反转录成功的cDNA单链可于-20℃中保存。
采用9条锚定引物和10条随机引物随机组合对梅山和杜洛克母猪卵巢的cDNA进行PCR扩增。DDRT-PCR扩增体系总体积20μL:2.0μL 10×Taq DNA polymerase buffer,1.0μL 10μmol/L锚定引物,1.0μL 10μmol/L随机引物,0.3μL Taq DNA polymerase,和12.7μL水。PCR程序如下:94℃5min,(94℃30s,40℃30s,72℃30s)10个循环,随后25循环:94℃30s,45℃30s,72℃30s,最后72℃延伸10min,4℃终止反应。PCR产物用PAGE胶银染分析。
1.2.2 差异条带的重扩增、克隆和序列分析
参照Liang等[8]的方法采用煮沸法回收差异cDNA片段,切下包含差异条带的聚丙酰胺凝胶,放入无菌1.5mL的EP管中。加入约80μL胶浸泡液TE,用枪头捣碎,95℃水浴放置15min。以回收的模板按照第1次扩增的条件进行再次扩增。PCR产物连接pMD-18T载体进行克隆。将得到克隆序列进行分析。引物及退火温度见表1。

表1 差异ESTs的引物序列及退火温度Tab.1ESTs specific primers and annealing temperature
1.2.3 半定量RT-PCR鉴定及组织表达谱分析
将各组织总RNA反转录的第一链cDNA稀释成相同的浓度作为模板,根据差异表达的EST的序列设计引物进行PCR,以β-actin的基因的表达作为对照,PCR的反应参数因不同的引物而异,反应一般为25个循环,每个PCR重复3次。
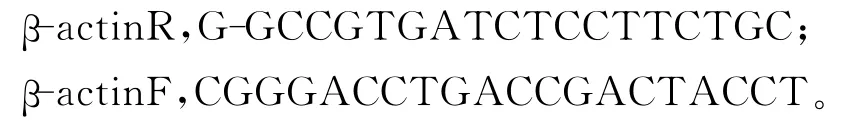
退火温度55℃。
2 结果与分析
2.1 mRNA差异显示分析
通过对梅山与杜洛克母猪发情前期卵巢组织的cDNA进行DD-PCR,将PCR产物在12%的聚丙烯酰胺凝胶上分离、银染显色分析,发现存在基因表达差异,差异显示的1个EST如图1所示。
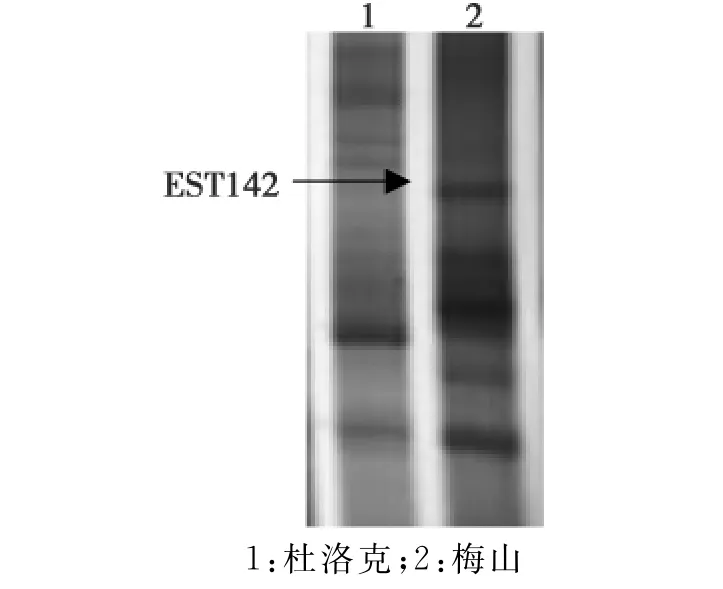
图1 EST142的差异表达分析Fig.1The differential expression analysis of EST142
2.2 序列分析
采用锚定引物和随机引物进行DDRT-PCR,获得1条同源性较高的差异表达条带,EST142(104 bp)与猪 BCL2/adenovirus E1B19kDa interacting protein 3-like(BNIP3L)同源性为92%。

表2 差异表达EST信息Tab.2Information on the differentially displayed EST
2.3 半定量RT-PCR
利用半定量PCR对差异基因EST142进行验证。发现EST142在杜洛克母猪的卵巢中不表达,在梅山猪的卵巢中表达。
2.4 组织表达谱分析结果
用梅山猪的组织cDNA为模板进行半定量RT-PCR,结果(表3)显示,差异EST142卵巢中表达丰富,在肾、肌肉、脂肪、大脑 、脾 、子宫、输卵管中中等表达,在心、肝中微量少量表达。
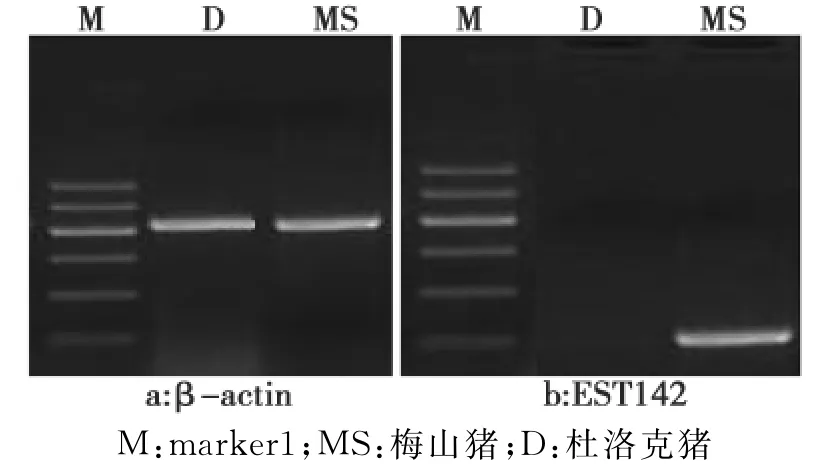
图2 半定量PCR结果Fig.2Result of semi-quantitative RT-PCR

表3 差异ESTs的组织表达谱分析Tab.3Information on the differentially displayed ESTs tissue expression profile analysis
3 讨论
EST142与猪BCL2/adenovirus E1B19kDa interacting protein 3-like(BNIP3L)序列同源,同源性为92%。BCL-2基因最早是Tsujimoto等[9]从人滤泡性淋巴瘤t(14,18)染色体易位的断裂点分离得到,是目前最受关注的细胞凋亡相关基因之一。该基因的主要功能是通过编码蛋白Bcl-2,而发挥其抑制细胞凋亡的功能。具体的抗凋亡的机制包括下面几个方面:(1)通过与其它蛋白间发生结合性相互作用而抑制细胞凋亡。Bcl-2抗凋亡功能的发挥在一定程度上依赖于与其它蛋白的结合和相互作,且已经得到证实。例如Bcl-2可通过与BAG-1结合而协同抵抗anti-Fas和CTL诱导的细胞凋亡[10]。(2)通过影响Ca2+流而抑制凋亡。诸多证据表明,Ca2+流的改变在凋亡中起着重要作用[11-12]。Bcl-2过表达可以抑制正在发生凋亡的细胞内质网中钙离子的释放。但郑英如等[13]发现,在ionophore处理的PC12细胞,过表达Bcl-2,不能阻止胞内游离Ca2+的升高,这又提示Bcl-2能够通过阻止位于Ca2+升高事件下游的一个凋亡信号而抑制凋亡。(3)通过干扰其它凋亡相关蛋白的功能和活性而抑制凋亡。如:在SV诱导的凋亡中,可因Bcl-2的表达而使NF-kB活性明显受抑,从而使凋亡过程受阻。(4)通过抑制胞膜磷脂酰丝氨酸早期重分布而阻止凋亡[13]。由于胞膜PS(磷脂酰丝氨酸)的早期重分布是凋亡的一个共同特征,而Bcl-2恰恰能够抑制PS的这种改变,从而提示Bcl-2有可能通过抑制PS的外在化而阻止凋亡。(5)通过参与信号传递而抑制细胞凋亡。R-RasP23、R-RasP21、Raf-1、NO等都是重要的信号传导分子,同时也参与细胞凋亡的调节。这些分子或可与Bcl-2结合,或可调节Bcl-2表达。于是人们推测,Bcl-2可能参与这些分子相关的信号传导通路,通过影响这些通路而抑制细胞凋亡[15]。另外Bcl-2可能通过抗氧化作用或抑制氧自由基的产生而抑制细胞凋亡。但是,Bcl-2基因是否能够抑制由活性氧化物质特殊诱导的细胞死亡,以及活性氧化中间体是否为细胞凋亡所必需,至今仍不清楚[14]。有研究报道动物排卵前颗粒细胞凋亡与排卵有关[15],随着排卵的临近,凋亡细胞逐渐增加,因此,若是Bcl-2基因在动物体内充分表达的话将有助于减少细胞凋亡,将极大的提高动物的繁殖率。
本研究发现该基因在梅山猪卵巢中表达丰富,而在杜洛克猪卵巢中不表达。可以推测可能在梅山猪排卵的期间由于Bcl-2参与调控导致排卵前颗粒细胞凋亡减少,从而使梅山猪排卵数增加。这可能是梅山猪相对于杜洛克猪高产的原因之一。本研究利用DDRT-PCR的技术获得差异EST142,并通过半定量RT-PCR验证EST142在猪种间的表达差异,验证后的EST142将作为一种重要的资源为揭示中外猪品种间差异的遗传基础带来希望和活力,有助于深入探讨卵巢、卵泡生理和生殖数量的遗传控制的潜在途径。
[1]Linville R C,Pomp D,Johnson R K,et al.Candidate gene analysis for loci affecting litter size and ovulation rate inswine[J].Journal of Animal Science,2001,79:60-67.
[2]Campbell E M G,Nonneman D,Rohrer G A,et al.Fine mapping aquantitative trait locus affecting on vulation rate in swine on chromosome 8[J].Journal of Animal Science,2003,81:1706-1714.
[3]Webb A J Objectives and strategies in pig improvement:an applied perspective[J].Journal of Dairy Science,1998,81(2):36-46 .
[4]杨公社.猪生产学[M].北京:中国农业出版社,2002:12.
[5]李炳坦,赵书广,郭传甲.养猪生产技术手册[M].2版.北京:中国农业出版社,2004:8.
[6]Davis K L,Robison O W,V D Toelle.Breed differences in uterine and ovarian measurements in gestating swine[J].J Anim Sci,1987,65:685-691.
[7]程宁辉,杨金水,高燕萍,等.玉米杂种一代与亲本基因表达差异的初步研究[J].科学通报,1996,41(5):451-454.
[8]Liang P,ZhuW,Zhang X,et al.Differential display using one-base anchored oligo-dT primers[J].Nucleic Acids Research,1994,22(25):5763-5764.
[9]Tsujimoto Y,Cossman J,Jaffe E,et a1.Involvement of the bcl-2gene in human follicular lymphoma[J].Science,1985,228:1440-1443.
[10]Shinichi Takayama,Takaaki Sato,Stanislaw Krajewski,et al.Coloning and functional analysis of BAG-1a novel BCL-2binding protein with anti-cell death activity[J]Cell,1995,80(2):279-284.
[11]Reed J C.BCl-2and the regulation of programmed cell death[J].Cell Biol,1994,124:1-6.
[12]Gabriel Nú~nez,Ramón Merino,Didier Grillot,et a1.Bcl-2and Bcl-x:regulatory switches for lymphoid death and survival[J].Immunol Tody,1994,15:582-588.
[13]郑英如,陈竹钦.Bcl-2的抗细胞凋亡机制[J].生物学杂志,1997,14(6):8-9.
[14]Martin S J,Reutelingsperger C P,McGahon A J,et al.Early redistribution of plasma membrane phosphatidylserine is a general feature of apoptosis regardless of initiating stimulus:inhibition by overexpression of Bcl-2 and Abl[J].JEM Home,1995,182:546-1556.
[15]乔爱君,李大全,马文霞.鸡与鹌鹑属间杂交早期胚胎Bcl-2、P53基因表达差异及发育性变化[J].中国农业科学,2008,41(5):1497-1502.
[16]孟潘庆,胡国强.Bcl-2基因研究进展[J].山东医药,2000,40(23):54-56.
[17]William J M.Programmed cell death in preovulatory ovine follicles[J].Biol Repro,1995,53:8-12.
Isolation and Identification of Differential Expression Genes in Ovarian Tissues of Meishan and Duroc Sows at Proestrus Stage
ZHAO Zhichao1,SUN Jingli1,HUANG Tao1,LI Daquan1,WANG Xiaoyan2,SONG Chengyi2,LIU Lijuan1,YANG Fei1
(1College of Animal Science and Technology,Shihezi University,Shihezi 832003,China;2College of Animal Science and Technology,Yangzhou University,Yangzhou 225000,China)
In order to explore the effect of the differential expression genes on ovulation and reproduction traits,mRNA differential diplay(DD)technique was employed to investigate the differences in gene expression in the ovary tissues of Meishan and Duroc sows.One expressed sequence tag EST142,differentially expressed between Meishan and Duroc,was isolated and identified through semi-quantitative reverse transcriptase-polymerase chain reaction(RT-PCR).The nucleotide sequence analysis revealed that the EST showed similarity to the known genes BCL-2/BNiP3Lpublished in GenBank.Tissue expression profile analysis showed that the EST142was expressed differently in heart,liver,lung,kidney,muscle,fat(subcutaneous fat little legs,the same below),small intestine,brain,ovary,uterus,spleen,and oviduct.Conclusion:The EST142expresses differentially between Meishan and Duroc.The gene will result in the differences of little size in pigs.This research provides a foundation for further study on the molecular mechanism of ovulation regulatory network.
Meishan;Duroc;ovary;semi-quantitative;expression profiles
S828
A
2011-12-09
国家自然科学基金项目(30901014),石河子大学高层次人才启动资金项目(RCZX200602)
赵志超(1985-),男,硕士生,专业方向为猪分子遗传育种;e-mail:qingxihuyang2008@163.com。
黄涛(1978-),男,副教授,从事猪分子遗传育种研究;e-mail:taohuang100@sina.com。
