材料表面性质对微生物附着行为的影响
2012-10-13段继周段东霞蔺存国侯保荣杨东方
苏 艳, 段继周, 段东霞, 蔺存国, 张 杰, 侯保荣, 杨东方
(1. 上海海洋大学 水产与生命学院, 上海201306; 2. 中国科学院 海洋研究所, 山东 青岛266071; 3. 青岛双瑞防腐防污工程有限公司, 山东 青岛266101)
生物污损对人类开发和利用海洋带来巨大损失[1]。生物污损的早期阶段是微生物附着和生物膜形成阶段[2]。海洋微生物附着过程包括细菌起始黏附、生物膜黏附期、生长期、成熟和剥落期等4个阶段[3-5]。首先,有机分子和少量细菌黏附在物体表面[6], 在化学键合、静电作用、机械联锁或扩散作用下进行黏附[7],也会在剥离、平面剪切、非平面剪切等作用下从表面脱落[8], 所以此时为可逆附着阶段; 然后微生物利用自身分泌的聚合物在表面牢固黏附, 进入不可逆附着阶段; 不可逆附着后, 生物膜继续生长, 经过几天或数周时间到达成熟和剥落期[9-10]。微生物在材料表面的附着、固定是一个十分复杂的动态过程, 受很多因素的影响。探究不同材料表面污损微生物的附着差异是研究生物污损的基础。Berntsson等[11-12]研究表明, 附着密度随粗糙度相关参数值的增加而下降并与疏水性呈正相关。Granhag等[13]发现, 表面特征会影响孢子在表面的黏接强度, 而且润湿性也决定着附着生物与物体表面之间的实际接触面积和吸附强度[14-16]。研究还表明, 微生物在材料表面的附着情况也受基体成分及各种环境因素(盐度、温度、酸碱度、营养盐等)的影响[17-18]。
虽然微观尺度的附着已得到了广泛探讨[19-21],但现有研究大多只针对导电性金属或不导电的聚合材料, 尚缺乏这两类材料的对比研究。为此, 本文利用表面荧光显微镜对 4种材料试片上的附着细菌进行了定量描述, 初步分析了细菌在不同材料表面的附着情况及材料表面不同微生物的附着差异, 并初步探讨了影响微生物附着的主要因素。
1 材料与方法
1.1 测试材料
实验采用大小20 mm×20 mm×2 mm的 316L不锈钢试片、载玻片用玻璃试片、聚氯乙烯试片(Polyvinyle Chloride, PVC)和有机硅试片(Silastic T-2)。有机硅试片由道康宁T2(DOW Corning Corporation, USA)制作而成, 先由普通玻璃制作成 20 mm×20 mm×2 mm的模具, 然后在模具底面放置一层2000目的砂纸, 将 Silastic T-2 base translucent和silastic T-2 curing agent以10:1混合, 搅拌均匀后倒入模具, 1d后有机硅试片即可脱模而成。
实验中的316 L不锈钢试片、玻璃试片及PVC试片均分别用 1000目、1200目、2000目的水砂纸依次进行打磨, 打磨顺序从低逐渐到高, 循序渐进,每更换一个目数, 试片打磨方向与上一号方向垂直90°。然后用无水乙醇浸泡316 L不锈钢试片、玻璃试片、PVC试片及有机硅试片, 再用超声波清洗, 取出晾干, 紫外灭菌12 h。
1.2 细菌菌株及其培养条件
试验采用 3种典型的附着性微生物作为供试菌株, 包括铜绿假单胞菌(Pseudomonas aeruginosaPAO1简称P.aeruginosaPAO1)来自于日本东京工业大学; 大肠杆菌JM109菌株(Escherichia coliJM109简称E.coliJM109)来自于香港大学; 希瓦氏菌Shewanella oneidensisMR-1(S.OneidensisMR-1)菌株来自于浙江大学。
配制LB培养基, 调pH至7.0, 121℃灭菌30 min,接种P.aeruginosaPAO1和E.coliJM109微生物菌株,置于 37℃的振荡培养箱中过夜培养; 配制低盐培养基(LLB), 调 pH 至 7.0, 121℃灭菌 30min, 接种S.oneidensisMR-1菌株置于30℃的振荡培养箱中过夜培养。实验中用到的培养基LB和LLB的组分列于表1。
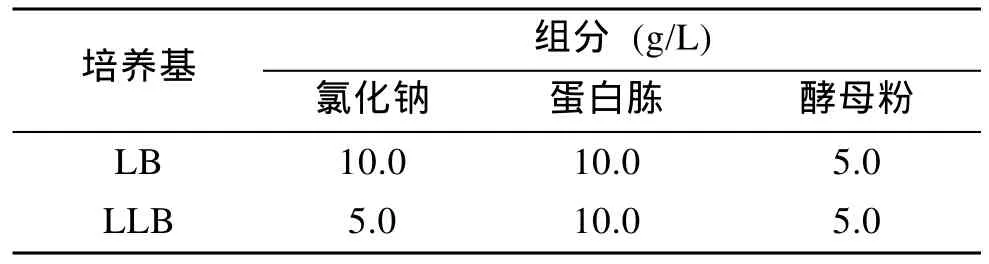
表1 LB和LLB培养基的组成Tab. 1 The composition of medium LB and LLB
1.3 实验方法
1.3.1 表面形貌观测和接触角测量
利用三维视频显微镜(型号: KH-1300)和静态接触角测试仪(型号: CAM100)测量316L不锈钢、玻璃、PVC、有机硅(Silastic T2)4种材料表面的表面形貌和静态接触角。
1.3.2 标准液的配制
标准磷酸缓冲液(PBS)配制: 用电子分析天平准确称取 NaCl 8.0 g, KCl 0.2 g, Na2HPO41.44 g,KH2PO40.44 g溶于1 L蒸馏水中, 121℃灭菌30 min。
戊二醛固定液配制: 将50%的戊二醛用PBS稀释10倍配成5%的戊二醛溶液。
DAPI染色液配制: 暗处准确称取0.001 g 4,6二脒基-2-苯吲哚盐酸(DAPI), 溶于1mL无菌三蒸水中制成1 g/L的DAPI母液, -20℃避光冻存。使用的时候, 先取出放在 4℃下溶解, 然后用 PBS逐级稀释103倍配制成1mg/L的DAPI染色液, 4℃避光保存。
1.3.3 挂片实验
将过夜培养的菌液2~4℃下6 000 r/min冷冻离心5 min, 弃去上清用PBS清洗1~2次, 将离心管中沉淀的菌细胞在PBS中悬浮, 利用荧光显微镜计数,制成终浓度 1×107cfu /mL的菌液。将紫外灭菌的316L不锈钢、PVC、玻璃和有机硅(Silastic T2)试片浸泡在菌液中(3次重复试验), 37℃下置于150 r/min的振荡培养箱中培养。
1.3.4 荧光显微镜观察与计数
试片在菌液中培养, 分别于不同采样时间(如1、3、6、24、48、72 h)取出试片, PBS冲洗以除去未黏附细胞, 5%戊二醛固定30 min。取出试片, PBS清洗2~3次, 1mg /L的DAPI染色10 min, PBS冲洗2~3次, 于荧光显微镜(德国ZEISS)下观察不同材料表面对细菌的黏附数量, 拍照计数, 并利用 Image-Pro Plus 6.0软件进行数据分析。
2 结果与分析
2.1 细菌在材料表面随时间变化的附着过程
以S.oneidensisMR-1菌株在有机硅试片表面的附着情况为例, 说明细菌附着随时间变化的规律。图1是有机硅试片在1×107cfu /mL的S.oneidensisMR-1菌液中挂片, 在附着不同时间后的荧光显微镜照片。
图2是有机硅材料(Silastic T2)在1×107cfu /mL的S.oneidensisMR-1菌液中挂片的荧光显微镜计数结果, 利用Image-Pro Plus 6.0软件分析得到试片表面随时间变化附着量如图 2所示。开始呈现上升趋势, 在附着时间3 h时达到峰值, 随之出现短暂的下降趋势, 之后又进入上升的附着阶段且细菌在试片上的附着数量不断增加, 并逐渐形成生物膜体系。
2.2 不同材料试片上污损生物的附着情况
4种不同材料试片上E.coliJM109、P.aeruginosaPAO1、S.oneidensisMR-1三种菌株的附着情况如图3~图5所示。
相同温度条件下, 不同种类材料(玻璃、316L不锈钢、PVC、有机硅)试片在1×107cfu /mL的微生物(S.oneidensisMR-1、E.coliJM109、P.aeruginosaPAO1)菌液中进行的挂片, 结果如图3~5所示, 可以看出,材料表面细菌的附着在达到不可逆黏附阶段后, 不同材料对污损细菌的附着量大小呈现如下趋势:316L不锈钢片>PVC>玻璃, 玻璃材料较其他三种材料表现出较好的防污损特性, 有机硅材料(Silastic T2)表面细菌的附着量时而大于或小于另外三种材料的表面附着量, 具有很大的变动性, 表明材料自身具有不确定特性。
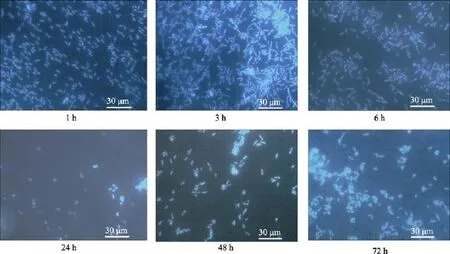
图1 S.oneidensis MR-1在有机硅试片表面的附着规律Fig. 1 The attachment regular pattern of S.oneidensis MR-1 on organic silicon (Silastic T-2)material
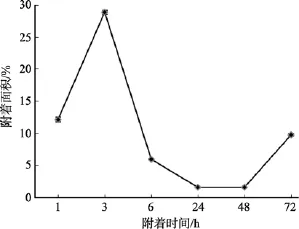
图2 S.oneidensis MR-1在有机硅试片上随时间变化的附着情况Fig. 2 The attachment of S.oneidensis MR-1 on organic silicon (Silastic T-2)material over time
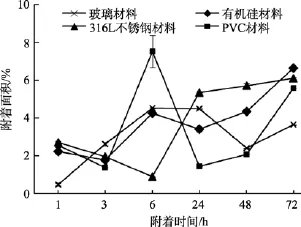
图3 E.coli JM109在不同材料表面的附着情况Fig. 3 The attachment of E.coli JM109 on different materials
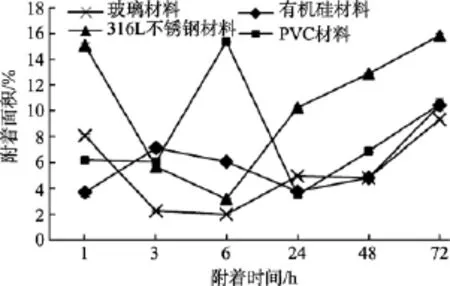
图4 P.aeruginosa PAO1在不同材料表面的附着情况Fig. 4 The attachment of P.aeruginosa PAO1 on different materials
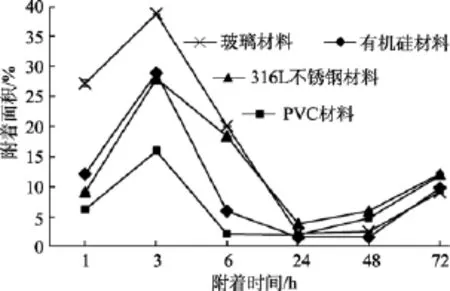
图5 S.oneidensis MR-1在不同材料表面的附着情况Fig. 5 The attachment of S.oneidensis MR-1 on different materials
2.3 同种材料表面不同污损生物的附着情况
同种材料表面污损生物菌株的附着情况如图6~图9所示。
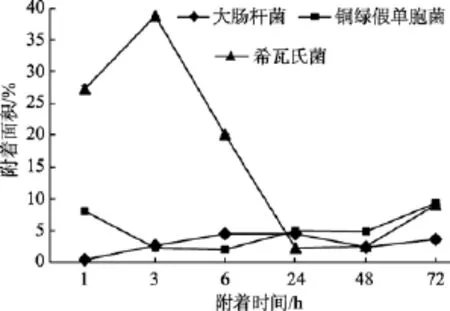
图6 不同细菌在玻璃材料表面的附着情况Fig. 6 The adhesion of different kinds of bacteria on glass material
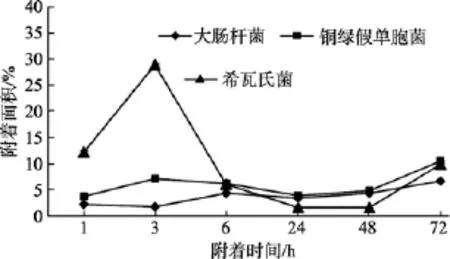
图7 不同细菌在有机硅材料表面的附着情况Fig. 7 The adhesion of different kinds of bacteria on silicone material
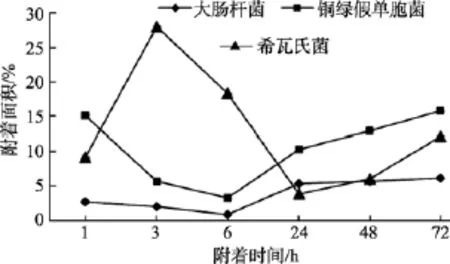
图8 不同细菌在316L不锈钢材料表面的附着情况Fig. 8 The adhesion of different kinds of bacteria on 316L stainless steel
对同种材料而言, 由图6~图9可以看出, 试片上附着细菌的数量呈现如下规律: 菌株S.oneidensisMR-1和P.aeruginosaPAO1在4种材料表面的附着面积均大于菌株E.coliJM109, 可见污损生物在材料表面的附着量跟污损细菌种类具有一定的相关性。
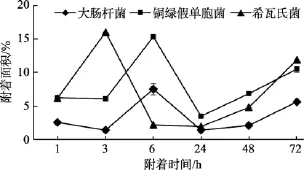
图9 不同细菌在PVC材料表面的附着情况Fig. 9 The adhesion of different kinds of bacteria on PVC material
3 讨论
3.1 细菌在材料表面随时间变化的原因分析
由图2中S.oneidensisMR-1在有机硅材料试片上随时间变化的附着情况看,S.oneidensisMR-1在有机硅材料上的附着面积在1~3 h时间内呈现上升趋势, 在3~24 h时间内呈现下降趋势, 继而又呈现上升趋势。可见在1~3 h是初始附着阶段, 继而3 h左右进入可逆附着阶段, 微生物在表面的附着源于水流、生物体运动或这些进程的联合作用。S.oneidensisMR-1附着数目骤然增加的同时, 由于附着的可逆性, 极易在流速的剪切力或微生物自身鞭毛的作用下脱落, 所以试验中细菌在短暂的数目陡增后, 数目开始减少。进入不可逆附着阶段, 只有牢固黏附的细菌才能在物体表面继续生长并分泌大量胞外聚合物, 并在胞外聚合物的作用下使得溶液中细菌继续黏附, 并形成生物膜。
3.2 材料表面特征与细菌特性影响微生物附着的原因分析
3.2.1 材料表面特性对细菌附着的影响
利用视频显微镜测得四种材料的表面形貌, 如图10所示。
利用静态接触角测试仪测得四种材料表面的静态接触角如图11。
在海洋环境中, 基体材料的理化特性和表面特征均会影响附着生物的数量, 从而影响微生物在机体表面的附着并最终导致生物污损[22]。由实验中材料表面的一些参数结合附着结果可以看出, 粗糙度和材料表面的润湿性(由材料表面静态接触角体现出,接触角越大润湿性越小)是影响污损微生物在材料表面附着的重要因素。由图10和图11可以看出经过打磨的316L不锈钢材料表面疏水性良好(图11), 但依然具有较大的表面粗糙度(图 10), 很容易被污损生物附着; 玻璃有相对较好的亲水表面(图11), 但其均匀光滑的表面形貌(图 10), 使得细菌不易在其表面附着; 接触角大于 98°的材料表面能都低 25 mJ/m2,因此被称为低表面能材料[23], 有机硅材料表面接触角接近于120°(图11), 是典型的高疏水、低表面能材料, 但微生物在材料表面的附着情况还与表面形貌息息相关, 由于在制作过程中易产生气泡, 从图 10可以明显看出有机硅材料的表面形貌较粗糙, 且研究表明有机硅防污材料在水中短时间浸泡会使表面能逐渐增大、防污性变差[24], 这些因素都会使有机硅材料表面细菌附着量变动较大。

图10 4种不同材料的表面形貌Fig. 10 The surface morphology of 4 different materials
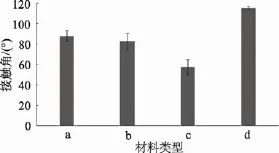
图11 不同材料的静态接触角Fig. 11 The contact angle of different specimen surfaces
此外, 新的研究发现, 有机硅材料体系中, 污损物的释放不仅与表面能有关, 而且与表面能及弹性体模量 E乘积的 1/2次方成正比[25]。实验中有机硅材料具有低表面能, 但具有较高的弹性模量, 两者共同影响着细菌在有机硅材料表面的附着量, 可见除表面能外弹性模量等表面特征参数也是影响材料表面附着差异的主要因素。
3.2.2 细菌特性对微生物附着的影响
生物膜的形成除与营养、水动力等外界环境因素有关外, 与细菌自身的特征也有重要关系。从实验结果 (图 6~图 9)来看,S.oneidensisMR-1菌株和P.aeruginosaPAO1菌株均大于E.coliJM109菌株的附着面积, 这是与不同微生物种类的鞭毛着生情况密切相关的,S.oneidensisMR-1, 单生鞭毛[26]; 铜绿假单胞菌(P.aeruginosaPAO1)单端 1~2根鞭毛[27];E.coliJM109周身鞭毛[5]。端生单鞭毛的杆菌或弧菌接触表面后, 单鞭毛黏附在表面上, 然后菌体横卧附着在表面上, 细菌逐渐地产生侧生鞭毛或黏多糖的纤丝, 使其在表面牢固地附着, 可避免被流体冲刷下来[28-30]。研究发现鞭毛介导的运动性在最初的表面黏附和后期的生物膜形成中都发挥了重要作用[31]。鞭毛介导的运动能使细菌克服表面张力达到物体表面, 也能让黏附的细菌个体从载体表面播散出去[32]。试验中也发现, 三种细菌不同的鞭毛数量和着生方式, 对细菌在材料表面的附着产生了影响, 最终表现出了以上的附着量差异。
微生物胞外聚合物的产生及数量与微生物的种类和生长环境息息相关, 虽然实验中条件是一致的,但微生物的最适环境条件有差异, 再加上微生物种类的差异, 所以胞外聚合物的产生及数量会有很大差异, 这也是导致微生物在材料表面附着差异的重要因素。此外, 细菌表面附着完成后, 具有群体感应的细菌能产生并释放自体诱导物(Autoinducer), 与周围环境进行信息交流, 从而改变其生理活性[5], 进而影响细菌在材料表面生物膜的形成。
由此可见, 由于不同种细菌间鞭毛、胞外聚合物及群体感应机制的差异, 会影响细菌在材料表面的黏附力, 进而影响细菌在同一种材料表面附着, 因此在试验中表现为S.oneidensisMR-1菌株和P.aeruginosaPAO1菌株在材料表面的附着量均大于E.coliJM109菌株的附着。
4 结论
通过对不同污损微生物在不同材料表面的附着情况研究, 得出以下结论:
(1)污损微生物的附着需要经过可逆附着阶段、可逆到不可逆附着的过渡阶段、不可逆附着阶段最后到生物膜发育并最终达到成熟, 在到达不可逆附着阶段之前细菌在材料表面的附着量变化不定, 达到不可逆附着阶段后细菌在材料表面的附着逐渐增多并最终形成成熟的生物膜。
(2)不同种类的材料表面细菌的附着量存在差异。实验中细菌附着量表现为316L不锈钢片>PVC>玻璃, 说明不同种类材料表面的不同性质及化学组成对污损微生物的附着具有影响, 有机硅材料接触角大表面能低, 是典型的高疏水、低表面能材料, 可通过进一步改良材料制作工艺来进行海洋防污。
(3)同种材料表面不同污损细菌的附着量存在差异。实验中表现为:S.oneidensisMR-1菌株和P.aeruginosaPAO1菌株均强于E.coliJM109菌株的附着, 可见不同细菌种类的自身特性(如有无鞭毛、分泌聚合物的多少及种类等)也是影响细菌附着的因素之一, 据此可以调查得出主要污损微生物种类,并有针对性的采取积极的海洋防污措施。
[1]王伟. 海洋环境中微生物膜与金属电化学状态相关性研究[D]. 青岛: 中国科学院海洋研究所, 2003.
[2]Little B, Wagner P, Mansfeld F. An overview of microbiologically influenced corrosion[J]. Electrochemical Acta, 1992, 37(12): 2185-2194.
[3]Van Houdt R, Michiels C W.Role of bacterial cell surface structures in Escherichia coli biofilm formation[J].Research in Microbiology, 2005, 156(5-6): 626-633.
[4]Yebra D M, Kiil S, Dam-Johansen K. Antifouling technology - past, present and future steps towards efficient and environmentally friendly antifouling coatings[J]. Progress in Organic Coatings, 2004, 50(2):75-104.
[5]干霞芳, 李蒙英. 生物膜和生物膜形成菌的研究[J].安徽大学学报(自然科学版), 2007, 31(6): 91-94.
[6]Callow M E, Callow J A.Marine biofouling: a sticky problem[J]. Biologist, 2002, 49(1): 1-5.
[7]Mabboux F, Ponsonnet L, Morrier J J, et al. Surface free energy and bacterial retention to saliva-coated dental implant materials - an in vitro study[J]. Colloids and Surfaces B-Biointerfaces, 2004, 39(4): 199-205.
[8]Brady R F. A fracture mechanical analysis of fouling release from nontoxic antifouling coatings [J]. Progress in Organic Coatings, 2001, 43(1-3): 188-192.
[9]O'Toole G, Kaplan H B, Kolter R. Biofilm formation as microbial development[J]. Annual Review of Microbiology, 2000, (54): 49-79.
[10]Stoodley P, Wilson S, Hall-Stoodley L, et al. Growth and detachment of cell clusters from mature mixed-species biofilms[J]. Applied and Environmental Microbiology, 2001, 67(12): 5608- 5613.
[11]Berntsson K M, Andreasson H, Jonsson P R, et al. Reduction of barnacle recruitment on micro-textured surfaces: Analysis of effective topographic characteristics and evaluation of skin friction[J]. Biofouling, 2000,16(2-4): 245-261 .
[12]Berntsson K M, Jonsson P R, Lejhall M, et al. Analysis of behavioural rejection of micro- textured surfaces and implications for recruitment by the barnacle Balanus improvisus[J]. Journal of Experimental Marine Biology and Ecology, 2000, 25(1): 59-83.
[13]Granhag L M, Finlay J A, Jonsson P R, et al. Roughness-dependent removal of settled spores of the green algaUlva(syn.Enteromorpha)exposed to hydrodynamic forces from a water jet[J]. Biofouling, 2004, 20(2): 117-122.
[14]Callow1 J A, Callow M E, Ista L K, et al.The influence of surface energy on the wetting behaviour of the spore adhesive of the marine algaUlva linza(synonym Enteromorpha linza)[J]. Journal of the Royal Society Interface,2005, (3): 1-7.
[15]Elek L. A low surface free energy approach in the control of marine biofouling [J]. Biofouling, 1992, 5(2):193-205.
[16]陈美玲, 张力明, 杨莉, 等. 低表面能船舶防污涂料的疏水结构及防污性能[J]. 船舶工程, 2010, 32(6):64-67
[17]Laque F L. Topic for research in marine corrosion[J].Materials Performance, 1982, 21(4): 13-18.
[18]郑纪勇. 海洋生物污损与材料腐蚀[J]. 中国腐蚀与防护学报, 2010, 30(2): 171-176.
[19]Carman M L, Estes T G, Feinberg A W, et al. Engineered antifouling microtopographies- correlating wettability with cell attachment[J]. Biofouling, 2006, 22(1):11-21.
[20]Schumacher J F, Carman M L, Estes T G, et al. Engineered antifouling microtopographies-effect of feature size, geometry and roughness on settlement of zoospores of the green algaUlva[J]. Biofouling, 2007,23(1): 55-62.
[21]Scardino A J, Guenther J, de Nys R. Attachment point theory revisited: the fouling response to a microtextured matrix[J]. Biofouling, 2008, 24(1): 45-53.
[22]Sieburth J M, Tootle J L . Seasonality of microbial fouling on Ascophyllum-nodosum(L)lejol, focus-vesiculosus L polysiphonta-lanosa(L)tandy and chondrus-crispus stackh[J].Journal of Phycology, 1981,17(1): 57-64.
[23]邱武高. 有机硅海洋防污涂层研究[D], 大连: 大连海事大学, 2011.
[24]魏宽文, 袁东武. 无毒防污涂料[J]. 涂料工业,1992(6): 35-38.
[25]边蕴静. 新型海洋涂料技术[J]. 化工新型材料, 2002,30(6): 25-28.
[26]梁伊丽, 奥奈达希瓦氏菌气液界面生物膜的生长及其机制研究[D], 长沙: 中南大学, 2009.
[27]谷海瀛. 铜绿假单胞菌鞭毛功能的影响因素及其致病性[J]. 中华微生物学和免疫学杂志, 2008, 28(12):1149-1152.
[28]Belas M R, Colwell R R. Adsorption-kinetics of laterally and polarly flagellated Vibrio[J]. Journal of Bacteriology, 1982, 151(3): 1568-1580.
[29]汪仁莉, 张玉玲, 张成莲. 细菌生物膜的研究进展[J].宁夏农学院学报, 2003, 24(4): 77-80.
[30]纪伟尚, 许兵, 徐怀恕. 海洋细菌在生物表面和非生物表面附着的研究[J]. 青岛海洋大学学报, 1991,21(2): 61-68.
[31]Lemon K P, Higgins D E, Kolter R. Flagellar motility is critical for Listeria monocytogenes biofilm formation[J]. Journal of Bacteriology, 2007, 189(12): 4418-4424.
[32]Gavin R, Rabaan A A, Merino S, et al. Lateral flagella of Aeromonas species are essential for epithelial cell adherence and biofilm formation[J].Molecular Microbiology, 2002, 43(2): 383-397.
