海洋链霉菌M506的鉴定及代谢产物抑菌活性初步研究
2012-10-13朱本伟李富超
朱本伟 , 李富超 秦 松
(1. 中国科学院 烟台海岸带研究所, 山东 烟台 264003; 2. 中国科学院 海洋研究所 海洋生物学重点实验室,山东 青岛 266071; 3. 中国科学院 研究生院, 北京 100049)
半个世纪以来, 陆生微生物成为抗生素等各种生物活性物质的重要来源, 但由于资源匮乏、研究方法滞后及筛选模型的陈旧, 近年来寻找到具有全新结构或特殊活性化合物的几率大幅度下降。海洋中蕴藏着丰富的微生物资源, 海洋微生物可能具有陆生微生物所不具有的化合物结构及生物活性, 海洋微生物尤其是海洋放线菌成为新结构活性化合物的重要来源[1]。近年来, 每年发现的新颖海洋新天然产物化合物分子超过1 000个, 而其中海洋微生物来源的新化合物也呈逐年递增的趋势[2-4]。
青岛胶州湾是典型的半封闭型浅水海湾, 水产养殖、港口设施等人类活动影响明显, 陆源物质输入丰富, 微生物种类繁多, 尤其是海洋放线菌多样性丰富。本实验室开展了多年的胶州湾沉积物海洋放线菌次级代谢产物的研究, 发现了一批具有抗菌、抗肿瘤等显著生物活性的新结构化合物[5-9], 并且建立了培养条件的优化技术, 通过海洋链霉菌培养条件的改变, 诱导其产生了一系列新结构化合物[5-6]。因此本研究对分离自胶州湾沉积物中的一株海洋链霉菌M506, 进行形态特征观察、生理生化特征实验及分子鉴定, 并通过培养条件优化, 研究其次级代谢产物对受试细菌的生物活性。
1 材料与方法
1.1 材料
菌株M506分离自青岛胶州湾沉积物, 保存于高氏一号固体培养基中。选择 6种培养基进行培养条件优化: 高氏一号培养基(GI)、Zobell海洋细菌培养基(ZB)、蛋白胨-酵母粉培养基(LB), 以及豆粉-甘露醇培养基(SM)、麦芽浸粉培养基(M2+)和牛肉浸膏培养基(ME)[6]。
受试菌株: 金黄色葡萄球菌(Staphylococcus aureus), 大肠杆菌(Escherichia coli), 枯草芽孢杆菌(Bacillus subtilis), 苏云金芽孢杆菌(Bacillus thuringiensis), 受试菌培养基为LB培养基。
1.2 培养特征
菌株M506划线接种于M2+固体培养基中, 将灭菌后的盖玻片斜插到培养基中, 28℃恒温培养4~5 d,使菌丝体和孢子能附着生长在盖玻片上, 取出盖玻片分别置于光学显微镜和扫描电子显微镜下观察菌丝体形态和孢子特征。
1.3 生理生化特征
参照《链霉菌鉴定手册》及国际链霉菌计划(ISP),并补充使用杭州微生物试剂有限公司生产的非发酵细菌生化编码鉴定管, 对菌株M506进行生理生化特征实验。
1.4 16S rDNA序列测定与系统发育分析
菌株 M506基因组总 DNA提取: 参照文献[10]的酚/氯仿抽提方法。
16S rDNA的PCR扩增和测序: 以菌株M506基因组DNA为模板, 利用引物P1 (27F): 5'-AGAGTTT GATCATGGCTCAG-3'和P2 (1390R): 5'-ACGGGC GGTGTCTACAA-3'进行 PCR扩增。PCR总体系为20 μL: 超纯水 14.4 μL, 10×PCR Buffer 2 μL, 引物P1 和 P2 各 1 μL, 10 mmol/L dNTP 0.4 μL, Taq 酶 0.2 μL, 基因组DNA1μL。PCR反应程序为: 94℃预变性5 min; (94℃变性50 s, 56℃退火50 s, 72℃延伸1.5 min)×30个循环; 72℃延伸10 min。把PCR产物进行琼脂糖凝胶电泳, 然后利用 TIANgel Midi Purification Kit(天根生化科技有限公司)进行 DNA 回收,回收产物连接到 pMD18-T(TakaRa公司)载体, 并转化到大肠杆菌Top10中, 挑取阳性克隆, 送上海美吉生物医药科技有限公司测序。
系统发育树分析: 通过BLAST软件从GenBank获得与菌株 M506亲缘关系最近的典型链霉菌菌株的16S rDNA序列, 用Clustal X软件进行多序列比对,利用MEGA 4.0软件包进行统计及聚类分析, 采用邻接法构建系统进化树, 通过自举分析(bootstrap)进行置信度检测, 自举数据集为1 000次。
1.5 不同培养基对抑菌活性的影响
从菌株M506固体培养基上, 切取长有丰富菌落的1 cm2大小的琼脂块, 接种到250 mL的GI、ZB、 L B、SM、M2+和ME六种液体培养基中, 28℃振荡培养4~5 d。发酵液冷冻干燥后, 用乙酸乙酯浸提5~6次, 旋转蒸发后获得粗提物, 溶于 1 mL甲醇/氯仿(1:1)混合溶剂中备用。
抑菌试验采用抑菌纸片法: 将培养至对数期的受试菌株培养液和熔化的LB固体培养基混合, 倒入已铺有一层LB固体培养基的平皿中, 待培养基充分凝固。用已消毒过的直径6 mm的滤纸片吸取30 μL粗提物溶液, 充分挥干溶剂后, 将纸片贴于培养基表面, 于 37℃培养 24 h后, 测量透明圈直径, 每株受试菌做三组平行实验, 抑菌圈直径取平均值。
2 结果
2.1 菌株的培养特征
链霉菌 M506在 M2+固体培养基上生长良好, 产生灰色孢子, 基内菌丝体无可溶性色素, 菌丝体短而弯曲, 分支少, 无横隔, 顶端断裂成孢子, 孢子呈椭球状, 表面有突起(图 1-a), 孢子链呈螺旋状(图 1-b), 孢子断裂方式可能为孢子两端向中心收缩。
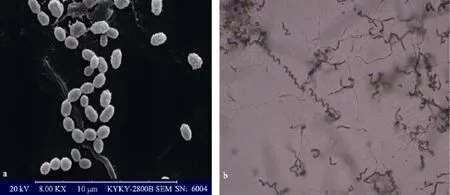
图1 菌株M506孢子链的显微照片Fig. 1 Spore micrograph of marine strain M506
2.2 菌株的生理生化特征
如表1所示, 菌株M506可以利用葡萄糖、果糖、木糖及阿拉伯糖, 具有明胶液化、牛奶凝固、牛奶胨化等产酶活性。

表1 菌株M506与灰略红链霉菌的生理生化特征比较Tab. 1 Comparison of physiological and biochemical characteristics between strain M506 and Streptomyces griseorubens
2.3 菌株M506的16S rDNA序列分析
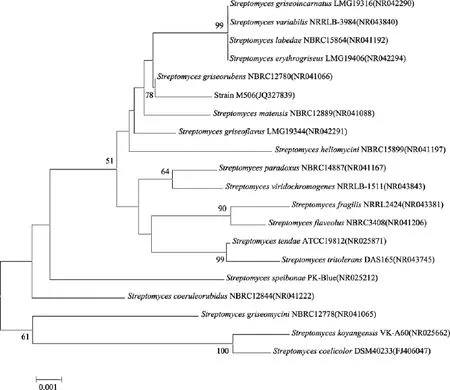
图2 菌株M506及相关菌株的16S rDNA 系统发育树Fig. 2 Phylogenetic tree based on 16S rDNA sequence showing the positions of strain M506 and related taxa.
菌株M506的16S rDNA序列测定结果共1381bp,GenBank登录号为 JQ327839。序列经过校对后, 与GenBank序列数据库中的已有序列进行比较, 根据序列同源性从高到低的次序选取典型菌株的序列用于序列分析和构建系统发育树, 如图 2所示, 菌株M506与灰略红链霉菌Streptomyces griseorubensNBRC 12780亲缘关系最近, 相似性为99%, 结合生理生化特征, 可以利用葡萄糖, 不能利用蔗糖, 不产硫化氢, 氧化酶水解阳性, 硝酸盐还原酶阴性等, 大部分特征一致[11-12], 因此将菌株M506可以鉴定为灰略红链霉菌。
2.4 不同培养基对菌株代谢产物组成及抑菌活性影响
通过抑菌纸片法活性试验发现, 菌株 M506在M2+培养基和 SM 培养基中培养得到的粗提物对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和苏云金芽孢杆菌均具有较强的抑制活性(抑菌圈直径大于16 mm), 如表2所示。而在其他四种培养基中培养所得到的粗提物只对枯草芽孢杆菌具有抑制活性, 因此, 海洋链霉菌M506在不同的培养条件下所产生的次级代谢产物组分和活性均有显著差异, 可以指导我们选择合适的培养条件有目的分离纯化有活性的化合物。
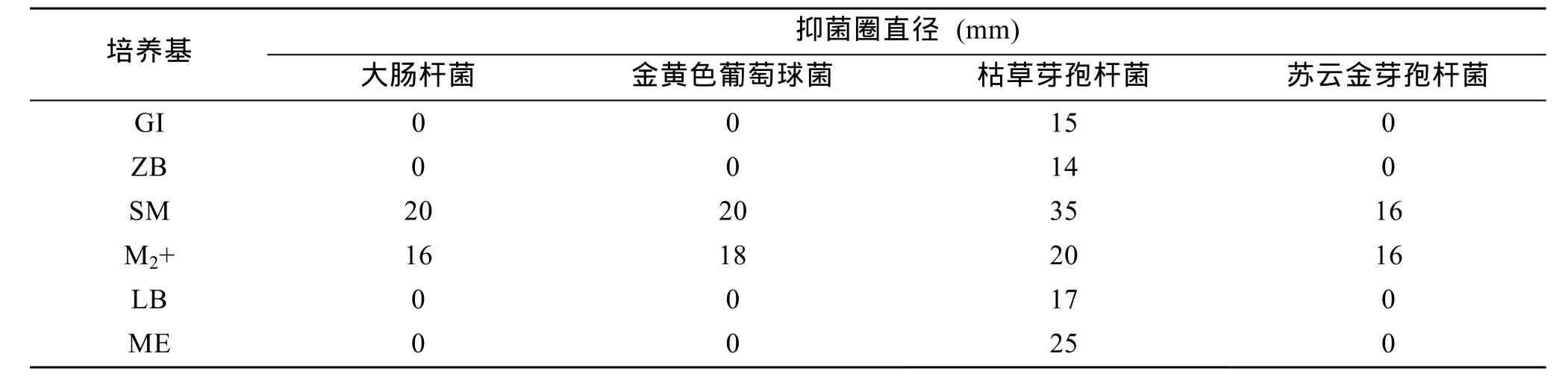
表2 菌株M506在不同培养条件下的粗提物抑菌活性Tab. 2 Antimicrobial activities of strain M506 crude extracts from different culture conditions
3 讨论
近年来, 陆地放线菌产生新颖结构化合物的概率在下降, 而新的疾病和病原微生物耐药性的增加,使寻找新型活性先导化合物显得极为迫切, 而海洋放线菌尤其是海洋链霉菌由于其生存环境的特殊性与多样性, 使其具有特殊次级代谢途径的潜力, 成为新颖活性物质的重要来源。本实验室通过对胶州湾海洋链霉菌的分离和筛选, 建立了包括培养条件优化、活性筛选以及化学去重复等一系列有效的天然产物研究方法, 鉴定出了一批具有良好生物活性的新结构化合物[5-9]。其中采用 6种不同培养基, 24种培养条件对海洋链霉菌M045的代谢产物分析, 获得了具有较强抗肿瘤活性的新结构化合物chinikomycin A和chinikomycin B[6]。对海洋链霉菌M518培养条件进行优化, 获得了抗肿瘤活性极强的新结构星形孢菌素等化合物[7]。因此本论文针对海洋链霉菌 M506, 通过不同培养基进行培养, 研究了其代谢产物的组分和活性差异, 发现在M2+和SM培养基中的代谢产物对于大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和苏云金芽孢杆菌均具有较强的抑制活性, 抑菌圈直径大于 16 mm, 代谢产物的薄层层析分析(结果未显示), 直观地反映出其代谢产物组成上的差别, 可以有效指导我们下一步活性化合物的分离。因此, 在海洋链霉菌次级代谢产物分离中,培养条件优化是提高新结构活性化合物发现几率的很好的策略。
本研究同时对菌株M506进行了鉴定, 通过形态观察具有典型的链霉菌特征, 16S rDNA序列分析发现其与灰略红链霉菌Streptomyces griseorubensNBRC 12780亲缘关系最近, 相似性高达99%, 结合生理生化特征实验, 与灰略红链霉菌的典型菌株特征基本相同, 所以我们把菌株M506鉴定为灰略红链霉菌的一个菌株。而叶亮[11]、杨文鸽[12]以及肖静[13]等也分别报道了从海洋沉积物中分离得到了与灰略红链霉菌相似的链霉菌, 并且发现代谢产物具有抗菌和抗肿瘤等活性[14]。与陆生链霉菌-灰略红链霉菌相比较, 该菌株在形态特征方面基本上无明显差异,但在碳源利用等生理生化特性方面较有不同, 由于该菌株采自海底沉积物, 由于生境的不同, 会造成两者在代谢途径、遗传及生态功能方面存在差异。本研究通过培养条件优化, 获得了海洋链霉菌M506产抑菌活性次级代谢产物的培养条件, 而海洋灰略红链霉菌次级代谢产物的分离纯化鲜有报道, 因此该研究下一步工作将对链霉菌 M506进行大规模发酵培养, 从其次级代谢产物中分离得到具有活性的化合物分子。
[1]Fenical W. Chemical studies of marine bacteria: developing a new resource [J]. Chem Rev, 1993, 93(5):1673-1683.
[2]Blunt J W, Copp B R, Hu W P, et al. Marine natural products [J]. Nat Prod Rep, 2009, 26: 170-244.
[3]Blunt J W, Copp B R, Hu W P, et al. Marine natural products [J]. Nat Prod Rep, 2010, 27: 165-237.
[4]Blunt J W, Copp B R, Hu W P, et al. Marine natural products [J]. Nat Prod Rep, 2011, 28: 196-268.
[5]Maskey R P, Li F, Qin S, et al. Chandrananimycins A-C:production of novel anticancer antibiotics from a marinActinomadurasp. isolate M048 by variation of medium composition and growth conditions [J]. J Antibiot, 2003,56(7): 622 -629.
[6]Li F, Maskey R P, Qin S, et al.Chinikomycins A and B:isolation, structure elucidation, and biological activity of novel antibiotics from a marineStreptomycessp.isolate M045 [J]. J Nat Prod, 2005, 68:349-353.
[7]Wu S J, Fotso S, Li F, et al. N-carboxamido-staurosporine and selina-4(14),7(11)-diene-8,9-diol, new metabolites from a marineStreptomycessp. [J]. J Antibiot,2006, 59(6): 331-337.
[8]Wu S J, Fotso S, Li F, et al. Amorphane Sesquiterpenes from a MarineStreptomycessp. [J]. J Nat Prod, 2007,70: 304-306.
[9]Ding L, Pfoh R, Rühl S, et al. T-muurolol sesquiterpenes from the marineStreptomycessp. M491 and revision of the configuration of previously reported amorphanes [J]. J Nat Prod, 2009, 72: 99-101.
[10]李富超. 胶州湾两株海洋放线菌次级代谢产物的研究[D]. 北京: 中国科学院研究生院, 2004.
[11]叶亮, 程沁园, 那广水, 等. 海洋放线菌 WBF7的鉴定及其抗肿瘤代谢产物的初步研究 [J]. 中国海洋药物杂志, 2007, 26(3): 45-49.
[12]杨文鸽, 楼乔明, 徐大伦, 等. 海洋放线菌 XS904分类鉴定及其发酵液抑菌活性的研究 [J]. 海洋与湖沼,2008, 39(5): 469-474.
[13]肖静, 洪专. 红树林沉积物来源链霉菌 HA6菌株发酵条件的优化 [J]. 台湾海峡, 2011, 30(4): 589-593.
[14]Ye L, Zhou Q F, Liu C H,et al. Identification and fermentation optimization of a marine-derivedStreptomyces griseorubenswith anti-tumor activity [J]. Indian J Mar Sci, 2009, 38(1): 14-21.
