山东半岛镆铘岛潮间带大型底栖动物群落特征
2012-10-13李新正王洪法张宝琳王金宝
黄 慧 , 李新正 王洪法 张宝琳 王金宝 马 林
(1. 中国科学院 海洋研究所, 山东 青岛 266071; 2. 中国科学院 研究生院, 北京 100049)
潮间带是沿岸带位于最高高潮线到最低低潮线之间的区域, 处于陆海过渡带。大型底栖动物是潮间带生态系统重要组成部分, 其种类组成和现存量受各种理化环境因子以及人类活动影响较为显著。潮间带底栖生物的生态调查研究一直备受关注, 早在20世纪30年代张玺[1]就对胶州湾进行过考察。近年来由于经济动物养殖、污水排放、旅游等人为干扰日益加剧, 对潮间带群落生态学等方面的研究也越来越多[2-9]。
镆铘岛位于山东省荣成市东南端, 四面环海,东临黄海, 西靠我国北方最大的渔港——石岛港, 镆铘岛渔港在该岛西北侧(图1)。镆铘岛潮间带底质主要为沙质和砾石, 滩涂上主要开展海参养殖。由于港口作业和养殖等人类活动对镆铘岛潮间带生境的扰动不断加强, 使该岛潮间带大型底栖动物类群也在发生着变化。因此, 了解镆铘岛潮间带大型底栖动物群落的现状对于研究这种变化并预测其变化趋势十分重要。本研究的目的是通过对镆铘岛潮间带大型底栖动物的群落结构特征的描述, 为保护和进一步跟踪镆铘岛及其附近生态环境的变化提供基础资料。
1 材料与方法
本研究在镆铘岛南洼村潮间带的高、中、低潮区各设一个采样站(表 1), 于 2007年 1、4、7和 10月(分别代表冬季、春季、夏季、秋季)最低潮时, 取一个垂直于海岸的断面, 在断面高、中、低潮区各设一个采样站, 以 GPS定位, 对大型底栖动物进行定量和定性调查采样。潮间带垂直距离约为 60 m, 高潮带和中潮带采样站位相距约为 35 m, 中潮带和低潮带相距约为25 m, 具体经纬度见表1。定量采集用面积为0.25 m2的采样框重复2次以减少数据的偶然性, 具体步骤为先拣取框内表面的大型生物, 然后再挖采样框内底泥至约30 cm深, 用孔径1.0 mm的筛子冲洗去泥, 两次取样获得样品合并分析; 定性采样是在定量采集站附近尽可能多地采集生物样品,以补充定量采集生物种类的不足。所有样品用 75%的酒精固定后带回实验室, 定量样品由分类专家鉴定后进行个体计数、称质量(湿质量), 计算栖息密度和生物量, 并对所获数据进行统计分析, 定性样品仅用于生物种类组成分析。调查方法、样品处理和数据获取方法均按照《海洋调查规范》(GB/T12763-2007)进行。

图1 镆铘岛潮间带采样站位示意图Fig. 1 Sampling stations of the intertidal zone in the Moye Island, Shandong Peninsula

表1 2007年镆铘岛潮间带大型底栖动物采样站位Tab. 1 Macrobenthic sampling stations of intertidal zone from Moye Island, Shandong Peninsula in 2007

2 结果
2.1 种类组成
本次在镆铘岛潮间带共采集到大型底栖动物 92种(附录 1), 包括多毛类环节动物 11科 22种, 软体动物17科28种, 甲壳动物18科33种, 棘皮动物2科2种, 扁形动物1种, 腔肠动物2种, 鱼类3种(表2)。其中定量采集到63种, 包括多毛类环节动物18种, 占总种数的29.03%; 软体动物19种, 占30.65%;甲壳动物21种, 占33.87%; 其他类群4种(鱼类2种,腔肠动物2种), 占6.45%。定性共采集到55种, 与定量采集的非共有种为29种, 其中包括定量采集中没出现的2种棘皮动物和1种扁虫。
2007年镆铘岛潮间带的优势种及其优势度(优势度Y>0.02)为: 菲律宾蛤仔(Ruditapes philippinarum, 0.470)、多齿沙蚕(Nereis multignathaImajima et Hartman, 0.025)和一种蜾蠃蜚(Corophiumsp.,0.022)。
从空间分布来看, 中潮带的物种数最多, 为 33种, 低潮带的最少, 为 25种; 在物种组成上高潮带和中潮带以甲壳动物物种数最高, 而低潮带以软体动物物种数居多。根据 Primer软件分析得到, 中潮带和低潮带首先聚在一起, 物种平均相似度为55.62%, 菲律宾蛤仔(Ruditapes philippinarum), 蜾蠃蜚(Corophiumsp.)和多齿沙蚕(Nereis multignatha)为特征种, 累积相似贡献率达到 63.80%。高潮带同中潮带、低潮带差异最大的物种是菲律宾蛤仔(Ruditapes philippinarum), 毛近缘玻璃钩虾(Parhyale plumulosa)以及多齿围沙蚕(Nereis multignatha), 累积差异贡献率达到了27.05%。
从季节分布来看, 夏季采到的物种数最多, 为25种, 秋季和冬季则最少, 均为 20种; 在物种组成上冬季三大主要类群物种数分布较均匀, 春季软体动物物种数最低, 夏季软体动物物种数最高, 秋季多毛类环节动物物种数最低(图2)。
2.2 生物量与栖息密度
镆铘岛潮间带大型底栖动物的平均生物量为81.74 g/m2, 其中软体动物最高, 为72.74 g/m2, 其次为多毛类环节动物, 为 5.09 g/m2; 平均栖息密度为329.67个/m2, 软体动物仍占据优势, 为 182.00 个/m2, 其次是甲壳动物, 为98.00个/m2。

表2 镆铘岛潮间带大型底栖动物物种名录及分布Tab. 2 Species list and distribution of macrobenthos from the intertidal zones of Moye Island, Shandong Peninsula

续表2

图2 2007年镆铘岛潮间带大型底栖动物不同季节(A)和不同潮带(B)各类群物种数Fig. 2 Seasonal (A)and spatial (B)species numbers of macrobenthic groups from the intertidal zones of Moye Island, Shandong Peninsula in 2007
在空间分布上, 镆铘岛各潮带大型底栖动物的栖息密度以中潮带为最高, 为 380 个/m2, 其优势类群为软体动物, 高潮带最低, 为 290个/m2。大型底栖动物的平均生物量以低潮带最高, 为146.69 g/m2,其中软体动物贡献最大, 高潮带最低, 为37.55 g/m2(图 3)。
在季节变化上, 镆铘岛大型底栖动物的高栖息密度和高生物量季节出现在夏季, 栖息密度和生物量分别为773.33个/m2和232.99个/m2, 软体动物贡献最大。低栖息密度季节出现在冬季, 其栖息密度为96个/m2, 低生物量季节则出现在秋季, 生物量为14.27 g/m2(图 3)。

图3 2007年镆铘岛潮间带不同季节不同潮带大型底栖生物主要类群栖息密度和生物量Fig. 3 Spatial and seasonal abundances and biomasses of macrobenthic groups from the intertidal zones of Moye Island,Shandong Peninsula in 2007
2.3 群落物种多样性
调查研究区域内大型底栖动物物种丰度指数(D)在三个潮区存在差异, 顺序为中潮带(1.74)>低潮带(1.45)>高潮带(1.43)。调查区域物种均匀度指数(J)差别较小, 为 0.62~0.70。Shannon-Wiener多样性指数(H')平均值为1.95~2.19, 高潮带最高 (图4)。
物种丰度指数D在四个季度相差不大, 为1.37~1.71, 冬季最低, 春季最高; 物种均匀度指数(J)变化规律为冬季(0.78)=秋季(0.78)>春季(0.65)>夏季(0.43); 冬季、春季和秋季物种多样性指数(H')相差不大, 为2.15~2.35, 夏季最低, 为1.48 (图 4)。
3 讨论
3.1 种类组成
综合定量和定性采集结果, 本次调查共采到大型底栖动物92种, 各主要动物类群的物种数为甲壳动物>软体动物>多毛类环节动物>棘皮动物, 优势种中菲律宾蛤仔占绝对优势。镆铘岛潮间带与同样位于山东半岛的乳山口和胶州湾潮间带的物种数、种类组成各不相同, 这可能与底质类型不同密切相关。底质的特性是控制底栖动物分布的重要因子, 底质的组成状况直接影响种类分布和数量特征[13]。镆铘岛潮间带底质多样, 为岩石、石块、砾石、粗砂, 导致其物种比较丰富; 乳山口潮间带均为砂质, 中潮带为细砂, 物种数为 41种, 软体动物>甲壳动物>多毛类环节动物[6]; 胶州湾红石崖以砂和粉砂为主, 还包括黏土和砾石, 物种总数为 89种, 多毛类环节动物和软体动物物种数为最多[14]; 胶州湾女姑口由黏土、砂和软泥构成, 总物种数为 57种, 软体动物最多, 其次是甲壳动物和多毛类环节动物[4]。
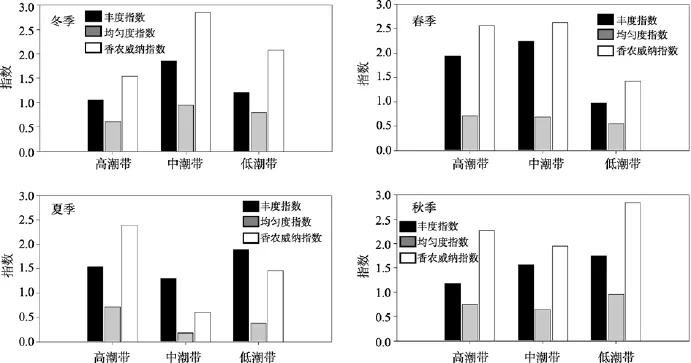
图4 2007年镆铘岛潮间带大型底栖动物物种多样性、丰度和均匀度指数Fig. 4 The seasonal species richness (D), evenness indices (J)and Shannon-Wiener (H')of macrobenthos from the intertidal zones of Moye Island, Shandong Peninsula in 2007
镆铘岛潮间带大型底栖动物优势种组成与乳山口潮间带、胶州湾潮间带的优势种组成也不相同, 镆铘岛潮间带的优势种中虽然多毛类环节动物、软体动物、甲壳动物都有, 但是不及胶州湾潮间带[5]优势种丰富, 这与胶州湾潮间带物种采样时底质为沙、泥沙和软泥, 底质多样有关[5]。镆铘岛潮间带优势种中菲律宾蛤仔占绝对优势, 而乳山口潮间带[6]的优势种是多毛类环节动物占优势。
此外, 镆铘岛潮间带物种比较丰富, 特殊的种类组成与其特殊的生境密切相关: 因其特殊的地理位置,同时采样潮间带两侧为养殖池, 不易受到大的风浪的干扰, 其生境相对稳定; 养殖池水的排放致使该潮间带的水质有机质含量较高, 适合生物的生存。
3.2 时空动态
从时间尺度看, 调查区大型底栖动物现存量的季节变化总体呈现夏季最高, 秋季下降, 冬季最低,春季回升的趋势, 这主要与优势种的消长有关。四个季节各类群中以夏季软体动物的栖息密度和生物量为最大, 主要由于夏季菲律宾蛤仔进入繁殖期, 其幼体补充进入群落, 这与吴耀泉[15]认为的山东沿海菲律宾蛤仔的产卵期相吻合。菲律宾蛤仔的潮区分布受波浪、潮汐、潮流及挖蛤等人类干扰因素的影响[16]。夏季中潮带菲律宾蛤仔的栖息密度(936个/m2)大于低潮带(736个/m2), 但是中潮带的生物量(131.08 g/m2)却小于低潮带(459.35 g/m2), 这与个体较大的菲律宾蛤仔较易出现在低潮带有关。秋季生物量最低, 软体动物的栖息密度和生物量下降明显,以软体动物菲律宾蛤仔尤为突出, 而甲壳动物栖息密度开始上升。马绍赛等[17]对山东半岛乳山湾滩涂养殖菲律宾蛤仔在夏季(主要是8月下旬至9月中旬)发生大规模死亡的现象进行了研究, 认为夏季潮间带底质的高温是造成菲律宾蛤仔大规模死亡的主要原因, 硫化物、细菌及其处于繁殖期也加剧了蛤仔的死亡。本次调查秋季采样时间为10月中旬, 软体动物栖息密度与生物量明显下降与菲律宾蛤仔在夏季高温期死亡有关, 不过该论断还有待证实。冬季大型底栖动物的栖息密度为最低, 其中多毛类环节动物和甲壳动物的栖息密度在全年中最低。春季, 大型底栖动物的栖息密度又开始回升, 这时甲壳动物的栖息密度达到最大, 主要由个体较小的甲壳动物蜾蠃蜚、毛近缘玻璃钩虾以及异跳钩虾增多所致。
3.3 多样性指数
张永普等[18]调查发现北麂列岛潮间带大型底栖生物的物种多样性指数(H')变化趋势为低潮带>中潮带>高潮带; 李新正等[5]对胶州湾女姑口和红石崖三个潮带的大型底栖动物的生态调查也得到这个结果,而镆铘岛潮间带多样性指数H'为高潮带>中潮带>低潮带。多样性指数的大小与物种种数和物种个数分布的均匀度有关。物种数越多, 个体分布越均匀, 物种多样性指数越高; 物种数越少, 物种分布越不均匀, 优势种的优势度越大, 物种多样性指数越低[19-20]。在三个潮带中, 高潮带的物种数较多, 物种均匀度指数最高, 为 0.74, 而中潮带和低潮带采集到的菲律宾蛤仔较多, 分别占到了该区物种个数的66.2%和 68.8%, 优势种作用明显, 导致高潮带物种多样性指数最高。张永普等[18]认为, 低潮区藻类的生长为底栖动物提供了丰富的食物来源, 物种数相对较多, 物种多样性指数高。但镆铘岛低潮带由于受养殖场及渔船停靠等人类活动的影响显著, 物种数低,物种多样性指数最低。
陶世如等[21]对长江口潮间带的研究发现, 横沙岛和长兴岛潮间带大型底栖动物多样性指数在春秋两季无差异, 九段沙潮间带多样性指数为春季大于秋季。廖一波等[22]对嵊泗岛潮间带进行生态学调查,认为物种多样性指数(H')在春秋两季无差别。镆铘岛潮间带多样性指数季节变化规律为秋季>春季>冬季>夏季。吴耀泉[15]认为山东沿海菲律宾蛤仔的产卵期约为 5~10月, 夏季优势种菲律宾蛤仔大量繁殖, 占到该季总物种种数的74.1%, 优势种过于显著, 同时其他季节物种分布较均匀, 所以多样性指数都高于夏季。
致谢: 本项目组李宝泉、韩庆喜、蔡文倩、董栋、董超、王晓晨、孙德海、寇琦、彭松耀、隋吉星、许鹏、甘志彬等分别参与野外采样调查、样品分析或在论文写作上给予帮助, 中国科学院海洋生物标本馆管理人员为本研究的样品分析给予大力协助, 在此一并表示衷心感谢。
[1]张玺. 胶州湾海产动物采集团第一期采集报告[J].北研动物所丛刊, 1935, 11: 1-95.
[2]鲍毅新, 葛宝明, 郑祥, 等. 温州湾天河滩涂大型底栖动物群落分布与季节变化[J]. 动物学报, 2006,52(1): 45-52.
[3]毕春娟, 陈振楼, 许世远, 等. 长江口潮滩大型底栖动物对重金属的累积特征[J]. 应用生态学报, 2006,17(2): 309-314.
[4]李宝泉, 张宝琳, 刘丹运, 等. 胶州湾女姑口潮间带大型底栖动物群落生态学研究[J]. 海洋科学, 2006,30(10): 15-19.
[5]李新正, 李宝泉, 王洪法, 等. 胶州湾潮间带大型底栖动物的群落生态[J]. 动物学报, 2006, 52(3):612-618.
[6]马林, 王洪法, 帅莲梅. 乳山口西村潮间带大型底栖动物生态学研究[J]. 海洋科学, 2009, 33(6): 29-34.
[7]寿鹿, 廖一波, 徐晓群, 等. 福清核电站邻近潮间带大型底栖生物数量分布与群落结构[J]. 海洋学研究,2009, 27(2): 42-50.
[8]王晓晨, 李新正, 王洪法, 等. 黄河口岔尖岛, 大口河岛和望子岛潮间带秋季大型底栖动物生态学调查[J]. 动物学杂志, 2008, 43(6): 77-82.
[9]袁兴中, 刘红, 陆健健. 长江口新生沙洲底栖动物群落组成及多样性特征[J]. 海洋学报, 2002, 24(2):133-139.
[10]Shannon C E, Weaver W. The Mathematical Theory of Communication[M]. Ubana: University of Illinois Press,1949: 1-144.
[11]Margalef R. Perspective In Ecological Theory[M].Chicago: University of Chicago Press, 1968: 1-111.
[12]Pielou E C. Ecological diversity[M]. New York: John Wiley, 1975: 1-163.
[13]Sanders H L. The biology of marine bottom communities[J]. Bull Bingham Oceanogr Coll, 1956, 15:345-414.
[14]王洪法, 李宝泉, 张宝琳, 等. 胶州湾红石崖潮间带大型底栖动物群落生态学研究[J]. 海洋科学, 2006,30(9): 52-57.
[15]吴耀泉. 中国近海菲律宾蛤仔的生态研究[C]//中国科学院海洋研究所. 海洋科学集刊. 北京: 科学出版社, 1995, 36: 213-216.
[16]吴耀泉. 胶州湾菲律宾蛤仔渔场环境及饵料分析[C]//贝类学会. 贝类学论文集Ⅷ辑. 北京: 学苑出版社, 1999, 86-90.
[17]马绍赛, 周诗赉, 陈聚法, 等. 滩涂养殖菲律宾蛤仔死亡及生态效应调查研究[J]. 海洋水产研究, 1997,18(2): 1-8.
[18]张永普, 应雪萍, 高素阳, 等. 北麂列岛岩相潮间带无脊椎动物的群落结构[J]. 东海海洋, 2001, 19(4):21-27.
[19]张景平, 黄小平, 江志坚, 等. 珠江口海域污染的水质综合污染指数和生物多样性指数评价[J]. 热带海洋学报, 2010, 29(1): 69-76.
[20]徐克学. 生物数学[M]. 北京: 科学出版社, 1999:250-290.
[21]陶世如, 姜丽芬, 吴纪华, 等. 长江口横沙岛、长兴岛潮间带大型底栖动物群落特征及其季节变化[J].生态学杂志, 2009, 28(7): 1345-1350.
[22]廖一波, 曾江宁, 陈全震, 等. 嵊泗海岛不同底质潮间带春秋季大型底栖动物的群落格局[J]. 动物学报,2007, 53(6): 1000-1010.
