辽东湾西部海域秋季大型底栖动物的群落结构特征
2012-10-13季相星曲方圆隋吉星王振钟于子山
季相星, 曲方圆, 隋吉星, 王振钟, 赵 宁, 于子山
(1. 中国海洋大学 海洋生命学院, 山东 青岛 266003; 2. 中国科学院 海洋研究所, 山东 青岛 266071)
大型底栖动物生活在海洋环境的“底栖区”, 是海洋生态系统的重要组成部分。由于大型底栖动物生活相对稳定(固定底内或短距离活动), 对海洋环境污染反应敏感, 因此其污染效应具有指示性、综合性和持续性。在污染监测研究领域, 大型底栖动物一直是研究的焦点[1-3]。近年来, 国内学者已对渤海及辽东湾北部海域大型底栖动物生态学展开了较系统的研究[4-10], 但对辽东湾西部海域的研究却尚未见报道。本文以2009年10月生态调查结果分析大型底栖动物的生物多样性及群落结构特征, 以期为该海域生态系统的深入研究提供参考。
1 材料与方法
1.1 研究的航次及站位设置
于2009年10月, 对辽东湾西部海域进行了14个站位的大型底栖动物样品采集, 站位如图1所示。六股河由1002站与1004站之间入海。
1.2 样品的采集、处理及分析
使用 0.05 m2的曙光型(HNM)采泥器进行采样,0.5 mm孔径的网筛分选沉积物样品, 分选后留在网筛上的标本及残渣, 现场全部收集装瓶, 用等体积10%福尔马林溶液固定。样品的处理、保存、计数和称量(民桥FA1004N, 感量为万分之一克)等均按《海洋调查规范》[11]进行。

图1 辽东湾西部海域大型底栖动物调查站位图Fig. 1 Sampling stations in the western waters of Liaodong Bay
1.3 数据处理
1.3.1 优势种的确定
采用相对重要性指数IRI(Index of Relative Im-portance)[12]进行优势种的确定。该指数的计算是将每种生物的个体重量、丰度及出现频率均考虑在内, 能够较为全面地反映出每种生物在整个群落中的地位。计算公式如下:
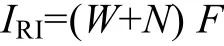
式中,W为每种的生物量占总生物量的百分比,N为每种的丰度占总丰度的百分比,F为该种出现的频率。
1.3.2 多样性指数的计算
采用 Margalef丰富度指数(d)、Shannon-Wiener多样性指数(H′)以及 Pielou’s 均匀度指数(J′)进行多样性分析。
公式如下:

式中,Pi为第i种的个体数与总个体数的比值,N为总个体数,S为总种数。
1.3.3 群落结构的分析
利用PRIMER5.0软件进行群落结构的分析。去除在总体中丰度小于1%的种, 但保留其中在任一站位相对丰度大于 3%的种, 以减少机会种的干扰, 构建Bray-Curtis相似性矩阵, 进行聚类(Cluster)分析[13]。
2 结果
2.1 大型底栖动物种类组成
本次调查共发现大型底栖动物99种, 其中多毛类44种, 占总种数的44.44%; 软体动物13种, 占总种数的13.13%; 甲壳动物39种, 占总种数的39.39%;其他类群3种, 占总种数的3.03%。
在调查发现的99种大型底栖动物中, 有21种的出现频率大于40 %。包括: 多毛类14种, 分别为拟特须虫(Paralacydonia paradoxa, 出现频率71.43%)、深钩毛虫(Sigambra bassi, 71.43%)、指节扇毛虫(Ampharete anobothrusiformis, 71.43%)、独指虫(Aricidea fragili, 64.29%)、微齿吻沙蚕(Micronephtyssp., 64.29%)、不倒翁虫(Sternaspis scutata, 57.14%)、日本刺梳鳞虫(Leanira japonica, 57.14%)、双唇索沙蚕(Lumbrinreis cruzensis, 57.14%)、缨鳃虫(Sabelliidae, 57.14%)、寡鳃齿吻沙蚕(Nephthys oligobranchia, 50%)、背蚓虫(Notomastus latericeus,42.86%)、日本双边帽虫(Amphictene japonica,42.86%)、长吻沙蚕(Glycera chirori, 42.86%)和稚齿虫(Prionospiosp., 42.86%); 甲壳动物 6种, 分别为异足类(Anisopoda, 92.86%)、滩拟猛钩虾(Harpiniopsis vadiculus, 85.71%)、背尾水虱(Anthuridea, 78.57%)、二齿半尖额涟虫(Hemileucon bidentatus, 71.43%)、太平洋方甲涟虫(Eudorella pacifica, 57.14%)和蜾蠃蜚(Corophiumsp., 42.86%);以及纽虫(Nemertinea, 64.29%)。
表1列出了IRI指数前10位的种。6种多毛类和4种甲壳动物, 组成了IRI指数的前10位, 说明这两大动物类群在调查海域的大型底栖动物群落中有着极其重要的作用。需要指出的是, 在301站发现了大量的日本双边帽虫(Amphictene japonica), 其丰度高达10 700 个/m2, 生物量为74.9 g/m2, 从而导致了它的IRI值高达3629。

表1 相对重要性指数排名前10位的种Tab. 1 The top 10 IRI species
2.2 大型底栖动物丰度与生物量
表2、表3分别示各站位丰度、生物量及各类群丰度、生物量的组成比例。调查海域内大型底栖动物的总平均丰度为 2387.1 个/m2, 取值范围: 150~11960 个/m2; 总平均生物量为 11.16 g/m2, 其范围为: 0.45~77.84 g/m2。其中, 多毛类的平均丰度为1 420.7 个/m2, 生物量为 8.67 g/m2; 软体动物的平均丰度为64.3 个/m2, 生物量为1.07 g/m2; 甲壳动物的平均丰度为873.6个/m2, 生物量为1.06 g/m2; 其他类群的平均丰度为28.6个/m2, 生物量为0.36 g/m2。由表2和表3可以看出, 301站无论是丰度还是生物量在各调查站位中都是最高的, 这是因为 301站出现了大量的日本双边帽虫(Amphictene japonica), 其丰度及生物量分别为10700 个/m2和74.9 g/m2; 1004站的丰度及生物量是各站位中最低的。调查海域内多毛类的平均丰度在各类群中最高, 其次为甲壳动物; 而多毛类的生物量在各类群中最高, 其他都较低, 这同样是由于 301站日本双边帽虫(Amphictene japonica)的高丰度高生物量所引起的。
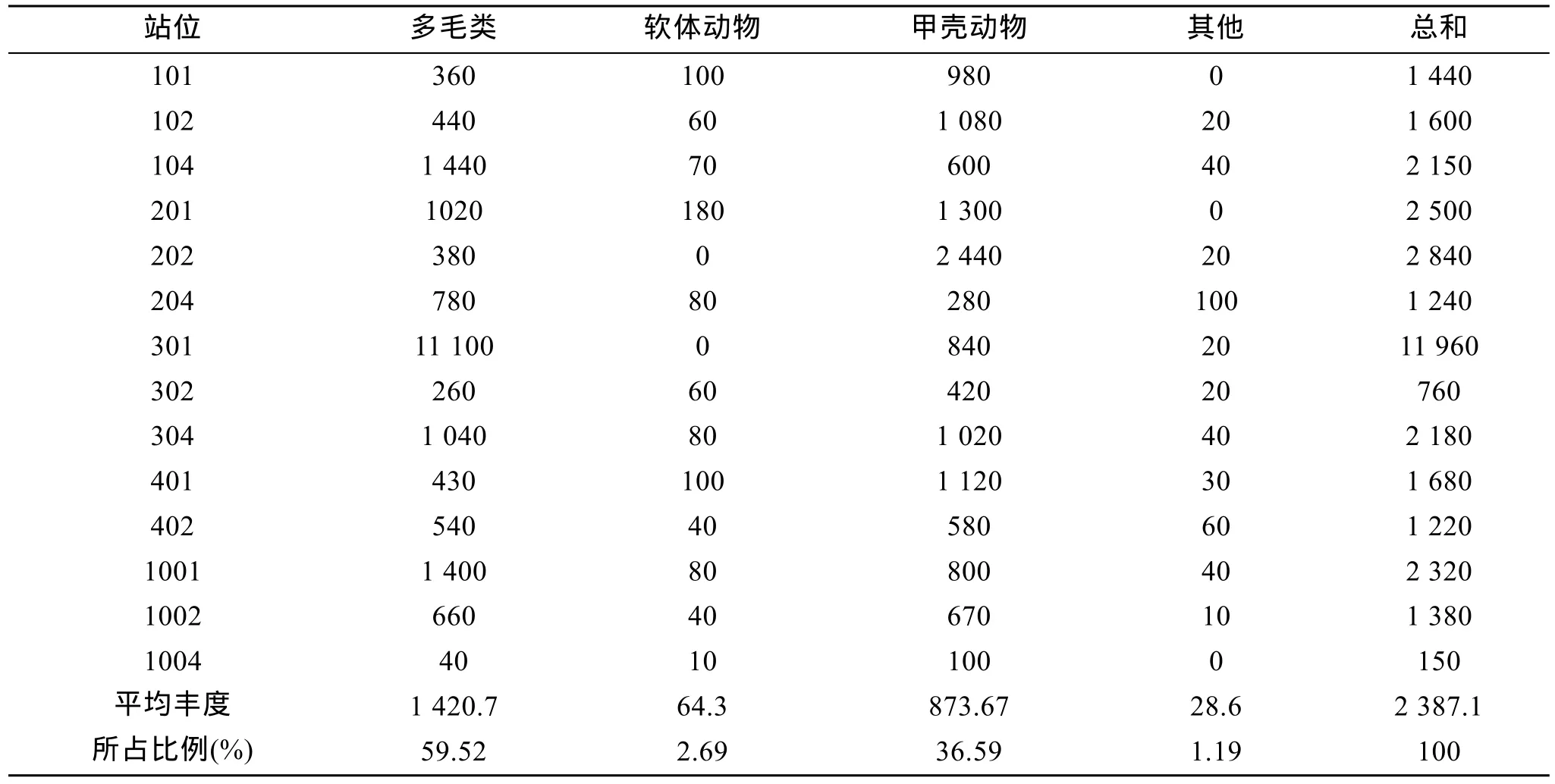
表2 调查海域大型底栖动物各主要类群的丰度(个/m2)Tab. 2 Abundance of the major macrobenthos taxa in the investigated waters(ind./ m2)
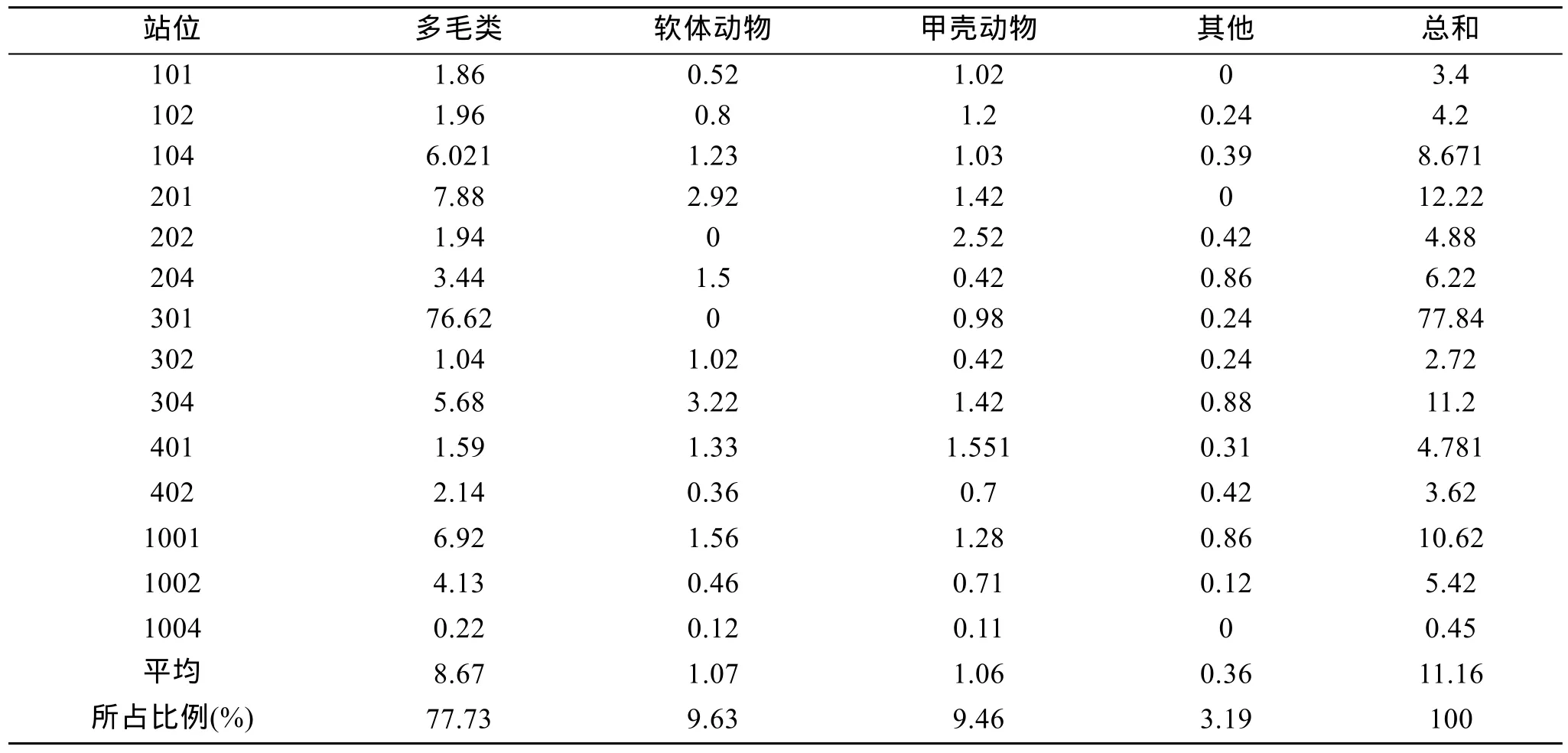
表3 调查海域大型底栖动物各主要类群的生物量(g /m2)Tab. 3 Biomass of the major macrobenthos taxa in the investigated waters(g /m2)
2.3 大型底栖动物丰度和生物量的空间分布
从大型底栖动物的丰度与生物量空间分布(图2)可以看出, 高丰度区及高生物量区均集中分布在北部沿岸区域, 其中以301站的丰度及生物量最高, 分别达到了11 960个/m2和77.84 g/m2, 其主要原因是该站出现了大量的日本双边帽虫(Amphictene japonica), 其丰度及生物量分别达到了 10 700 个/m2和74.9 g/m2; 而低丰度区和低生物量区分布在南部远岸区域, 最低值均出现在 1004站, 其丰度及生物量分别为150 个/m2和0.45 g/m2。

图2 大型底栖动物丰度和生物量空间分布Fig. 2 Spatial distribution of the abundance and biomass of macrobenthosa. 丰度; b. 生物量a. abundance; b. biomass
由于大型底栖动物的分布受多个因素影响, 包括物理环境(如水体交换能力、沉积物类型、悬浮物浓度、水深)[14-16]和物种间的相互关系等, 因此其分布具有较大的空间变异性[10]。在 301号站位分布着大量的日本双边帽虫(Amphictene japonica), 同时还有其他多毛类(8种)、甲壳类(9种)及纽虫(Nemertinea)共18种大型底栖动物; 而在1004号站位仅采集到2种多毛类、1种软体动物及4种甲壳动物共7种生物。造成这种情况的原因可能是: 1004号站位位于六股河口附近, 海水盐度较低, 使其大型底栖动物的数量及群落组成受到了限制; 而北部沿岸站位远离河口, 物理化学环境较稳定, 大型底栖动物能够较好的生存。
2.4 大型底栖动物多样性
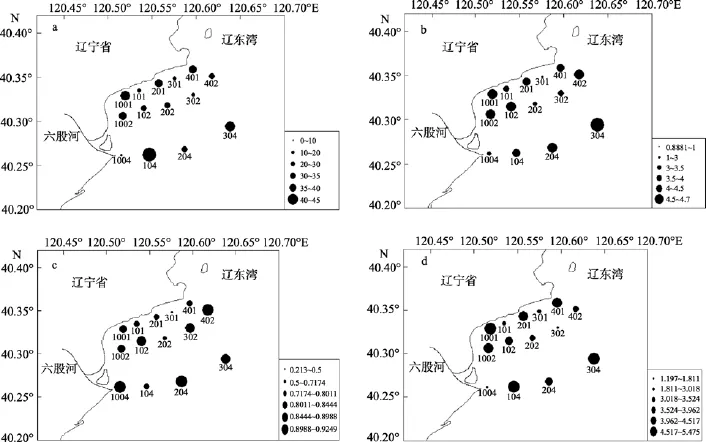
图3 辽东湾西部海域大型底栖动物多样性指数分布图Fig. 3 Spatial distribution of the diversity index of macrobenthos in the western waters of Liaodong Bay a. 种数; b. 多样性指数; c. 均匀度指数; d. 丰富度指数a. S; b. H′ ; c. J′; d. d
图3a示调查海域内各站种数的空间分布图。在调查站位中, 每站平均26种(表3), 种数最多的站位是104站, 共发现43种, 其中包括多毛类23种、软体动物5种、甲壳动物14种及1种棘皮动物, 其次为304站的37种和1001站的36种; 种数最少的站位为1004站, 仅发现7种。整体而言, 辽东湾西部海域近岸和远离海岸的区域为种数的高值区, 近岸和远海之间为种数的低值区。这与辽东湾北部海域[4-5]和胶州湾[17-18]大型底栖动物分布规律相类似,即河口区域生态环境多变, 大型底栖动物群落结构相对脆弱; 河口区域外生态环境相对稳定, 大型底栖动物群落处于较健康的状态。
图3b示各站Shannon-Wiener多样性指数的空间分布图。平均值为 3.556, 最高值出现在 304站, 为4.626, 最低值出现在301站, 为0.8881。有11个站位大于3(其中有6个站位大于4), 3个站位(202、301和1004)为2~3, 301最低仅为0.8881。整体而言, 多样性指数H′呈现出由近岸向外围, 逐渐升高的趋势。由此本文认为, 该调查海域底栖生态环境良好[19]。
图3c示各站均匀度指数的空间分布图。平均均匀度指数为 0.7714, 最高值出现在 204站, 为0.9248, 最低值出现在301站, 为0.213。整体而言,均匀度指数呈现由近岸向远离海岸区域逐渐增加的趋势。
图3d示各站丰富度指数的空间分布图。平均丰富度指数为3.426, 最高值位于104站, 为5.474, 最低值位于1004站, 为1.197。丰富度指数的分布趋势与种数的分布相似。
调查海域大型底栖动物多样性指数调查结果见表 4。

表4 调查海域大型底栖动物多样性指数Tab. 4 Diversity index of macrobenthos in the investigated waters
2.5 大型底栖动物群落划分
对调查海域大型底栖动物丰度进行聚类(Cluster)分析, 结果见图4。如图4所示, 在40%的相似度上,可将14个站划分为5个站组, 1004站和301站分别单独划为站组Ⅰ和站组Ⅲ, 401及 104划为站组Ⅱ,101、1001及 1002划为站组Ⅴ, 其余各站划为站组Ⅳ。站组Ⅰ仅包括1004站一站, 共发现7种大型底栖动物, 其中包括多毛类2种、软体动物1种及甲壳动物4种; 站组Ⅲ仅包括301站一站, 共发现大型底栖动物18种, 其中包括纽形动物1种, 多毛类8种及甲壳动物9种, 日本双边帽虫(Amphictene japonica)占绝对优势, 其丰度和生物量分别高达 10700个/m2和 74.9 g/m2。

图4 调查海域大型底栖动物丰度的聚类图Fig. 4 Cluster of macrobenthos abundance in the investigated waters
对其他站组进一步进行 SIMPER分析, 表征各站组的特征种, 结果表明: 站组Ⅱ包括2个站, 以独指虫(Aricidea fragilis)、异足类(Anisopoda)、内海拟钩虾(Gammaropsis utinomii)为特征种, 这些站的平均群落相似性为 27.41%; 站组Ⅳ包括 7个站, 以二齿半尖额涟虫(Hemileucon bidentatus)、拟特须虫(Paralacydonia paradoxa)、深钩毛虫(Sigambra bassi)及异足类(Anisopoda)为特征种, 这些站的平均群落相似性为 37.47%; 站组Ⅴ包括 3个站, 以二齿半尖额涟虫(Hemileucon bidentatus)、滩拟猛钩虾(Harpiniopsis vadiculus)及日本刺梳鳞虫(Leanira japonica)为特征种,这些站的平均群落相似性为35.20%。
3 讨论
为了了解辽东湾西部海域的底栖生态状况, 本文把此次的调查结果同周边海域的历史调查资料进行了比较, 见表 5。据现有文献, 目前在各个海区进行的大型底栖动物研究较为零散, 且出于研究目的不同, 研究者在野外调查中的站位设置疏密不一,采样范围各不相同, 由此造成了数据间的可比性较差。本文选取了几个站位设置相对集中的研究, 初步探讨大型底栖动物在渤海不同海区的分布趋势。由表 4可以看出, 本次调查的总平均丰度与渤海中南部的调查结果相近, 而与其他 3次调查的结果相差很远, 且本次调查的总平均生物量却是这几次调查中所最低的。造成这种现象的原因可能有: (1)本次调查在 301站发现了大量的日本双边帽虫(Amphictene japonica), 其对整个调查海域平均丰度的贡献率为32%, 而其他调查并未有如此高丰度的物种发现。(2)取样方式的不同也是造成此种现象的一个原因。取样方式的不同主要表现在采泥器类型和所用网筛孔径上; 辽东湾北部和渤海湾近岸调查均是采用1mm孔径的网筛, 较本次调查的 0.5mm孔径大一倍,这也是导致总平均丰度差异的一个原因。(3)采样季节的不同对调查结果也有影响。不同季节由于水温等环境因素的不同大型底栖动物的丰度也会有所不同。

表5 本次调查结果与周边海域的对比Tab. 5 Comparison of the result of this investigation with the data from the sea around
[1]田胜艳, 张文亮, 张锐.大型底栖动物在海洋生态系统中的作用[J].盐业与化工, 2009, (2): 50-54.
[2]刘录三, 李新正.东海春秋季大型底栖动物分布现状[J].生物多样性, 2002, 10(4): 351-358.
[3]Somerfield P J, Cochrane S J, Dable S, et al.Free-living nematodes and macrobenthos in a high-latitude glacial fjord [J].Journal of Experimental Marine Biology and Ecology, 2006, 330: 284-296.
[4]刘录三, 孟伟, 郑丙辉, 等.辽东湾北部海域大型底栖动物研究: Ⅰ.种类组成与数量分布[J].环境科学研究, 2008, 6: 118-123.
[5]刘录三, 孟伟, 李新正, 等. 辽东湾北部海域大型底栖动物研究: Ⅱ. 生物多样性与群落结构[J]. 环境科学研究, 2009, 2: 155-161.
[6]韩洁, 张志南, 于子山. 渤海中、南部大型底栖动物的群落结构[J]. 生态学报, 2004, 3: 531-537.
[7]韩洁, 张志南, 于子山. 渤海中、南部大型底栖动物物种多样性的研究[J]. 生物多样性, 2003, 1: 20-27.
[8]韩洁, 张志南, 于子山.渤海大型底栖动物丰度和生物量的研究[J].青岛海洋大学学报, 2001, 31(6):889-896.
[9]房恩军, 李军, 马维林, 等. 渤海湾近岸海域大型底栖动物初步研究[J]. 现代渔业信息, 2006, 10: 11-15.
[10]王瑜, 刘录三, 刘存歧, 等.渤海湾近岸海域春季大型底栖动物群落结构[J].环境科学研究, 2010, 4:430-436.
[11]国家质量监督局.海洋调查规范: 海洋生物调查[S].中华人民共和国国家标准.北京: 中国标准出版社, 2007: 41-44.
[12]Pinkas L, Oliphant M S,Iverson I L K. Food habits of albacore, bluefin tuna, and bonito in California waters[J].California Department of Fish and Game Fish Bulletin, 1971, 152: 1-105.
[13]Clarke K R, Warwick R M. Change in Marine Communities: An Approach to Statistical Analysis and Interpretation[M]. Plymouth, UK: Natural Environment Research Council, 1994: 24-36.
[14]赵章元, 孔令辉. 渤海海域环境现状及保护对策[J].环境科学研究, 2000, 13(2): 23-27.
[15]于子山, 张志南, 韩洁. 渤海大型底栖动物次级生产力的初步研究[J]. 青岛海洋大学学报, 2001, 31(6):867-871.
[16]刘成, 王兆印, 何耘, 等. 环渤海湾诸河口潜在生态风险评价[J]. 环境科学研究, 2002, 15(5): 33-37.
[17]于海燕, 李新正, 李宝泉, 等. 胶州湾大型底栖动物生物多样性现状[J]. 生态学报, 2006, 2: 416-422.
[18]李新正, 于海燕, 王永强, 等. 胶州湾大型底栖动物的物种多样性现状[J]. 生物多样性, 2001, 1: 80-84.
[19]蔡立哲, 马丽, 高阳, 等. 海洋底栖动物多样性指数污染程度评价标准的分析[J]. 厦门大学学报(自然科学版), 2002, 41(5): 641-646.
