不同碳氮浓度对雨生红球藻生长及虾青素累积的影响
2012-10-13顾文辉潘光华朱大玲王广策
韦 韬, 顾文辉, 李 健, 张 波, 潘光华, 朱大玲, 王广策
(1.天津科技大学 海洋科学与工程学院, 天津 300457; 2. 中国科学院 海洋研究所, 山东 青岛 266071; 3.中国科学院 研究生院, 北京 100049)
虾青素(Astaxanthin)又名虾黄质、龙虾壳色素,化学名称为 3,3’-二羟基-ß,ß’-胡萝卜素-4,4’-二酮, 是一种分布广泛的酮式类胡萝卜素[1]。由于具有良好的着色功能和超强的抗氧化能力[2], 虾青素已经被广泛应用于水产养殖[3]、医疗卫生[4]、化妆品和保健品等行业[5-7]。雨生红球藻(Haematococcus pluvialis)是一种淡水单细胞绿藻, 是目前已知的虾青素含量最高的生物物种[8-9], 最高含量达干质量的4%, 被认为是理想的天然虾青素生产者[10-11]。红球藻的生活史主要分游动细胞和不动细胞两个阶段: 环境适宜时,藻细胞快速生长, 为游动细胞; 当环境条件不利时,转入不动细胞阶段, 细胞内开始积累虾青素[11]。根据培养过程中雨生红球藻的形态和颜色变化, 可将藻细胞分为四类: 绿色游动细胞、绿色不动细胞、褐色不动细胞和红色不动细胞[12]。
近年来, 国内外研究者对雨生红球藻的培养条件及虾青素合成的诱导条件进行了分析研究, 但由于不同研究者采用的培养方法和藻种的差异, 导致他们的实验结果不尽相同[8,11,13]。在众多的影响因子中, 碳源作为细胞内有机分子碳骨架的提供者, 对雨生红球藻的生长及虾青素的合成起着至关重要的作用。Kaplan等[14]指出二氧化碳是雨生红球藻生长的最适碳源, 但过高浓度的二氧化碳又会造成培养液pH快速下降而不利于藻细胞生长。Kang等[15]的研究也显示, 以二氧化碳为碳源进行光合自养时更有利于雨生红球藻细胞中虾青素的积累。雨生红球藻是通过光合作用来固定二氧化碳, 然而, 目前关于二氧化碳浓度对雨生红球藻光合能力影响的研究鲜有报道。此外, 氮也是雨生红球藻生长过程中的必需元素, Harker[16]、Borowetzka 等[17]指出雨生红球藻的最适氮源为硝酸盐。虽然虾青素分子中不含氮, 但培养液中氮浓度的高低对细胞的生长有明显影响,进而会影响虾青素的总量。同时, 接种时藻细胞的状态对细胞内虾青素的累积也有一定的影响, 而相关研究的报道则很少。
本实验以二氧化碳为碳源, 研究了不同二氧化碳浓度对雨生红球藻生长及虾青素累积的影响, 同时, 对培养后红球藻的光合能力进行了比较; 其次,在碳源较充足的条件下, 通过改变培养液中硝酸钾浓度的浓度, 对培养体系中氮浓度的作用进行了系统的分析, 并对接种不同状态的藻细胞的影响进行了研究。
1 材料与方法
1.1 实验藻种
雨生红球藻(Haematococcus pluvialisFlotow N-212)由中国科学院海洋研究所提供, 本实验室保藏。
1.2 培养条件
按 MCM[17]的修正配方配制成基础培养基, 灭菌(121℃、20 min)后添加适量维生素, 培养基初始pH为7.2。在光照培养箱中进行细胞的培养, 培养温度为22℃±1℃, 光暗周期: 12 h/12 h, 光照强度为70 μmol/(m2·s)。每天摇瓶数次, 防止细胞贴壁, 保种的藻细胞每7天转接1次, 使其始终处于旺盛的对数生长时期。
1.3 实验装置
实验装置设计如图 1所示。通过气泵泵入灭菌的 CO2气体, 其中高浓度 CO2(600 ×10-6)为除菌后的室内空气, 低浓度CO2(60×10-6)是空气经由饱和氢氧化钠溶液吸收处理后而得, CO2浓度通过CO2分析仪(Telaire 7001, USA)实时监测, 并通过及时更换氢氧化钠溶液进行控制, 以维持在 60×10-6左右,气体流速为 30 L/(L·min)。

图1 实验装置设计图Fig. 1 Schematic diagram of experiment device
1.4 实验设计
1.4.1 气相二氧化碳浓度实验
实验中设两个 CO2处理组, 分别为 600×10-6和60×10-6, 各处理组设 3个平行, 将处于对数生长期的雨生红球藻细胞以3 500g离心5 min(22℃), 弃上清液后, 将收集的细胞用新鲜 MCM 培养基重新悬浮, 并接种于 5 000 mL三角瓶中, 接种后体积为3 000 mL。
1.4.2 硝酸钾浓度实验
绿色游动藻种: 连续通入较高浓度(600×10-6)的CO2气体, 设置不同硝酸钾浓度, 分别为: 0、1、10、100、200和300 mg/L, 每组设3个平行。接种前, 将处于对数生长期的雨生红球藻藻液以3 500g离心 5 min(22℃), 弃上清液后, 将剩下的藻细胞用缺氮(不含硝酸钾)的 MCM 培养液充分悬浮, 再以3 500g离心5 min(22℃), 然后将收集的细胞用含有不同硝酸钾浓度的培养基重新悬浮, 最后接种于500 mL 三角瓶中, 接种后体积为350 mL。
绿色不动藻种: 雨生红球藻细胞生长至稳定期后, 由于营养消耗等原因, 藻细胞逐渐失去鞭毛, 转为不动细胞。藻液经充分静置后, 去除悬浮液, 获得绿色不动细胞作为绿色不动藻种。硝酸钾浓度分别设置为0、10、100和300 mg/L, 培养条件及接种方法与绿色游动藻种实验一致。
1.5 实验参数测定
1.5.1 细胞密度
用血球计数板进行显微细胞计数。将培养物充分摇匀后取5 mL至试管, 用4%的戊二醛固定藻样后, 在双筒显微镜下计数。细胞数目多时, 稀释后计数。每个平行计数4次, 取平均值。
1.5.2 生长速率
根据普通生物学通用的计算公式[18]计算生长速率:

公式中:µ为相对生长速率;NT是时间T时的细胞密度;
N0是初始时的细胞密度;T为培养时间。
1.5.3 pH值
将培养液充分摇匀后取5 mL至试管, 用pH计测量。每个平行测量3次, 计算平均值。
1.5.4 光合参数
取70 mL藻液, 以3 500g离心5 min(22℃), 收集藻细胞, 利用Dual-PAM 100测得光合参数。
1.5.5 叶绿素含量
本实验利用丙酮法提取总叶绿素[19], 计算公式为:

公式中:C(a+b)表示单位体积内的总叶绿素浓度, 单位为mg/L;
C(cell)表示单个细胞中的总叶绿素含量, 单位为pg/个;
A645和A663分别为645 nm和663 nm处, 1 cm提取液的吸光值。
1.5.6 虾青素含量
参考Boussiba和Vonshak的方法[20]并加以改进,进行虾青素的提取和测定。计算公式如下:

公式中:C1表示单位体积内的虾青素浓度, 单位为g/L;
C2表示单个细胞中的虾青素含量, 单位为 pg/个;
消光系数A1%,1cm=2220;
A492为492 nm处1 cm液层混合物的吸光值。
1.5.7 数据分析
用SAS 9.1软件对数据进行统计分析。用统计学方法处理所得数据, 通过方差分析检测各实验组数据的显著性差异。
2 结果与分析
2.1 二氧化碳对雨生红球藻的影响
如图2a 所示, 不同CO2浓度对雨生红球藻生长的影响差异明显: 当CO2浓度为600×10-6时, 细胞生长较快, 第20天时细胞密度达到42.67×104个/mL,前20 d的生长速率为0.11 d-1; 当CO2浓度为60 ×10-6时, 雨生红球藻的最大细胞密度和相应的生长速率分别为 20.67×104个/mL 和 0.07 d-1, 均显著低于利用高浓度CO2(600 ×10-6)培养后的值(P<0.05)。
光合作用参数:Y(II)表示任一光照状态下 PSⅡ的实际量子产量, 即实际光合能力;Fv/Fm表示暗适应后 PSⅡ的最大光化学效率, 反映藻细胞潜在的光化学能力, 常作为光抑制的指标。30 d后, 高浓度CO2培养后的雨生红球藻的Y(II)值为0.48,Fv/Fm为0.64(图 2b), 低浓度 CO2培养后的Y(II)和Fv/Fm值分别为0.36和0.60, 二者之间差异明显(P<0.05)。
红球藻经高浓度CO2和低浓度CO2培养30 d后,在单位体积内所获得的叶绿素浓度分别为(5.15±0.21)mg/L 和(4.86±0.48)mg/L, 无显著性差异(P>0.05); 单个细胞内高CO2组和低CO2组的叶绿素含量分别为(12.03±0.18)pg/个和(27.77±1.45)pg/个(P<0.05)。
利用高浓度CO2培养雨生红球藻30 d后, 获得的虾青素含量无论是单位体积内还是单个细胞中均高于低浓度 CO2培养组, 最大值分别为(1.85±0.11)mg/L 和(5.50±0.31)pg/个(图 2d)。
2.2 硝酸钾对雨生红球藻的影响
绿色游动藻种:
在连续充气(600×10-6CO2浓度)的条件下, 雨生红球藻的生长随着 KNO3浓度的变化而变化(图3a)。当 KNO3浓度为 100、200和 300 mg/L时, 雨生红球藻生长较好, 所获得的最大细胞密度分别为 36.92×104、35.83×104和 40.17×104个/mL; 当培养液中初始 KNO3浓度逐渐降低后, 所得到的最大细胞密度也逐渐下降; 缺氮时, 细胞密度基本没有增加。
当培养基中KNO3浓度较低时(0、1和10 mg/L),藻液的pH值在整个培养过程中保持稳定, 保持在7左右; 当 KNO3浓度升高后, 藻液 pH 也随之升高,当 KNO3浓度为 300 mg/L时, 第 8天时, 其值达到9.22(图 3b)。

图2 不同二氧化碳浓度对雨生红球藻生长及虾青素累积的影响Fig. 2 Effects of different CO2 concentrations on the growth and astaxanthin accumulation of H.pluvialis
雨生红球藻绿色游动细胞培养12 d后, 无论是单个细胞还是单位体积内, 总叶绿素含量均随着KNO3浓度的升高而升高(图3c)。当KNO3浓度为300 mg/L时达到最大值, 分别为 38.13 pg/个和 15.67 mg/L 。
如图3d所示, 雨生红球藻在缺N的条件下也能积累一定量的虾青素(6.69 pg/个); 当培养液中有 N时, 单个细胞内的虾青素含量随着 KNO3浓度的升高而降低, 并且在KNO3浓度为1 mg/L时获得最大值(10.93 pg/个); 单位体积培养液内的虾青素含量在KNO3浓度为100 mg/L时最大, 为2.86 mg/L。
绿色不动藻种:
当绿色不动细胞接种到新鲜培养基后, 无论KNO3浓度的高低, 藻密度在前两天里只有较小的增长。两天后, 当KNO3浓度相对充足时(100 mg/L和 300 mg/L), 藻细胞进入对数生长期, 生物量迅速增加, 获得的最大细胞密度分别为 35.92×104个/mL和 39.33×104个/mL。与用游动细胞接种后相似, 在缺氮或KNO3浓度较低时, 细胞生长较慢(如图 4a)。
雨生红球藻不动细胞接种到缺氮或低 KNO3浓度的培养基后, 藻液 pH值始终保持较低水平。当KNO3浓度为100 mg/L和300 mg/L时, 最大pH值分别为8.04和8.87。
如图4c, 不动细胞接种培养12 d后, 红球藻中总叶绿素含量与培养基中的初始 KNO3浓度成正相关, 随着KNO3浓度的升高而升高, 单个细胞和单位体积内的最大值分别为22.77 pg/个和8.96 mg/L。
当 KNO3浓度为 10 mg/L时, 不动细胞接种 12天后, 单个红球藻细胞内虾青素含量最大, 为 12.64 pg/个; 当KNO3浓度为300 mg/L时, 单位体积内的虾青素含量最大, 为2.94 mg/L(图4d)。

图3 不同硝酸钾浓度对雨生红球藻绿色游动细胞生长及虾青素累积的影响Fig. 3 Effects of different KNO3 concentrations on the growth and astaxanthin accumulation of H.pluvialis green vegetative cells
通过以上结果可以看出, 培养液中初始的KNO3浓度和接种细胞的类型对雨生红球藻的生长及虾青素的累积有很大的影响。当碳源和氮源相对充足时,红球藻生长良好, 但较高的 KNO3浓度不利于藻细胞内虾青素的积累; 当培养基中缺氮或氮源浓度较低时, 单个藻细胞内可以获得较高的虾青素含量,但此种状态下的红球藻生长缓慢, 细胞密度较低,导致单位体积培养液内的虾青素总量偏低。
3 讨论
作为光自养生物, 雨生红球藻只有吸收了充足的CO2, 才能满足光合作用的需求, 同时较高的CO2浓度有利于提高光合作用效率(图2b)。然而, 培养液中自然溶解的 CO2浓度比较低, 不能满足藻细胞迅速生长的要求, 需要不断地补充。补充碳源的方法有很多, 如充CO2、添加NaHCO3和NaAc等。陆开形等[21]指出适于红球藻生长的NaHCO3浓度为0.2 g/L,此时获得的最大细胞密度为14.0×104个/mL。庄惠如等[22]分别选用乙酸钠、葡萄糖、麦芽糖、乳糖等为碳源, 研究了红球藻混合营养及异养培养的条件,所得的最大细胞密度分别为 12.0×104个/mL和4.28×104个/mL。本实验中充气(CO2)条件下得到的最大藻细胞密度为 42.83×104个/mL, 远远高于上述研究者利用其他碳源培养时的值。
实验证明雨生红球藻的生长及虾青素的累积受培养液中氮源浓度的影响: 在充入较高浓度 CO2的条件下, 当培养基中缺氮时, 红球藻细胞内可积累一定量的虾青素, 分析认为藻细胞中的Rubisco可作为一个氮库, 为缺氮条件下细胞内虾青素的积累提供了一定的氮源; 当培养基中KNO3浓度较低时, 雨生红球藻生长缓慢, 单个细胞内的虾青素含量较高,但因为细胞密度较低而使得虾青素总量偏低; 当培养基中氮源浓度较高时, 虽然红球藻生长良好, 但却不利于细胞内虾青素的累积。因此, 在利用雨生红球藻进行虾青素大规模生产时, 可在氮源较充足的培养液中连续充入一定浓度的 CO2气体, 这不仅能为处于生长阶段的雨生红球藻提供充足的碳源, 而且随着培养时间的延长、培养液中氮的消耗, 可诱使藻细胞内虾青素的快速合成, 最终获得较高的虾青素产量。
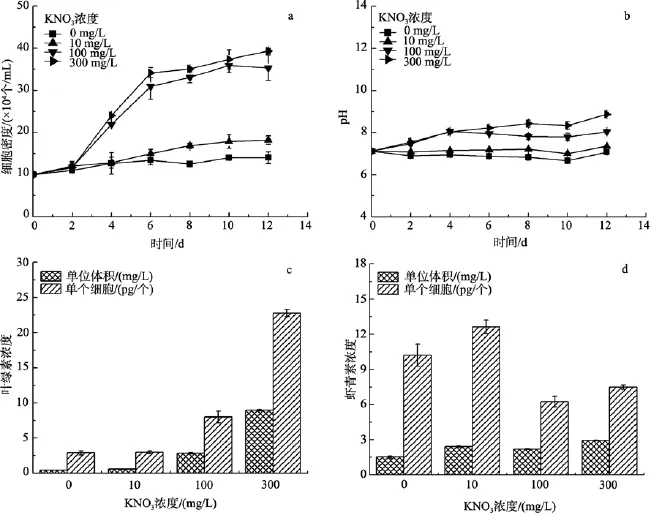
图4 不同硝酸钾浓度对雨生红球藻绿色不动细胞生长及虾青素累积的影响Fig. 4 Effects of different KNO3 concentrations on the growth and astaxanthin accumulation of H.pluvialis green rest cells
4 结论
本实验结果表明: 1)较高浓度的CO2气体有利于雨生红球藻光合作用的进行, 从而可促进藻细胞的快速生长; 2)在碳源较充足的条件下, 较低的氮浓度有利于诱导红球藻细胞内虾青素的累积, 且接种绿色不动藻种后能获得更高的细胞内虾青素含量。
[1]Lorenz R T, Cysewski G R. Commercial potential forHaematococcusmicroalgae as a natural source of astaxanthin [J]. Trends in Biotechnology, 2000, 18(4):160-167.
[2]Kamath B S, Srikanta B M, Dharmesh S M, et al. Ulcer preventive and antioxidative properties of astaxanthin fromHaematococcus pluvialis[J]. European Journal of Pharmacology, 2008, 590(1): 387-395.
[3]Nelis H, De Leenheer A. Microbial sources of carotenoid pigments used in foods and feeds [J].Journal of Applied Microbiology, 1991, 70(3): 181-191.
[4]Chew B P, Park J S. Carotenoid action on the immune response [J]. The Journal of Nutrition, 2004, 134(1):257S-261S.
[5]魏东, 严小君. 天然虾青素的超级抗氧化活性及其应用[J]. 中国海洋药物, 2001, 20(4): 45-50.
[6]李浩明, 高蓝. 虾青素的结构功能与应用[J]. 精细化工, 2003, 20(1): 32-37.
[7]Guerin M, Huntley M E, Olaizola M.Haematococcusastaxanthin: applications for human health and nutrition[J]. Trends in Biotechnology, 2003, 21(5): 210-216.
[8]Tripathi U, Sarada R, Rao S R, et al. Production of astaxanthin inHaematococcus pluvialiscultured in various media [J]. Bioresource Technology,1999, 68(2):197-199.
[9]Sandesh K B, Vidhyavathi R, Sarada R, et al.Enhancement of carotenoids by mutation and stress induced carotenogenic genes inHaematococcus pluvialismutants [J]. Bioresource Technology, 2008,99(18): 8667-8673.
[10]Li J, Zhu D L, Niu J F, et al. An economic assessment of astaxanthin production by large scale cultivation ofHaematococcus pluvialis[J]. Biotechnology Advances,doi:10.1016/j.biotechadv. 2011. 04.001.
[11]Zhang B Y, Geng Y H, Li Z K, et al. Production of astaxanthin fromHaematococcusin open pond by two-stage growth one-step process [J]. Aquaculture,2009, 295(3): 275-281.
[12]陈张帆. 雨生红球藻Rubisco在虾青素积累过程中的表达分析[D]. 青岛:中国科学院海洋研究所, 2008.
[13]Orosa M, Franqueira D, Cid A, et al. Analysis and enhancement of astaxanthin accumulation inHaematococcus pluvialis[J]. Bioresource Technology,2005, 96(3): 373-378.
[14]Kaplan A, Reinhold L. CO2concentrating mechanisms in photosynthetic microorganisms [J]. Annual Review of Plant Biology,1999, 50: 539-570.
[15]Kang C, Lee J, Park T, et al. Comparison of heterotrophic and photoautotrophic induction on astaxanthin production byHaematococcus pluvialis[J].Applied Microbiology and Biotechnology, 2005, 68(2):237-241.
[16]Harker M. Use of response-surface methodology to optimize carotenogenesis in the microalgaHaematococcus pluvialis[J]. Journal of Applied Phycology,1995, 7(4): 399-406.
[17]Borowitzka M A, Huisman J M, Osborn A. Culture of the astaxanthin-producing green algaHaematococcus pluvialis. Effects of nutrients on growth and cell type[J]. Journal of Applied Phycology, 1991, 3(4):295-304.
[18]Dauta A, Devaux J, Piquemal F, et al. Growth rate of four freshwater algae in relation to light and temperature [J]. Hydrobiologia, 1990, 207(1): 221-226.
[19]Kobayashi M, Kakizono T, Nagai S. Astaxanthin production by a green alga,Haematococcus pluvialisaccompanied with morphological changes in acetate media [J]. Journal of Fermentation and Bioengineering,1991, 71(5): 335-339.
[20]Boussiba S, Vonshak A. Astaxanthin accumulation in the green algaHaematococcus pluvialis[J]. Plant and cell Physiology, 1991, 32(7): 1077.
[21]陆开形, 蒋霞敏, 翟兴文. 不同条件下雨生红球藻生长的研究[J]. 水利渔业, 2003, 23(1): 17-19.
[22]庄惠如, 陈必链, 王明兹, 等. 雨生红球藻混合营养与异养培养研究[J]. 微生物学报, 2000, 27(3): 198-201.
