响应面法优化酶法制备藻蓝蛋白抗氧化肽的实验研究
2012-10-13唐志红焦绪栋周云丽吕家森
唐志红, 焦绪栋, 周云丽, 周 虹, 吕家森, 秦 松
(1. 烟台大学 生命科学学院, 山东 烟台 264005; 2. 中国科学院 烟台海岸带研究所, 山东 烟台 264003)
藻蓝蛋白是存在于蓝藻、红藻、隐藻中的一类光合辅助色素, 由开链四吡咯化合物和脱辅蛋白通过硫链键结合, 是螺旋藻细胞中起重要光合作用的天然色素, 在螺旋藻中的含量高达 10%~20%[1]。大量研究表明, 藻蓝蛋白具有抗氧化[2]、抗辐射[3]、提高机体免疫力[4]、促进动物细胞再生[5]、抑制癌细胞[6]等作用, 这就决定了螺旋藻及其活性成分在功能性食品、药物研究与开发方面有着广阔的应用前景。我国对藻蓝蛋白的研究始于20世纪70年代, 经过30多年的研究开发, 虽然有较大进展, 但大都处于实验室水平。同时, 以藻蓝蛋白为主的功能性食品不多,在药品的研究开发方面还是空白[7]。采用酶解的方法将藻蓝蛋白降解为可溶性寡肽, 则可大大提高其在食品中的理化性能, 并有可能获得其前体没有的生理活性。因此, 将藻蓝蛋白进行酶解处理具有较大的实用价值和应用前景。目前国内外有关对藻蓝蛋白进行酶解制备抗氧化肽的研究尚未见报道。本文以对超氧阴离子和羟基自由基的清除能力为评价指标,应用响应面分析方法对碱性蛋白酶制备藻蓝蛋白抗氧化肽的酶解工艺进行了研究, 为藻蓝蛋白的进一步开发利用提供研究基础。
1 材料与方法
1.1 材料和仪器
藻蓝蛋白(A620/A280>2), 由本实验室从螺旋藻((Spirulina platensis)中提纯得到; 碱性蛋白酶, 上海江莱生物科技有限公司; 其他均为分析纯试剂; pH仪, 上海任氏有限公司; HH-6恒温水浴锅, 江苏省金坛市荣华仪器制造有限公司; TDL-5型台式离心机,上海安亨科学仪器厂; 721型分光光度计, 上海菁华科技仪器有限公司。
1.2 实验方法
1.2.1 藻蓝蛋白碱性蛋白酶水解工艺
称取适量藻蓝蛋白溶于 20 mL去离子水中, 在一定温度下恒温水浴酶反应器中溶解 20 min, 然后按不同[E]/[S]、pH、温度酶解一定的时间, 到所需反应时间后将酶解液置于95℃中灭酶10 min, 冷却后离心(4 000 r/min, 15 min), 将上清液冻干备用。
1.2.2 响应面(RSM)因素的确定
在探讨酶作用温度、时间、pH、[E]/[S]和底物浓度等单因素对酶解作用影响的基础上, 确定了酶作用的适宜 pH为 8.5, 底物浓度为 5%, 根据Box-Behnken中心组合试验设计原理, 以X1(温度)、X2(时间)和X3([E]/[S])为自变量, 以超氧阴离子自由基清除率(Y)为响应值, 设计了三因素三水平的响应面分析试验。试验的因素和水平的取值见表l。
1.2.3 数据分析
对试验所得数据采用Design-Expert7.0进行响应面分析。通过将优化试验所得的试验数据与响应面模型进行拟合, 以验证模型的可靠性。

表1 Box-Behnken试验因素与水平Tab. 1 Factors and levels of Box-Behnken design
1.2.4 分析方法
藻蓝蛋白酶解产物清除超氧阴离子自由基清除能力测定, 采用邻苯三酚自氧化法[8]。分别称取适量藻蓝蛋白酶解产物溶解于1 mL的蒸馏水中, 取0.1 mL加入2.8 mL 0.1mol/L的Tris-HCl缓冲溶液pH 8.2), 空白对照管以双蒸馏水代替样品, 震荡混匀,在25℃水浴保温10 min后加入0.1 mL、3 mmol/L的邻苯三酚溶液(25℃水浴预热), 迅速混匀并开始计时, 每隔30 S在325 nm处测定吸光度值A325, 5 min后结束, 以0.1 mL双蒸水加2.8 mL 的Tris·HCL缓冲溶液调零。作吸光度随时间变化的回归方程, 其斜率为邻苯三酚自氧化速率V, 按下式计算样品对超氧阴离子的清除率:
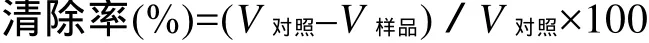
式中,V对照为对照组邻苯三酚自氧化速率, △A/min;V样品为样品组邻苯三酚自氧化速率, △A/min。
还原能力的测定, 铁氰化钾法[9]。
清除羟基自由基能力测定, 采用Fenton反应[10]。
2 结果与分析
2.1 酶解工艺参数的优化
本实验采用Box-Benhnken组合设计对影响藻蓝蛋白酶解的三个因素X1(温度)、X2(时间)和X3([E]/[S])进行了15组试验, 来寻找上述3因素的最佳条件。试验设计及结果见表2。
2.1.1 回归方程的建立
以超氧阴离子自由基清除率(Y)为响应值指标,通过design expert7.0数据处理软件对表3的试验结果进行分析, 得到X1(温度)、X2(时间)和X3([E]/[S])3个因素与Y之间的回归方程(模型)为:

对回归模型进行方差分析, 结果见表 3。该模型的Pr>F值为 0.0096, 说明模型回归高度显著; 失拟项Prob>F=0.0668>0.1, 失拟不显著, 说明回归方程的拟合程度较好; CV为10.16%, 较低, 说明试验操作可信, 综上可以确定回归方程(1)为碱性蛋白酶制备藻蓝蛋白抗氧化肽提供了一个理想的模型, 故可用该回归模型代替试验真实点对试验结果进行分析。从3因素(X1、X2、X3)对酶解产物的水解度的影响来看, 方程中X12和X32项对Y值的影响高度显著,X1、X3和X1X2项对Y值的影响显著, 其他项对Y值的影响不显著, 分析结果表明响应值的变化非常复杂,三个试验因素对响应值的影响不是简单的线性关系,二次项和交互项对响应值有很大的影响。

表2 Box-Behnken试验设计及结果Tab. 2 Design and result of Box-Behnken test
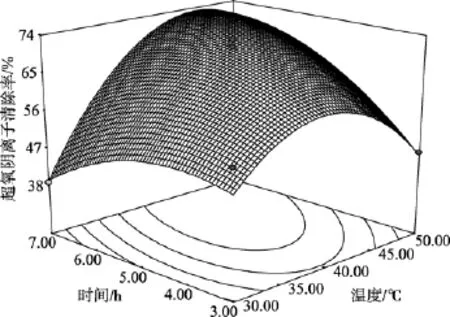
图1 酶解温度和时间对超氧阴离子自由基清除率的影响Fig. 1 Response surface plots for the effects of hydrolysis temperature and time on the scavenging rate of superoxide anion radicals
根据模型方程(1)绘制响应曲面见图1、图2和图3。从响应面的最高点和等高线可以看出在所选的范围内存在极值, 响应面的最高点同时也是等值线中最小椭圆的中心点。通过岭嵴分析得到水解度(Y)最高时的酶解优化组合为X1=0.468、X2=6937和X3=0.307, 即温度为44.9℃、时间为6.4 h和[E]/ [S]为 3.6%, 此时对超氧阴离子自由基清除率达到75.15%。

表3 回归方程方差分析Tab. 3 Analysis of variance for regression equation
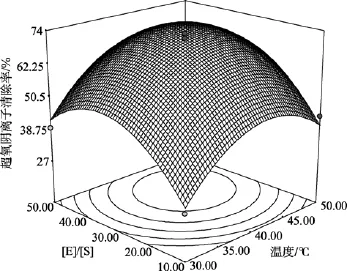
图2 酶解温度和[E]/ [S]对超氧阴离子自由基清除率的影响Fig. 2 Response surface plots for the effects of hydrolysis temperature and [E]/ [S]on the scavenging rate of superoxide anion radicals
2.1.2 验证实验
为了验证回归模型预测的准确性, 采用上述优化后的酶解工艺条件, 即温度44.9℃、时间6.4 h、[E]/ [S]为3.6%、[S]5.0%、pH 8.5进行验证试验, 3次试验的超氧阴离子自由基清除率平均为 75.39%,与理论预测值的相对误差在土1%以内, 说明响应面法优化得到的数学模型与试验数据拟合较好, 能较好反映酶解过程中超氧阴离子自由基清除率。

图3 酶解时间和[E]/[S]对超氧阴离子自由基清除率的影响Fig. 3 Response surface plots for the effects of hydrolysis time and [E]/ [S]on the scavenging rate of superoxide anion radicals
2.2 藻蓝蛋白酶解产物的还原能力
研究表明, 抗氧化剂的还原力与其抗氧化性之间存在联系。抗氧化剂是通过自身的还原作用给出电子而清除自由基的, 还原力越强, 抗氧化性越强。因此可通过测定还原力来说明抗氧化活性的强弱[11]。藻蓝蛋白酶解产物(在优化后的酶解工艺条件下获得)的还原能力见图4。在浓度为0.1~0.5 g/L时, 藻蓝蛋白酶解产物的还原能力随浓度的增大而提高, 当浓度为 0.5 g/L时吸光度达 1.03, 还原能力略高于VC。

图4 藻蓝蛋白酶解产物的还原能力Fig. 4 The reducing power of antioxidant peptides from phycocyanin
3 结论
根据 Box-Behnken设计原理采用三因素水平的响应面分析法, 对影响藻蓝蛋白抗氧化肽制备的三个主要因素: 温度、时间、[E]/[S]进行了优化, 选取合适的取值范围, 并对各因素的最佳水平进行了研究, 建立了温度、时间、[E]/[S]与超氧阴离子自由基清除率之间的数学模型, 模型的回归效果显著, 能很好地预测超氧阴离子自由基清除率。优化后的酶解工艺条件, 即温度 44.9℃、时间 6.4 h、[E]/[S]3.64%、[S]5.0%、pH 8.5, 在此条件下, 实际超氧阴离子自由基清除率为75.39%, 与模型理论值75.15的相对误差在土1%以内, 说明响应面法优化得到的数学模型与试验数据拟合较好, 能较好反映酶解过程中超氧阴离子自由基清除率。在优化条件下制备的藻蓝蛋白酶解产物在0.5 g/L时吸光度达1.03, 还原能力略高于 VC, 说明藻蓝蛋白酶解产物具有显著的还原能力。本研究对于藻蓝蛋白的进一步开发利用具有重要的意义。
[1]郝玮, 潘凌. 螺旋藻藻蓝蛋白生理活性的研究进展[J]. 医学综述, 2006, 12(2): 111-113.
[2]Patel A, Mishra S, Ghosh P K. Antioxidant Potential of C-Phyeoeyanin isolated from cyanobaeterial species Lynghya, Phormidium andSpirulinaspp.[J].Indian J Bochem Bophys, 2006, 43(1): 25-31.
[3]Gonzalez R, Rodriguez S, Romay C H,et al.Anti-inflammatory activityof phycocyanin extract in acetic acid-induced colitis in rats[J]. Pharmacol Res,1999, 39(1): 1055-1059.
[4]唐玫, 金鹰, 郭宝江, 等. 螺旋藻藻蓝蛋白对小鼠免疫功能的影响[J]. 暨南大学学报, 1998, 19(5): 93-97.
[5]张成武, 曾昭琪, 张媛贞, 等. 藻蓝蛋白对小鼠粒单系祖细胞生成的影响[J]. 中国海洋药物, 1996, 60(4):25-28.
[6]关燕清, 郭宝江. 硒化藻蓝蛋白生物材料抗肝癌作用的研究[J]. 华南师范大学学报, 2001, 3(1): 40-44.
[7]陈志桃, 王立兴, 林维钦. 螺旋藻藻蓝蛋白的研究进展[J]. 海峡药学, 2003, 15(6): 1-5.
[8]李艳红, 刘坚, 张涛, 等. 酶解鹰嘴豆蛋白制备抗氧化肽工艺优化研究[J]. 农业工程学报, 2008, 24(1):268-273.
[9]张强, 周正义, 王松华. 从米糠中制备抗氧化肽的研究[J], 食品工业科技, 2007, 28(7): 145-148.
[10]牟雪姣, 张强, 邢静, 等, 鸡血红蛋白抗氧化肽的制备工艺研究[J]. 农产品加工, 2009, 3: 54-57.
