喉鳞状细胞癌组织中Snail和E-cadherin的表达及其意义
2012-10-10滕思莹崔香艳
尚 静,房 宁,滕思莹,崔香艳,汪 欣
(吉林大学第一医院耳鼻咽喉-头颈外科,吉林 长春 130021)
肿瘤转移表现为细胞脱落、细胞迁移、降解细胞外基质、新生血管形成等级联反应,而上皮-间质转化(epithelial-mesenchymal transition,EMT)表现出的细胞学机制,即细胞黏附的丧失和迁移力的获得作为肿瘤转移级联反应的起始环节越来越受到学者们的重视。上皮钙黏蛋白(E-cadherin)是钙黏附素中的一个重要成员,其下调常标志着EMT的发生。E-cadherin介导同型细胞间的连接,维持正常上皮细胞的形态、细胞的极性以及组织结构的完整性[1]。当上皮细胞E-cadherin的表达下调,细胞间的黏附性下降,细胞就从原发部位脱落,若此过程发生在上皮性肿瘤中就可能成为肿瘤转移的第一步[2]。转录因子Snail通过与E-cadherin启动子区E-box盒结合来抑制E-cadherin的转录[3],降低E-cadherin蛋白水平,促进细胞从相邻细胞脱落并迁移。Snail高表达于乳腺癌[4]、胃癌[5]、结肠癌[6]、肝癌[7]、食管癌[8]等组织中,并与乳腺癌、胃癌、食管癌组织学分级、淋巴结转移及远处转移密切相关[4-5,8]。然而Snail在喉鳞状细胞癌(laryngeal squamous cell carcinoma,LSCC)组织中的表达国内未见报道,国外也少有研究。本研究旨在分析LSCC组织中Snail和E-cadherin的表达与淋巴结转移、组织分化的关系,探讨EMT与LSCC转移的关系。
1 资料与方法
1.1 标本来源收集吉林大学第一医院耳鼻咽喉-头颈外科2008年3月-2009年11月手术切除经病理证实为鳞状细胞癌的LSCC组织46例,相应手术切除范围外经病理证实为正常鳞状上皮的癌旁组织46例。所有患者术前未进行化疗和放疗。46例喉癌标本中男性32例,女性14例;年龄38~80岁,平均年龄58.62岁(年龄≤59岁25例,年龄>59岁21例);发病部位:声门上型30例,声门型16例;按国际抗癌协会(UICC)的TNM分类标准(2002)分别为T1-T224例,T3-T422例;临床分期Ⅰ-Ⅱ期12例,Ⅲ-Ⅳ期34例;有颈淋巴结转移26例,无颈淋巴结转移20例;按组织学分级:高分化13例,中分化20例,低分化13例。
1.2 主要试剂及步骤小鼠抗人E-cadherin单克隆抗体(MAB-0589)(即用型),超敏S-P免疫组化试剂盒(KZT9710),小鼠抗人Snail单克隆抗体(bs-1371R)。石蜡切片脱蜡、水化、修复后,滴加一抗(小鼠抗人Snail单克隆抗体稀释度为1∶100,小鼠抗人E-cadherin单克隆抗体稀释度为1∶200),4℃过夜,以PBS代替一抗作为阴性对照。滴加二抗,室温孵育10 min,滴加链酶亲和素-生物素-辣根过氧化物酶,DAB显色和苏木精复染色,脱水和透明后用中性树胶封片。
1.3 结果判断Snail及E-cadherin表达的免疫组化结果判定方法:每张切片在100倍视野找到表达密集区,200倍下计数3个视野、200个细胞。染色结果综合染色强度及阳性细胞数进行分析,染色强度积分分值(IRS)=SI×PP,SI表示染色强度,无染色为0分,弱染色为1,中等染色为2,强染色为3;PP是阳性细胞百分比,阳性率0记为0分,<10% 为1分,11%~50%为2分,51%~80%为3分,>80%为4分。按照积分分值分为:阴性(—),0~1分;弱阳性(+),2~3分;中度阳性(),4~6分;强阳性(),>6分。弱阳性、中度阳性及强阳性表达合称为阳性表达。
1.4 统计学分析应用SPSS 13.0统计软件进行统计分析,Snail和E-cadherin在LSCC、癌旁组织中表达阳性率比较,以及两者在LSCC中的表达与临床病理因素间的关系,均采用χ2检验;Snail和E-cadherin在LSCC中表达的相关性采用Spearman等级相关分析。
2 结 果
2.1 Snail在LSCC和癌旁组织中的表达Snail表达可见于细胞浆或细胞核,阳性细胞为棕黄色颗粒弥漫分布于细胞浆或棕褐色颗粒分布于细胞核内。在LSCC组织中,Snail表达多为阳性或强阳性,多数位于细胞核内(图1A~C,见插页四);在癌旁组织中,Snail表达主要为阴性和弱阳性,阳性多位于细胞浆区域,少数细胞核染成棕褐色(图1D,见插页四)。LSCC和癌旁组织中Snail表达的阳性率分别为69.57%(32/46)和36.96%(17/46)。Snail在LSCC与癌旁组织表达阳性率比较,差异有统计学意义(χ2=9.824 4,P<0.01)。
2.2 Snail的表达与LSCC临床病理特征的关系在不同年龄组、不同性别组、不同发病部位组、不同T分级组以及不同临床分期组Snail表达阳性率的差异均无统计学意义(P>0.05)。而在LSCC的不同组织分化程度组、有无颈淋巴结转移组比较,Snail表达阳性率的差异有统计学意义(P<0.05)。在不同组织分化组中,Snail的表达程度随组织分化程度的降低而逐渐增强,且其表达部位由以细胞质染色为主到以细胞核染色为主(图1A~C,见插页四),Snail在高分化、中分化、低分化组中的阳性率分别为46.15%、64.71%和93.75%,低分化组Snail表达阳性率与高分化组、中分化组比较差异有统计学意义(P<0.05),而高分化组与中分化组比较差异无统计学意义(P>0.05)。见表1。
2.3 E-cadherin在LSCC和癌旁组织中的表达E-cadherin表达的阳性细胞为棕黄色颗粒沿细胞膜弥漫分布或细胞质内见棕黄色颗粒。在LSCC组织中,E-cadherin表达多为阴性和弱阳性,阳性多位于细胞膜区域,少数细胞质染色,但棕黄色颗粒分布不均匀(图2A~C,见封三)。在癌旁组织中,E-cadherin表达多为阳性或强阳性,多数均匀分布于细胞膜,少数可见细胞质染色(图2D,见封三)。LSCC和癌旁组织中E-cadherin表达阳性率分别为47.83%(22/46)和78.26%(36/46),两者比较差异有统计学意义(χ2=9.144 0,P<0.01)。
2.4 E-cadherin的表达与LSCC临床病理特征的关系在不同年龄组、不同性别组和不同发病部位组E-cadherin表达阳性率的差异均无统计学意义(P>0.05)。而在LSCC的不同T分级组、不同组织分化程度组、不同临床分期组、有无颈淋巴结转移组比较,E-cadherin表达阳性率的差异有统计学意义(P<0.05)。在不同组织分化组中,E-cadherin的表达程度随组织分化程度的降低而逐渐降低,表达部位由以细胞膜染色为主到以细胞质染色为主,在低分化组织中大部分组织未见染色,只见少部分细胞浆染色(图2A~C,见封三),E-cadherin在高、中、低组织分化组中的阳性率分别为69.23%、58.82%和18.75%,低分化组E-cadherin表达阳性率与高分化组、中分化组比较差异有统计学意义(P<0.05),而中分化组与低分化组比较差异无统计学意义(P>0.05)。见表1。
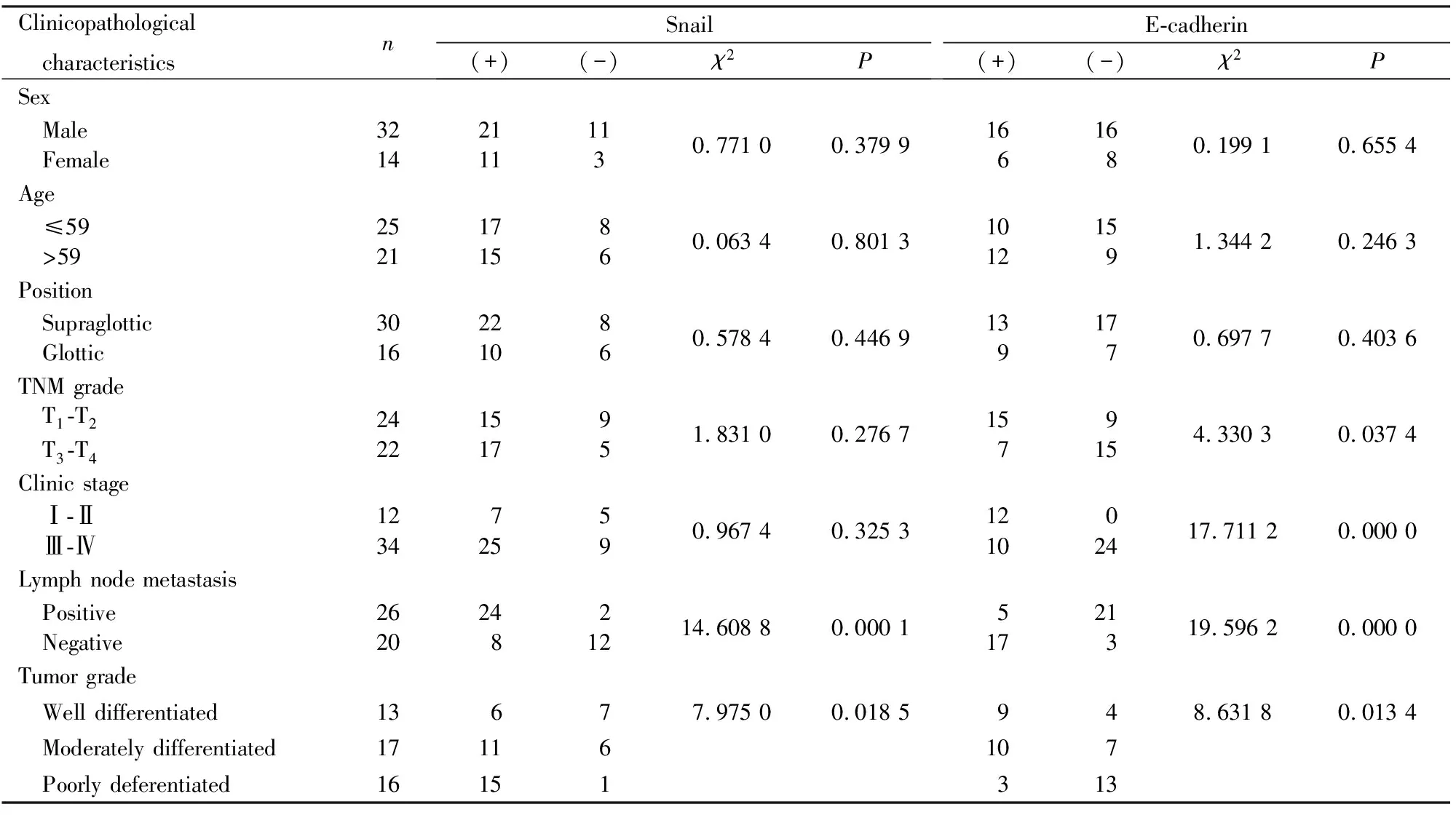
表1 Snail和E-cadherin的表达与LSCC临床病理特征的关系
2.5 Snail和E-cadherin在LSCC组织中表达的相关性经Spearman等级相关分析,Snail的阳性表达增高,E-cadherin的阳性表达明显减弱,两者在LSCC中的表达呈负相关(r=-0.569 0,P<0.01)。
3 讨 论
正常上皮依靠细胞间的黏附作用来建立和维持组织细胞的正常形态和功能,如果这种黏附作用出现异常,将会导致细胞的堆积、去分化,甚至侵袭和转移,形成恶性肿瘤。钙黏蛋白是细胞黏附分子中的一个家族,其中E-cadherin在维持正常上皮细胞形态、细胞极性及在组织结构完整性中发挥着重要作用[1]。有研究[9]发现:在转移潜能低、分化较好的细胞如正常上皮细胞MDCK、上皮性肿瘤细胞A431、MCF27、MDA2MB453中均存在较强的E-cadherin mRNA与蛋白的表达;而在转移潜能高的成纤维细胞3T3、低分化的上皮性癌细胞HepG2、MDA-MB435s、MDA-MB231中,E-cadherin的mRNA与蛋白几乎检测不到。本研究结果显示:在低分化LSCC组织中E-cadherin的表达几乎为阴性,只在少许细胞的细胞质中见弱表达,未见细胞膜表达,这可能是因为此时的E-cadherin蛋白虽有合成,但不能与细胞膜结合发挥其应有的黏附功能,使细胞黏附力下降,再次支持了EMT通过降低E-cadherin的方式促进恶性肿瘤的转化和浸润。Snail属于转录抑制子中的Snail家族,在EMT的细胞信号转导通路中居于中心环节。研究[10]表明:Snail不仅调控E-cadherin蛋白,还转录调控多种在EMT中发挥作用的蛋白,从而被认为是一种重要的肿瘤转移调节因子。体外实验将反义Snail转染入卵巢癌细胞HO9810[10]、肝癌HepG2[11]和鼻咽癌5-8F细胞[12],可以显著降低上述癌细胞的运动能力,同时其侵袭细胞外基质的能力也明显下降,从而明显降低癌细胞的转移和增殖。
临床多项研究表明:Snail和E-cadherin在很多上皮性癌(包括鳞癌、肝癌、黑色素瘤等)中存在明显的反向表达。在这些研究中还发现侵袭力强的E-cadherin阴性克隆细胞呈现Snail的高表达,而侵袭力弱的E-cadherin阳性克隆细胞几乎检测不到Snail的表达。研究[13]发现:在卵巢癌早期Snail在细胞质和细胞核中均表达,而在肿瘤晚期和转移阶段Snail单独定位于细胞核,此外Snail的表达水平和细胞定位与E-cadherin的表达呈负相关。在本研究中,Snail在高分化LSCC组织中细胞核染色较少,以细胞质染色为主,但在中分化LSCC组织中细胞核染色逐渐增多,但染色程度较低分化组织弱,而在低分化LSCC组织中则以细胞核的强染色为主。而E-cadherin的表达则与Snail相反。说明在LSCC组织中Snail和E-cadherin存在反向表达。
Snail的表达强度与组织分化程度和淋巴结转移相关,E-cadherin的表达程度除与组织分化程度和淋巴结转移相关外,还与肿瘤TNM分级和临床分期相关,考虑可能是在LSCC组织中E-cadherin除受到Snail的调控外,还可能受到其他因子的调控。研究[14]发现:无论是在mRNA水平还是在蛋白水平,转录抑制因子Snail、Slug、SIP1和Twist在梭状细胞癌中的表达均高于鳞状细胞癌,Slug、Twist和SIP1的增高具有统计学意义,而Snail无统计学意义。综上所述,Snail表达越强、E-cadherin表达越弱,LSCC就越有可能发生淋巴结转移、分化程度越差。因此Snail和E-cadherin联合检测可作为判断LSCC恶性程度和预后的参考指标,并能为个性化治疗提供参考信息。
[参考文献]
[1]Ray ME,Mehra R,Sandler HM,et al.E-cadherin protein expression predicts prostate cancer salvage radiotherapy outcomes [J].J Urol,2006,176(4): 1409-1414.
[2]Shapiro L,Fannon AM,Kwong PD,et al.Structural basis of cell-cell adhesion by cadesions[J].Nature,1995,374(6520): 327-337.
[3]Larue L,Bellcosa A.Epithelial-mesenchymal transition in development and cancer: role of phosphatidylinositol 3′,kinase/AKT pathway [J].Oncogene,2005,24:7442-7454.
[4]Come C,Arnoux V,Bibeau F,et al.Roles of the transcription factors snail and slug during mammary morphogenesis and breast carcinoma progression [J].J Mammary Gland Biol Neoplasia,2004,9(2): 183-193.
[5]Rosivatz E,Becker I,Specht K,et al,Differential expression of the epithelial-mesenchymal transition regulators snail,SIPI,and twist in gastric camer [J].Am J Pathol,2002,161(5): 1881-1891.
[6]Batlle E,Sancho E,Franci C,et al.The transcription factor Snail is a repressor of E-cadherin gene expression in epithelial tumor cells[J].Nat Cell Biol,2002,2(2): 84-89.
[7]Palmer HG,LarribaMJ,Garcia JM.The transcription factor SNAIL represses vitamin D receptor expression and responsiveness in human colon cancer [J].Nat Med,2004,10(9): 917-919.
[8]Usam Y,Satake S,Nakayama F,et al.Snail-associated epithelial-mesenchymal transition promotes oesophageal squamous cell carcinoma motility and progression[J].J Pathol,2008,215: 330-339.
[9]Zidar N,Gale N,Kojc N,et.al.Cadherin-catenin complex and transcription factor Snail-1 in spindle cell carcinoma of the head and neck[J].Virchows Arch,2008,453(3):267-274.
[10]金鸿雁,丰有吉.反义Snail转录因子抑制卵巢癌转移的实验研究[J].中华妇产科杂志,2005,40(6): 400-403.
[11]刘 海,王志强.反义Snail转录因子抑制肝癌转移[J].世界华人消化杂志,2006,14(35): 3409-3413.
[12]陈 丽,刘求真,邱际华,等.人Sna il基因RNA i慢病毒载体对鼻咽癌5-8F细胞增殖和侵袭的影响[J].第三军医大学学报,2009,31(2): 1151-1154.
[13]Jin H,Yu Y,Zhang T,et al.Snail is critical for tumor growth and metastasis of ovarian carcinoma[J].Inter J Cancer 2010,126(9):2102-2111.
[14]Kojc N,Zidar N,Gale N,et al.Transcription factors Snail,Slug,Twist,and SIP1 in spindle cell carcinoma of the head and neck [J].Virchows Arch,2009,454(5): 549-555.
