人脂肪基质细胞向胰岛素分泌细胞的分化诱导
2012-10-10韦安慧李会敏付常皓王浩天王文加苏曼曼颜炜群
韦安慧,李会敏,付常皓,王浩天,王文加,苏曼曼,颜炜群
(1.吉林大学药学院生物工程教研室,吉林 长春 130021; 2.吉林大学第二医院检验科,吉林 长春 130041)
糖尿病是由多种病因引起的以慢性高血糖为特征的代谢性疾病,严重危害人类健康。近年来,随着胰岛素治疗的改善,胰腺和胰岛细胞移植成为治疗糖尿病的有效途径[1-2]。但是胰腺和胰岛细胞移植治疗受到供体来源不足和移植排斥等因素的限制[3]。干细胞研究为胰岛细胞来源开辟了新的途径。通过干细胞定向诱导分化,可以产生大量有功能的胰岛样细胞,进而移植治疗糖尿病[4-6]。胚胎干细胞具有分化的全能型,体外可以分化为胰岛素分泌细胞[7-8],但是存在潜在致瘤性和伦理道德的问题,因此成体干细胞成为了理想的细胞来源。Timper等[9-10]诱导人脂肪基质细胞(human adipose tissue-derived stromal cells,hADSCs)分化为胰岛素分泌细胞,但是诱导后细胞是否受葡萄糖调节未检测,而且诱导后细胞的分化率低。在此基础上,本研究利用exendin-4、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、上皮细胞生长因子(epidermal growth factor,EGF)和尼克酰胺等诱导hADSCs形成胰岛样细胞团、分泌胰岛素,旨在探讨hADSCs分化为胰岛素分泌细胞的潜能,为其应用于临床移植治疗糖尿病奠定基础。
1 材料与方法
1.1 主要材料DMEM培养基(Gibco)、胎牛血清、exendin-4(Sigma)、尼克酰胺、双硫腙、bFGF(Promega)、Trizol试剂(Invitrogen),引物由上海生工合成。
1.2 细胞培养脂肪组织由吉林大学中日联谊医院整形外科提供,供者均为健康女性,年龄20~35岁,吸脂部位为腰腹部。知情同意,将所得脂肪组织,低温条件下2 h送到实验室操作。hADSCs参照文献[11]的方法分离,分离后细胞培养在DMEM基础培养基中(含10%FBS和5 mg·L-1EGF),接种于175 cm2的培养瓶中,37℃、5%CO2、95%的空气气相下培养。每3 d换液,细胞长至80%时传代培养,传代至3~5代时,进行下面实验。
1.3 hADSCs向胰岛素分泌细胞诱导分化取对数生长期第3代细胞,用细胞消化液消化,调整细胞密度至(0.5~1.0)×105mL-1,接种在胶原包被的6孔板中,置入37℃、5%的CO2、95%的空气气相下继续培养。贴壁生长至占培养皿底部80%时,基础培养液(H-DMEM+10% FBS)更换为条件培养基(H-DMEM、2%FBS、10 nmol·L-1exendin-4和20 mg·L-1bFGF),培养1周后,用L-DMEM+2% FBS+10 mg·L-1EGF+10 nmol·L-1exendin-4+10 mmol·L-1尼克酰胺诱导2周。
1.4 诱导后hADSCs的检测①RT-PCR检测:收集诱导后的细胞,提取细胞总的RNA,行RT-PCR。引物如下:胰岛素,5′-agcctttgtgaaccaacacc-3′,5′-gctggtagagggagcagatg-3′;胰十二指肠同源性盒因子(pancreatic and duodenal homeobox 1,Pdx-1),5′- gatgaagtctaccaaagctcacgc-3′,5′-ccagatcttgatgtgtctctcggtc-3′;葡萄糖转运子2 (glucose transporter 2,Glut-2),5′-accctggttttcactgtcatcactg-3′,5′-gctttgattcttccaagtgtgtcc-3′;胰高血糖素(glucagon),5′-ctcagcttcccaggcagacccactc-3′,5′-agcatgtctgcggccaagttcttca-3′;GAPDH,5′-accacagtccatgccatcac-3′,5′-tccaccaccctgttgctgta-3′。引物由上海生工合成。②双硫腙染色:50 mg双硫腙粉末(dithzone),加入5 mL DMSO中制成储备液,充分溶解后过滤,上清作为工作液。使用时用0.1 mol·L-1PBS按1∶100比例稀释。分别取诱导后胰岛素分泌细胞和未诱导的hADSCs,PBS液漂洗2次,加入染色液,37℃温育30 min,镜下观察,照相。③免疫荧光检测诱导后细胞:取诱导后细胞,4%多聚甲醛室温固定,PBS洗3次,0.25% TritonX-100处理10 min增加细胞膜的通透性,PBS洗3次,5%BSA湿盒封闭30 min,以防止非特异性吸附。加入一抗兔抗人胰岛素,兔抗人Pdx-1,4℃过夜。第2天PBS洗3次,加入二抗,FITC标记的羊抗兔抗体,37℃、30 min孵育,PBS洗3次,共聚焦显微镜观察。
1.5 葡萄糖刺激胰岛素释放实验诱导后细胞PBS洗涤3次后,分别加入低糖(含5.6 mmol·L-1葡萄糖)和高糖(含23.3 mmol·L-1葡萄糖)培养液刺激细胞,孵育1 h 后,收集细胞上清液,置于-20℃冻存。ELISA检测上清中胰岛素含量。
2 结 果
2.1 hADSCs的分离和培养细胞分离、接种24 h后,换液除去未贴壁的细胞。培养10 d后,细胞贴壁生长达90%,可见细胞呈克隆状生长。用0.25%胰酶消化细胞,1∶3传代。传代后细胞生长旺盛,细胞呈成纤维细胞样。
2.2 体外hADSCs分化为胰岛素分泌细胞加入诱导液后,细胞形态发生变化。诱导7 d左右细胞由长梭形逐渐变成多边形,并且开始聚集,培养15 d细胞呈岛状聚集,21 d左右形成胰岛样细胞团(图1,见插页三)。对诱导后胰岛样细胞双硫腙染色,倒置显微镜下观察细胞团呈红色(图2,见插页三),细胞团周围散在的单个细胞也呈阳性,对照组细胞则未着色,说明诱导后细胞内富含锌离子,与胰岛β细胞一致。
2.3 免疫荧光和RT-PCR检测结果免疫荧光染色显示Pdx-1(图3A,见插页三)和胰岛素(图3B,见插页三)在细胞内阳性表达。RT-PCR检测结果显示:胰岛素基因、胰高血糖素、Pdx-1和Glut-2在细胞中表达。见图4。
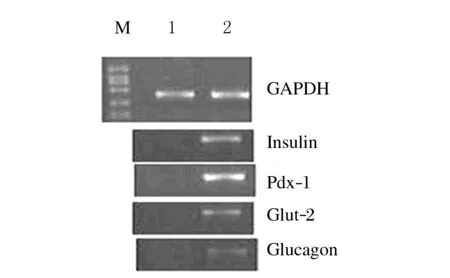
图4 RT-PCR检测诱导细胞内基因表达
2.4 葡萄糖刺激胰岛素分泌葡萄糖刺激实验中,对照组上清中未检测到胰岛素,诱导后细胞低糖刺激胰岛素分泌量为(60.21±9.14) μIU·L-1,高糖刺激胰岛素分泌量为(146.27±11.13) μIU·L-1。可见诱导后细胞分泌胰岛素,并且能感受培养液中葡萄糖浓度的变化。
3 讨 论
间充质干细胞(mesenchymal stem cell,MSC)是一群中胚层来源的具有自我更新和多向分化潜能的多能干细胞。MSC分布广泛,已从多种组织中分离出[12-13]。ADSCs包括不同成熟阶段的脂肪前体细胞,其中分化程度低的基质血管细胞(stromal-vascular cell,SV)证实为脂肪来源的MSC[14]。由于脂肪组织具有来源丰富、脂肪抽吸术简单易行、自体移植时无免疫排斥、易于分离培养、在体外具有很强的增殖能力和多分化潜能等优点,已成为细胞治疗和组织工程种子细胞的来源。干细胞在体外适宜的环境下可以分化为胰岛素分泌细胞。本实验中,在hADSCs分化的不同阶段添加促分化或促成熟的因子,促进其分化为胰岛素分泌细胞。exendin-4具有明显的促进β细胞增殖和分化的作用。尼克酰胺和葡萄糖是诱导前体细胞向成熟胰岛细胞分化的关键因子。高糖有利于干细胞的分化。尼克酰胺是一种主要的内分泌细胞分化诱导剂,促使胰岛样细胞团的形成,增加胰岛细胞的分化量,促进细胞成熟。早期的高糖可以启动Pdx-1表达,在实验的第2阶段采用了低糖环境,因为持续的高糖环境可以改变细胞β分化和胰岛素分泌的模式,而使β细胞去分化。这些因子在不同阶段适量加入,不仅有利于hADSCs的分化,而且有利于诱导后细胞的成熟和持续分泌胰岛素。Pdx-1是胰腺发育及胰岛素基因转录表达的关键性转录因子,决定了胰腺前体细胞向β细胞、α细胞和δ细胞分化[15]。Glut-2是存在于B细胞膜内的跨膜转运蛋白,可以将葡萄糖转运入细胞内,并且直接关系到细胞对葡萄糖的敏感性。本实验中RT-PCR显示了基因Pdx-1、Glut-2、胰岛素和胰高血糖素的表达;葡萄糖刺激实验显示了诱导后细胞对葡萄糖刺激敏感,说明诱导后细胞具有与成熟胰岛细胞相似的功能。
本实验成功诱导hADSCs分化为胰岛素分泌细胞,分化后细胞具有与胰岛细胞相似的功能,为细胞移植治疗糖尿病提供了细胞来源。
[参考文献]
[1]Shapiro AM,Lakey J,Ryan E,et al.Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen [J].N Engl J Med,2000,343(4):230-238.
[2]Shapiro AM,Ricordi C,Hering BJ,et al.International trial of the Edmonton protocol for islet transplantation [J].N Engl J Med,2006,355(13):1318-1330.
[3]Berney T,Toso C.Monitoring of the islet graft [J].Diabetes Metab,2006,32(5 Pt 2):503-512.
[4]Kajiyama H,Hamazaki TS,Tokuhara M,et al.Pdx1-transfected adipose tissue-derived stem cells differentiate into insulin-producing cells in vivo and reduce hyperglycemia in diabetic mice [J].Int J Dev Biol,2010,54(4):699-705.
[5]D’Amour KA,Bang AG,Eliazer S,et al.Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells [J].Nat Biotechnol,2006,24(11):1392-1401.
[6]Sun Y,Chen L,Hou XG,et al.Differentiation of bone marrow-derived mesenchymal stem cells from diabetic patients into insulin-producing cells in vitro [J].Clin Med J,2007,120(9):771-776.
[7]Segev H,Fishman B,Ziskind A,et al.Differentiation of human embryonic stem cells into insulin-producing clusters [J].Stem Cells,2004,22(3):265-274.
[8]Zhang D,Jiang W,Liu M,et al.Highly efficient differentiation of human ES cells and IPS cells into mature pancreatic insulin-producing cells [J].Cell Res,2009,19(4): 429-438.
[9]Timper K,Seboek D,Eberhardt M,et al.Human adipose tissue-derived mesenchymal stem cells differentiate into insulin,somatostatin,and glucagon expressing cells[J].Biochem Biophys Res Commun,2006,341(4):1135-1140.
[10]Lee J,Han DJ,Kim SC.In vitro differentiation of human adipose tissue-derived stem cells into cells with pancreatic phenotype by regenerating pancreas extract[J].Biochem Biophys Res Commun,2008,375(4):547-551.
[11]Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells [J].Mol Biol Cell,2002,13(12):4279-4295.
[12]Erickson GR,Gimble JM,Franklin DM,et al.Chondrogenic potential of adipose tissue-derived stromal cells in vitro and in vivo[J].Biochem Biophys Res Commun,2002,290(2): 763-769.
[13]Ashjian PH,Elbarbary AS,Edmonds B,et al.In vitro differentiation of human processed lipoaspirate cells into early neural progenitors[J].Plast Reconstr Surg,2003,111(6): 1922-1931.
[14]Zuk PA,Zhu N,Mizuno H,et al.Multilineage cells from human adipose tissue: implications for cell-based therapies[J].Tissue Eng,2001,7(2):211-228.
[15]Yuan H,Li J,Xin N,et al.Expression of Pdx1 mediates differentiation from mesenchymal stem cells into insulin-producing cells[J].Mol Biol Rep,2010,37(8):4023-4031.
