分枝杆菌噬菌体D29与巨噬细胞的相互作用及其机制
2012-10-10张红梅乌亭亭郭述良
张红梅,梁 梅,刘 平,乌亭亭,郭述良
(重庆医科大学附属第一医院呼吸内科,重庆400016)
目前结核疫情和耐药形势仍十分严峻,已有40多年没有突破性的抗结核药物问世,急需开发治疗结核病的新药物、新技术和新方法。由于噬菌体能够特异性裂解宿主菌,金黄色葡萄球菌噬菌体、铜绿假单胞菌噬菌体等多种噬菌体已用于临床试验。面对日趋严峻的结核疫情,分枝杆菌噬菌体D29因能特异性裂解结核菌而成为研究热点,国家“十一五”重大专项课题已经给予支持,该课题前期研究显示:分枝杆菌噬菌体D29不仅能裂解巨噬细胞外的结核菌,且能裂解巨噬细胞内的结核菌。但D29是如何进入巨噬细胞内,进入巨噬细胞后又是如何进入巨噬细胞内的结核菌内以及D29在巨噬细胞内结核菌内外分布的滴度变化是本文作者关注的问题,目前尚无相关文献报道。本研究通过探讨分枝杆菌噬菌体D29是否会影响巨噬细胞的免疫功能及D29被巨噬细胞吞噬后在结核菌内外的滴度变化,旨在为研究D29用于治疗结核病的机制及临床治疗剂量的确定提供参考。
1 材料与方法
1.1 菌株、动物、主要仪器和试剂
分枝杆菌噬菌体D29及耻垢分枝杆菌由本室培养,H37RV结核标准株来自重庆市肺科医院。耻垢分枝杆菌、H37RV结核标准株分别在改良罗氏培养基上37℃培养3~7 d和2~4周,分枝杆菌噬菌体D29的扩增和效价检测方法见参考文献[1-2],纯化方法见参考文献[3],4℃保存。7~8周龄SPF级BALB/C小鼠,购自重庆医科大学实验动物中心。5%CO2培养箱(Thermo Scientific公司);6孔、12孔培养板;平皿(Greiner公司);倒置显微镜(OLYMPUS);低速水平离心机(长沙平凡仪器仪表公司);超速低温离心机(Sigma 公司);PCR仪(TaKaRa Code.TP800);酶标仪;恒温水浴箱(金坛市金伟实验仪器);引物:5′-AGCTGGCCGGTACGACTCAG-3′,5′-GAGTCAACACCACGGCGGT-3′(TaKaRa)。胎牛血清(FBS,Hyclone公司);RPMI 1640(Hyclone公司);硫酸亚铁铵(FAS,Sigma公司); 7H9培养基、7H10培养基(BD公司);牛血清复合物(OADC,BD公司);IL-12 ELISA试剂盒(达科为生物技术有限公司);NO ELISA试剂盒(R&B公司)。SYBR Premix Ex Taq Ⅱ、DL 2 000 DNA Marker、pMD 18-T Vector、细菌基因组提取试剂盒、病毒RNA/DNA提取试剂盒均为TaKaRa公司产品。
1.2 腹腔巨噬细胞的提取和纯化[4]
1.2.1 巨噬细胞的提取 小鼠腹腔注射巯乙酸酯肉汤1 mL,72 h后采用颈椎脱臼法处死。75%酒精浸泡7 min后,腹腔注射PBS 4 mL/只,轻揉腹部2 min后,在无菌条件下用解剖剪和解剖镊逐层打开腹腔,回收透明的腹腔液。腹腔液1 000 r· min-1离心7 min,重悬后再用RPMI 1640液洗涤2次,最后加入RPMI 1640(10%FBS)制成细胞悬液。采用台盼蓝拒染法对细胞悬液进行细胞计数。
1.2.2 细胞计数 在细胞板上采用台盼蓝拒染法对细胞悬液进行细胞计数。公式为:细胞计数(mL-1)=(4个大格子细胞总数/4)×104×稀释倍数。根据细胞悬液的浓度用RPMI 1640(10%FBS)调整至5×105mL-1,作为工作浓度。
1.2.3 巨噬细胞的纯化 将工作浓度的细胞悬液加入6孔细胞板中,每孔l mL,37℃、5%CO2饱和湿度条件下孵育3 h,使巨噬细胞贴壁,弃去未贴壁细胞,即得到纯化的巨噬细胞。
1.3 巨噬细胞的吞噬作用
1.3.1 巨噬细胞对分枝杆菌噬菌体D29的吞噬 纯化的巨噬细胞(5×105个/孔)中每孔加入100 μL分枝杆菌噬菌体D29(1×108PFU),分别于5、10、15、20和25 min时加入8%FAS 100 μL,作用5 min以杀灭未进入巨噬细胞的D29,弃去上清,PBS冲洗3次,最后加入phage buffer 1 mL,采用反复冻融[5]的方法使巨噬细胞裂解,收集孔内所有裂解液,10 000 r·min-1离心10 min,收集上清液于离心管中,采用小平皿法铺板测定所有离心管中D29效价,每个时间点3个复孔。同时设置对照组,孔内不加巨噬细胞,以证明8%FAS作用5 min是否能将巨噬细胞外D29全部杀灭。另设D29组,效价1.4×107PFU·mL-1,用phage buffer 10×梯度稀释至1.4×102PFU·mL-1,每个稀释度的D29液经过反复冻融后,小平皿法测定效价,以证明经反复冻融后D29效价下降程度。
1.3.2 巨噬细胞对结核分枝杆菌标准株(H37RV)的吞噬 ①H37RV单细胞悬液的制备:将在改良L-J培养基上37℃生长3~4周的结核分枝杆菌菌落用7H9液体培养基洗下后研磨,用8 μm滤器过滤,麦氏比浊法测定菌液浓度,调整浓度至1 g·L-1,即得到H37RV单细胞悬液,作为巨噬细胞吞噬H37RV的工作浓度。②巨噬细胞对H37RV的吞噬:纯化的巨噬细胞(5×105个/孔)中每孔加H37RV单细胞悬液1 mL,37℃、5%CO2孵育4 h,弃去培养液,每孔加37℃的PBS(pH 7.0)2 mL,采用不离心方法洗涤3次,以去除游离的巨噬细胞和未被吞噬的H37RV。同时设无细胞对照孔以证实洗涤3次是否能将未被吞噬的菌落洗脱。
1.4 分枝杆菌噬菌体D29在巨噬细胞内的变化
分别将1×108PFU和1×107PFU的D29加入到纯化的巨噬细胞内(5×105个/孔),于20 min后用FAS杀灭细胞外的D29,分别于0、10、20和30 min反复冻融裂解巨噬细胞,收集所有液体于离心管,10 000 r· min-1离心10 min,平皿法铺板测定效价,每个时间点3个复孔。
1.5 分枝杆菌噬菌体D29对巨噬细胞的影响
纯化的巨噬细胞分为3组(一块24孔板,每6孔为一组),分别为:①巨噬细胞空白对照组;②巨噬细胞+LPS组,加入LPS使其终浓度为10 mg·L-1,为阳性对照;③巨噬细胞+D29组,将1×108PFU的D29加入巨噬细胞孔内,于20 min时FAS杀灭PBS缓冲液冲洗后,加入RPMI 1640培养基2 mL/孔,继续培养细胞12 h后分别吸取3组中每孔的培养上清液,每组均获取6个样品,ELISA法分别检测IL-12与NO含量。标准曲线的建立及细胞上清液IL-12与NO的检测严格按说明书进行操作。
1.6 分枝杆菌噬菌体D29进入巨噬细胞中结核菌的时间
工作浓度的H37RV单细胞悬液1 mL/孔加入纯化的巨噬细胞中,37℃、5%CO2孵育4 h,弃去培养液,每孔加37℃的 PBS 2 mL洗涤3次,D29(1×109PFU·mL-1)100 μL/孔加入巨噬细胞,20 min后杀灭未进入巨噬细胞的D29,分别于0、10、20、30、40和200 min裂解巨噬细胞[6],待巨噬细胞完全裂解后,加入8%FAS杀灭未进入结核菌的D29,10 000 r·min-1离心10 min,用沉淀铺板,观察噬菌斑出现时间。同时设2孔对照,巨噬细胞中不加结核菌,以证明FAS能否杀灭巨噬细胞内所有D29。
1.7 分枝杆菌噬菌体D29在巨噬细胞中结核菌内外的滴度变化
1.7.1 结核菌外的滴度变化 工作浓度的H37RV单细胞悬液1 mL/孔加入纯化的巨噬细胞中,37℃、5%CO2孵育4 h,弃去培养液,每孔加37℃的PBS 2 mL洗涤3次,1×109、1×108PFU D29分别加入巨噬细胞中,分别于30、40、50、60、190、210 min和48 h后弃上清,裂解巨噬细胞,10 000 r·min-1离心,收集上清液提取DNA(按照说明书操作),行荧光定量PCR检测。①构建DNA标准品:将片段序列为430 bp的目的基因片段克隆到pMD18-T Vector上,经纯化、线性化质粒,经抽提得标准品。②引物序列:5′-AGCTGGCCGGTACGACTCAG-3′,5′-GAGTCAACA-CCACGGCGGT-3′。③标准曲线制作:将DNA标准品梯度稀释(1×107、1×106、1×105、1×104、1×103、1×102及10 copies· μL-1)作为模板进行Real Time PCR反应,反应组成为SYBR Premix Ex Taq Ⅱ 12.5 μL,Primer F/R mix 1 μL,Template 1 μL,dH2O 9.5 μL;反应条件为95℃、30 s,95℃、5 s,60℃、30 s,后两步进行45个循环,得标准曲线。④样品检测:每个样品复测1次,反应组成及条件均按步骤③操作。
1.7.2 结核菌内的滴度变化 将1.7.1中10 000 r·min-1离心后的沉淀提取DNA(按照细菌基因组提取试剂盒),做荧光定量PCR检测,步骤如1.7.1中所述。
1.8 统计学分析

2 结 果
2.1 巨噬细胞对分枝杆菌噬菌体D29的吞噬情况
各个效价的D29液在反复冻融前后平皿法测得效价见表1。巨噬细胞在加入D29不同时间,裂解细胞后平皿法所得D29滴度见表2。无巨噬细胞的对照孔在加入8%FAS作用5 min后无噬菌斑出现,说明8%FAS 100 μL作用5 min可使巨噬细胞外的所有D29失活。表1显示:不同效价D29经过反复冻融后,滴度比较差异无统计学意义(P>0.05);表2显示:随着作用时间延长,巨噬细胞吞噬的D29量(铺板法)随之增加,在作用20 min时吞噬量多,与25 min时相比虽有下降,但差异无统计学意义(P>0.05),因此在观察D29与巨噬细胞相互作用时感染时间选择20 min为宜。

表1 不同效价D29液在反复冻融前后效价比较
表2 与巨噬细胞作用不同时间后D29进入巨噬细胞的数量
2.2 分枝杆菌噬菌体D29在巨噬细胞内的滴度变化
1×108及1×107PFU D29与巨噬细胞共同孵育20 min后,经反复冻融法(约160 min)后铺板测D29效价,均有约104PFU的D29被巨噬细胞吞噬,进入巨噬细胞约170 min后D29存活量即开始减少,180 min后大量失活,差异有统计学意义(P<0.05),190 min时巨噬细胞内已无存活的D29。见表3。
2.3 分枝杆菌噬菌体D29对巨噬细胞免疫功能的影响
D29被巨噬细胞吞噬后,上清液中IL-12和NO水平与巨噬细胞空白组比较差异无统计学意义,但明显少于LPS阳性对照组(P<0.05)。见表4。

表3 D29进入巨噬细胞不同时间后存活量比较

表4 巨噬细胞上清液IL-12和NO水平
2.4 分枝杆菌噬菌体D29进入巨噬细胞中结核菌内的时间
结核菌被巨噬细胞吞噬后,1×109PFU·mL-1D29以100 μL/孔加入巨噬细胞,孵育20 min后杀灭未进入巨噬细胞的D29,即刻裂解巨噬细胞并加入8%FAS后,离心用沉淀铺板未见噬菌斑,10 min时裂解巨噬细胞可见17个噬菌斑,20 min时可见20个噬菌斑,30 min时可见25个噬菌斑,40 min时可见75个噬菌斑,200 min时可见60个噬菌斑(图1)。未加结核菌的对照组于10 min裂解巨噬细胞后无噬菌斑出现,说明FAS能杀灭巨噬细胞内所有D29。
2.5 荧光定量PCR检测分枝杆菌噬菌体D29在巨噬细胞中结核菌内外的滴度变化
加入1×109及1×108PFU D29于巨噬细胞中,作用40、50 min时,D29在结核菌内外滴度均有一过性升高,此后结核菌内外滴度均下降,作用190、210 min时D29量大幅度减少,48 h时结核菌内外几乎不能检测到D29(图中未给予表示)。见图2和3。
3 讨 论
随着耐药结核的出现,噬菌体疗法显得尤为重要,但结核分枝杆菌属于胞内寄生菌,D29进入巨噬细胞后是否会被巨噬细胞杀灭、是否会影响巨噬细胞的免疫功能、进入巨噬细胞后在结核菌内外的滴度变化对于确定D29用于治疗结核病的给药剂量尤为重要。D29被巨噬细胞吞噬后很快失活,但当巨噬细胞内存在结核菌时,D29存活时间延长,提示当D29用于治疗时可选择无致病性的耻垢分枝杆菌或母牛分枝杆菌作为载体,可能会延长D29在巨噬细胞内的存活时间,从而更好地发挥裂解胞内结核菌的作用。有研究[7]表明:将大肠杆菌和T4噬菌体预先共培养15 min后再与中性粒细胞混合,可增强中性粒细胞吞噬大肠杆菌的能力。这说明本文作者选用耻垢分枝杆菌或是母牛分枝杆菌作为载体,可能会增强巨噬细胞对其载体的吞噬能力,从而会有更多的D29到达靶细胞发挥裂解作用,这对治疗胞内结核菌的感染有很大益处。

图1 D29在不同时间进入巨噬细胞中结核菌内的数量
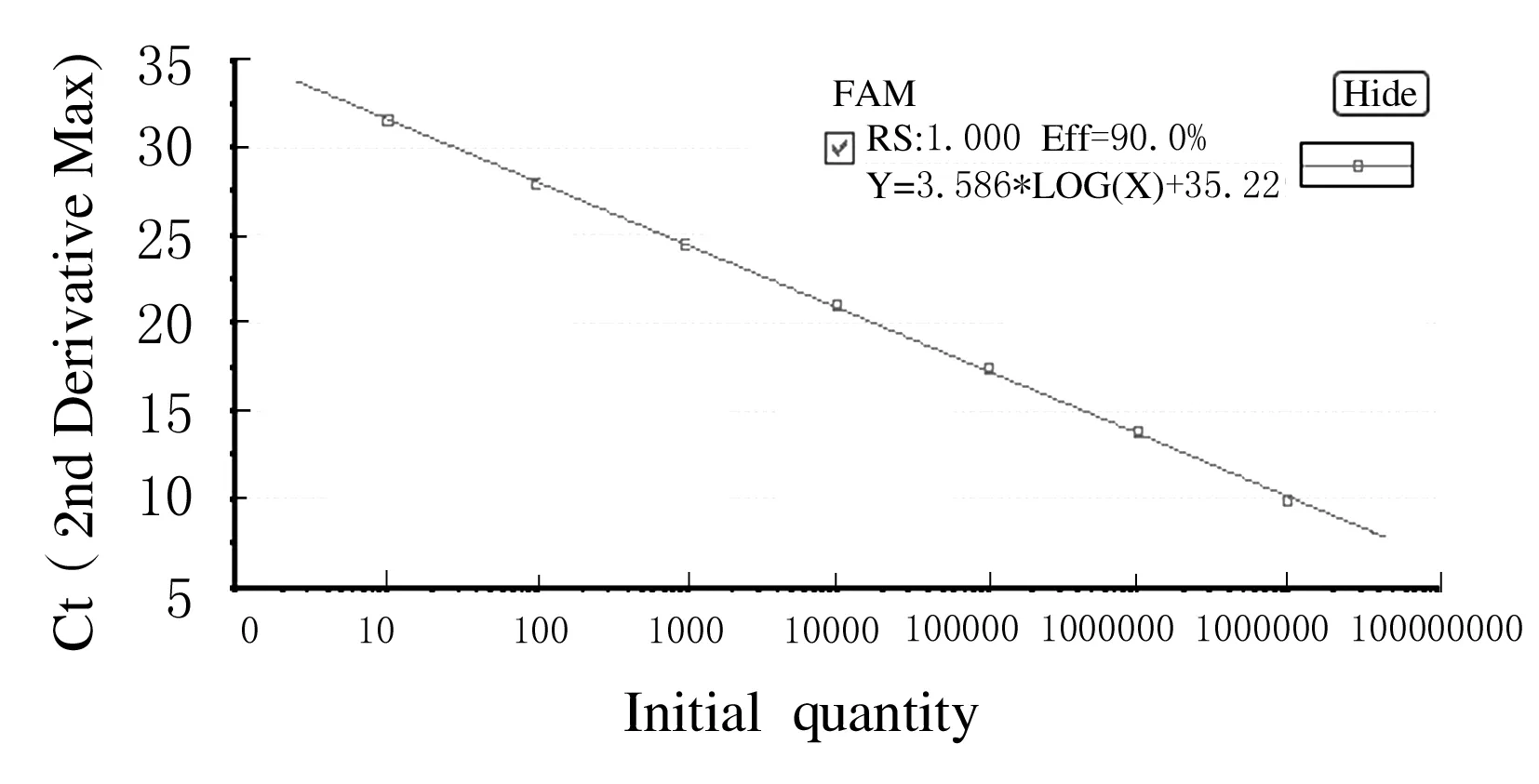
图2 标准曲线
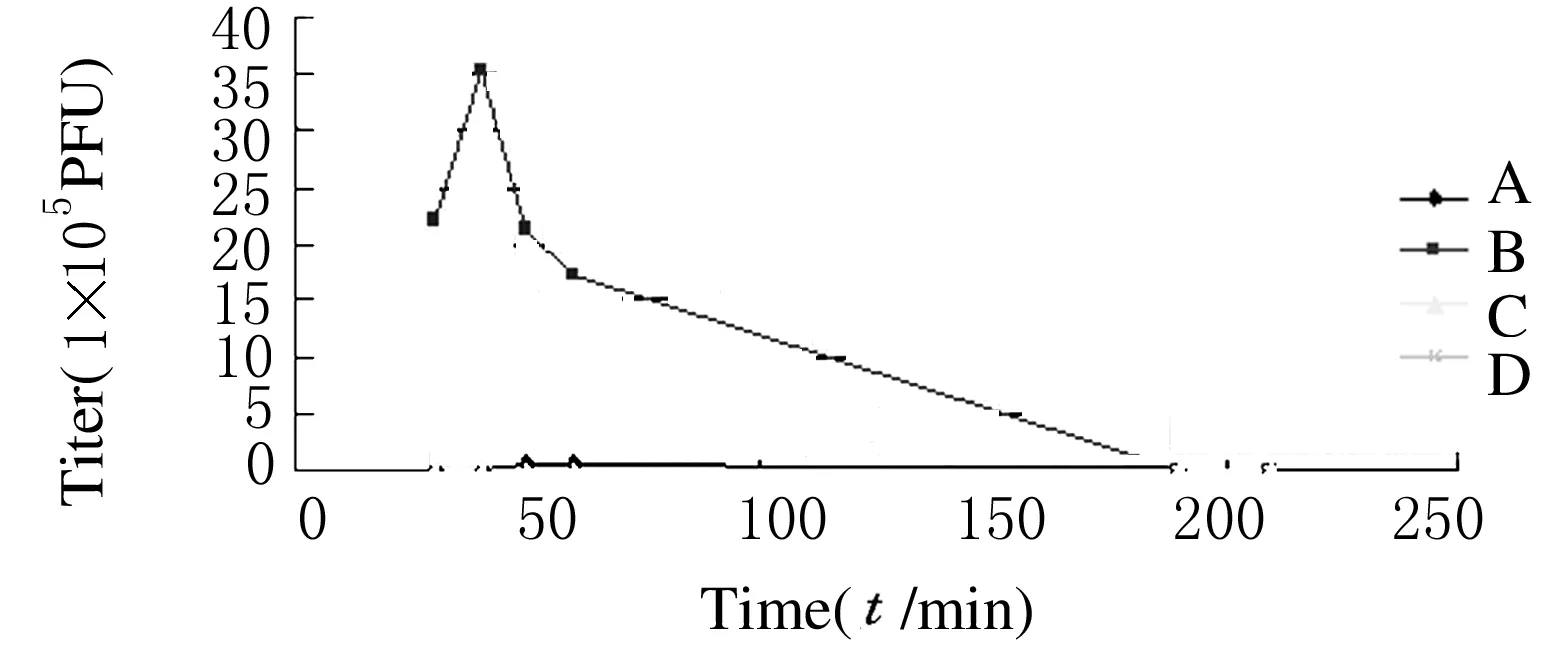
图3 D29被巨噬细胞吞噬后分布于结核菌内外的滴度变化
结核病发病时表现为Th1免疫应答受抑制和(或)Th2应答亢进,IL-12是一种异源二聚体的细胞因子,能诱导初始T细胞分化为Th1细胞,并促进Th1增殖,有可能调节机体的抗结核免疫。NO是一种多功能的信息分子,可在巨噬细胞发挥细胞毒性作用、免疫调节作用以及胞内杀菌作用等。本研究结果显示:D29被巨噬细胞吞噬后,细胞上清液中IL-12及NO水平与空白对照组比较差异无统计学意义,说明D29不会影响巨噬细胞的免疫功能。而Eriksson等[8]研究显示:噬菌体可增加小鼠脾细胞培养上清液中IL-12水平。这可能与本研究所用噬菌体株不同及脾组织中含有较多淋巴细胞有关。
Rosanna等[9]证实:phage MSa能够减少甚至杀灭小鼠巨噬细胞内的金黄色葡萄球菌;彭丽等[4]也证实:D29进入巨噬细胞后可以减少巨噬细胞内的活菌数量。本研究证实了D29进入巨噬细胞后,能吸附并感染结核菌,通过在其中复制、增殖杀灭结核菌,但D29感染效率不高,这可能与胞内弱酸环境影响D29的吸附有关[10]。在本研究中,D29与吞噬了结核菌的巨噬细胞孵育40和50 min时,D29在结核菌内外滴度均有一过性升高,这可能有两方面原因:①随着时间延长,进入巨噬细胞内的D29增多,进入结核菌的D29量也增多;②随着D29进入结核菌,其DNA在其中开始复制、增殖,这可以用David等[11]的研究结果解释:DNA在结核菌内复制开始于感染后20 min,10 min后复制1代。但是此后结核菌内外滴度均下降,孵育190、210 min时D29量大幅度减少,48 h时结核菌内外几乎不能检测到D29,分析原因可能是由于巨噬细胞对其杀伤作用大,D29从结核菌内释放出来后未能感染其他结核菌就被溶酶体消化了,提示在用D29治疗结核病时可能需要多次给药。但也有可能是因为结核菌长期处在D29的环境里发生了变异,使其对D29产生抗性,因而D29不能吸附并进入结核菌而长期暴露在巨噬细胞中被消化,具体原因还有待下一步证实。
本研究中扩增D29最大滴度为1×109PFU·mL-1,所以在使用剂量上受到了很大限制,根据本研究结果,D29滴度越高,进入巨噬细胞中及巨噬细胞中结核菌内的数量越多,且D29不会影响巨噬细胞的免疫功能,如果D29用于治疗结核病,临床上可考虑使用较大剂量。
[参考文献]
[1]Hatfull GF.Phage hunting program[M].Pittsburgh:University of Pittsburgh,2005:26-40.
[2]McNerney R,Wilson SM,Sidhu AM,et al.Inactivation of mycobacteriophage D29 using ferrous ammonium sulphate as a tool for the detection of viable Mycobacterium smegmatis and M.tuberculosis[J].Res Microbiol,1998,149(7): 487-495.
[3]萨姆布鲁克.拉塞尔著.黄培堂译.分子克隆实验指南[M].3版.北京:科学出版社,2002:8.
[4]彭 丽,陈保文,罗永艾,等.利用噬菌体杀灭巨噬细胞内耻垢分枝杆菌的实验研究[J].Chin J Tuberc Respir Dis,2005,28(9):619-622.
[5]Duong T,Barrangou R,Russell WM,et al.Characterization of the tre Locus and analysis of trehalose cryoprotection inLactobacillusacidophilusNCFM[J].Appl Envir Microbiol,2006(72):1218-1225.
[6]Lawrence B,Danuta S,Elizabeth M,et al.Killing of mycobacterium avium and mycobacterium tuberculosis by a mycobacteriophage delivered by a nonvirulent mycobacterium:A model for phage therapy of intracellular bacterial pathogens[J].J Infect Dis,2002,186(15):1155-1160.
[7]Przerwa A,Zimecki M,Switaía-Jeleń K,et al.Effects of bacteriophages on free radical production and phagocytic functions[J].Med Microbiol Immunol,2006,195(3):143-150.
[8]Eriksson F,Culp WD,Massey R,et al.Tumor-specific phage particles promote tumor regression in a mouse melanoma model[J].Cancer Immunol Immunother,2007,56(5):677-687.
[9]Capparelli R,Parlato M,Borriello G,et al.Experimental phage therapy against Staphylococcus aureus in mice[J].Antimicrob Agents Chemother,2007,51(8):2765-2773.
[10]司樨东.噬菌体学[M].北京:科学出版社,1996:26-30.
[11]David HL,Sérès-Clavel S,Clément F,et al.Further observations on the mycobacteriophage D29-mycobacterial interactions[J].Acta Leprol,1984,2(2-4): 359-367.
