肝细胞中固有干扰素调节因子7的表达及其抗病毒作用
2012-10-10金清龙温晓玉牛俊奇
齐 月,金清龙,温晓玉,牛俊奇
(吉林大学第一医院肝胆胰内科,吉林 长春 130021)
在针对丙型肝炎病毒(HCV)的体外培养过程中,肿瘤细胞株HuH-7对于基因型2a型的HCV病毒株JFH1的复制容许度要远远高于人永生化细胞株HuS-E/2[1-2]。HuH-7和HuS-E/2基因表达的对比显示:HuS-E/2细胞中存在干扰素调节因子7(interferon regulatory factor 7,IRF7)的固有表达,而HuH-7细胞中不具备这种基因的固有表达[3]。目前对于RNA病毒感染后,尤其是HCV感染后,细胞内部免疫反应的研究多使用HuH细胞株为研究工具,其研究结果表明:病毒感染后,通过激活IRF3,使其形成二聚体,进入细胞核内,诱导IFN 的转录,IFN 通过干扰素受体(IFNAR),诱导IRF7的表达与激活,然后作用于细胞核内,诱导IFN 的转录表达,最终达到抑制病毒的作用[4-5]。而人原代肝细胞及永生化肝细胞中均可以检测到IRF7的固有表达[3],其作用尚不明确。考虑到固有表达 IRF7在细胞免疫反应中的作用[6],本文作者拟通过检测肝细胞中IRF7在病毒感染后相关免疫基因[7-12]诱导表达的作用,以及其对于HCV在HuH-7细胞中的感染复制的作用,评估HuH-7是否可以完全替代肝细胞作为HCV感染体外研究的工具。
1 材料与方法
1.1 细胞培养原代肝细胞冻存液(江阴齐氏)为商业制品,HuS-E/2细胞及HuH-7细胞由北海道大学Hussein Aly博士馈赠,HuS-E/2和原代肝细胞的培养条件为DMEM (Invitrogen),内含44 mmol·L-1碳酸氢钠、10 mmol·L-1烟碱、5%小牛血清 (Gibco)、5% AB型人血清(Sigma)、20 mmol·L-1HEPES (Gibco)、0.1 mmol·L-1长效抗坏血酸、5 mg·L-1EGF (Sigma)、100 mg·L-1链霉素、1%DMSO、8 mg·L-1脯氨酸、0.25 mg·L-1胰岛素 (Sigma)、50 nmol·L-1地塞米松、100 IU·mL-1青霉素及2 mg·L-1两性霉素B。37℃、CO2孵箱培养。HuH-7的培养条件为DMEM (Invitrogen),内含100 IU·mL-1青霉素、10%小牛血清 (Gibco)、20 mmol·L-1HEPES (Gibco)及100 mg·L-1链霉素。
1.2 抗体及免疫荧光染抗-IRF7抗体(H246,Santa Cruz Biotechnology),Alexa Fluor 488 山羊抗兔 IgG(A11008,Invitrogen),Alexa Fluor 546 山羊抗人IgG(A11027,Invitrogen)均为商业制品。以纤维蛋白原Ⅰ包被的玻璃培养板培养HuH-7细胞,以含有JFH1的培养基孵育过夜进行感染,以HCV感染者血清作为第一抗体标记HCV感染的细胞。以纤维蛋白原Ⅰ包被的玻璃培养板培养原代肝细胞,以仙台病毒(Sendai virus,SV)感染,在指定时间点,以抗IRF7抗体作为第一抗体进行标记。采用荧光显微镜Biozero进行检测。
1.3 质粒构建及转染以293T细胞的全长RNA作为模板,利用逆转录多聚酶链反应(RT-PCR)技术,克隆全长IRF7的cDNA,并插入pcDNA3表达载体中,构建pcDNA3-IRF7表达质粒。FuGENE transfection reagent(Promega)作为HuH-7细胞的转染试剂,Effectene transfection reagent (Qiagen) 作为原代肝细胞的转染试剂,按照试剂盒提供的说明书进行转染。IRF7显性负性突变体表达质粒pcDNA3-7DN为北海道大学Hussein Aly博士馈赠[3]。psiRNA-hIRF-7(Invitrogen)为商业制品。
1.4 RNA的提取采用RT-PCR及实时定量PCR(real time PCR),以氯仿乙醇法提取细胞全长RNA[2],以200 ng全长RNA为模板,以one step RNA PCR kit (Takara)进行RT-PCR,通过对比特定长度的cDNA条带灰度,比较其mRNA的表达水平,以40 ng全长RNA 为模板,以SYBR GREEN PCR Master Mix (Applied Biosystems)进行实时定量PCR,通过比较mRNA的相对量来比较基因表达情况。GAPDH 上游引物:5′- CCATGGAGAAGGCTGGGG-3′,下游引物:5′-CAAAGTTGTCATGGATGACC-3′;IFNα1上游引物:5′-TGGCAACCAGTTCCAGAAGGCTCCA-3′,下游引物:5′-TCTGCTCTGACAACCTCAGGCAC-3′;IFNβ上游引物:5′-TTCAGAGGACAGTCGCCACC-3′,下游引物:5′-ATGCCCCAGACCTCCTTCTC-3′;IFNλ3上游引物:5′-GCACACACGAGGCCTATGTC-3′,下游引物:5′-CTTCCACCTGGCCAGGAATC-3′;RIG-I上游引物:5′-GCTCCTACAGGTTGTGGAAA-3′,下游引物:5′-CAGTGGGCCTGAAGATCCTC-3′;IRF7上游引物:5′- TGCTGCCTCGGAACTGTGAC-3′,下游引物:5′- TCACCAGGACCAGGCTCTTC -3′。
2 结 果
2.1 HuH-7细胞与肝细胞在RNA病毒感染后的免疫相关基因表达RT-PCR检测结果显示:未经感染的HuH-7中无IRF7的表达,而原代肝细胞中存在IRF7的固有表达(图1)。在感染12 h之内,相同RT-PCR检测条件下,HuH-7细胞中未检测到相关基因RNA的条带,而原代肝细胞中检测到IFNα1、IFNβ、IFNλ3和RIG-I 的诱导表达。但IFNα1的诱导表达量很低(图2)。
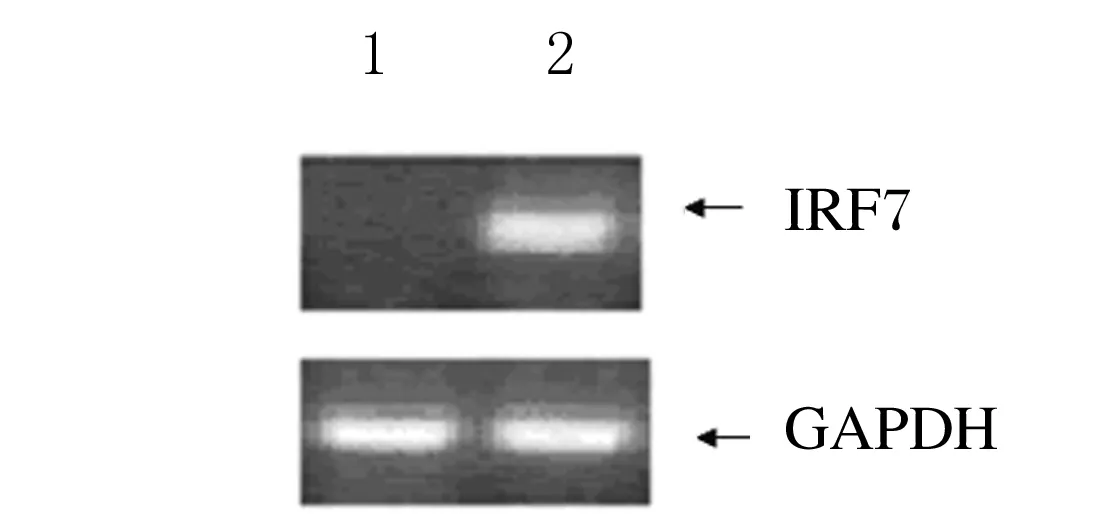
图1 IRF7在未经感染的原代肝细胞和HuH-7细胞中的表达
2.2 永生化肝细胞在RNA病毒感染后的干扰素诱导在感染早期,表达7DN的细胞中,IFNα1、RIG-I、IFNβ和IFNλ3的诱导均受到抑制,但感染6 h后,这种抑制逐渐消退(图3)。转染psiRNA-hIRF-7 HuS-E/2细胞中IRF-7的mRNA水平降低至正常水平的20%。实时PCR法检测,SV感染3 h内IFNα1、RIG-I、IFNβ和IFNλ3的表达情况见图4,结果显示:在永生化肝细胞被SV感染的前3 h,可以检测到上述基因的诱导表达,而在IRF-7 mRNA下调的细胞中,上述基因的表达水平明显降低。
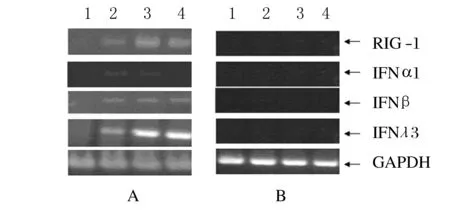
图2 SV感染后相关基因的表达
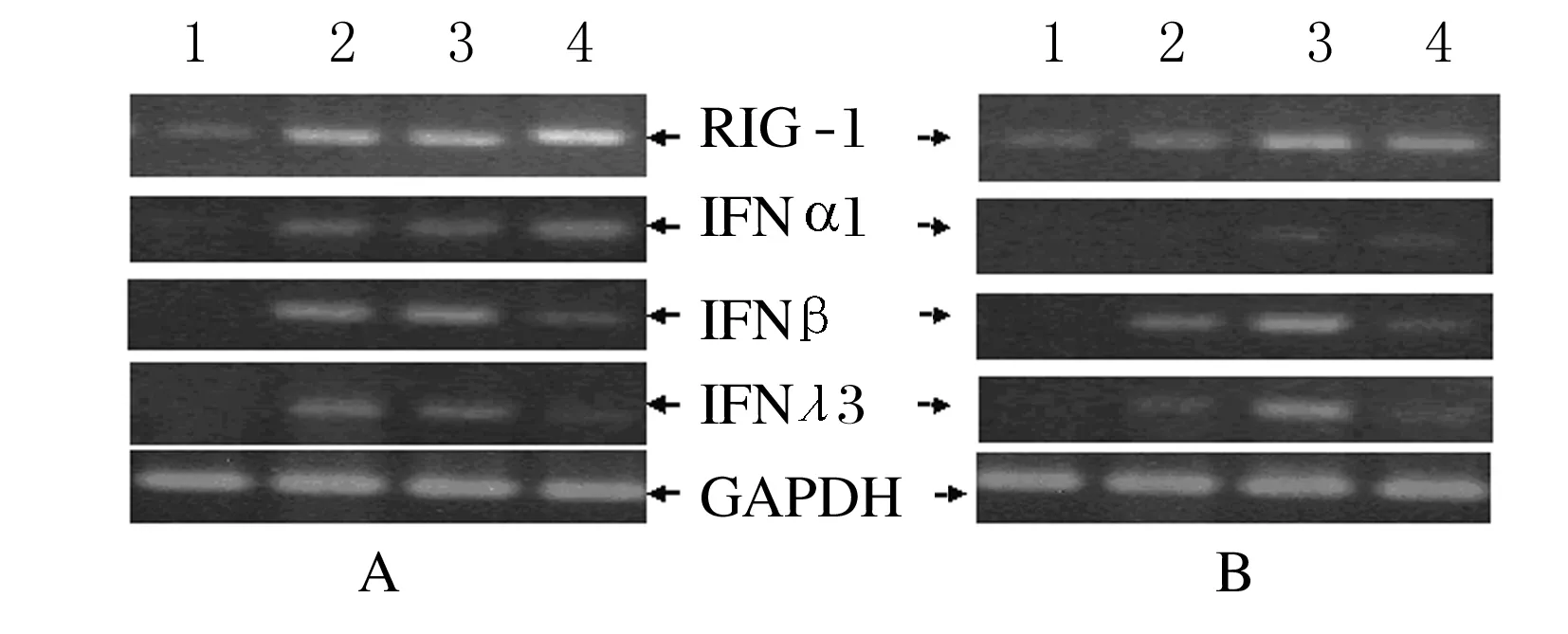
图3 HuS-E/2细胞中IFNα1、IFNβ、IFNλ3和 RIG-I的表达
2.3 感染前即存在IRF7异位表达的HuH-7细胞中JFH1的感染水平与转染pcDNA3的细胞比较表达异位IRF7的HuH-7细胞中,JFH1的感染率明显下降(图5,见封二)。提示IRF7的异位表达可以抑制HuH-7细胞中HCV的感染复制。利用健康者血清作为第一抗体重复检测转染空载体的HuH-7细胞时,IRF7及HCV感染的信号见图6(封二)。
3 讨 论
IRF7参与免疫过程中细胞干扰素的诱导,机体的大部分细胞不存在IRF7的固有表达,在HCV感染后,通过IFNβ诱导,可以大量产生。但最近有研究报道:人肝细胞中存在大量固有表达的IRF7,其功能尚不清楚。本研究通过转染IRF7表达载体入没有IRF7固有表达的HuH-7细胞,检测其转染前后HCV的感染支持水平,对比HuH-7细胞与肝细胞在SV感染后IFNα1、RIG-I,、IFNβ和IFNλ3的诱导以及抑制IRF7功能,以上述基因的表达变化来初步阐述IRF7在肝细胞病毒感染后免疫反应中的作用。肝脏是人体最大的实体免疫器官,其生理地位决定了其要面对大量的入侵因素,包括病毒、细菌等,IRF7的固有表达,很可能决定了肝脏应对各种入侵因素的反应程度,有利于机体的免疫应答。本研究结果从另外一个角度说明目前比较常用的HuH-7细胞并不能完全真实地反应HCV感染肝细胞的情况,尚需开发新HCV体外模型,以便更好地进行HCV感染的研究。
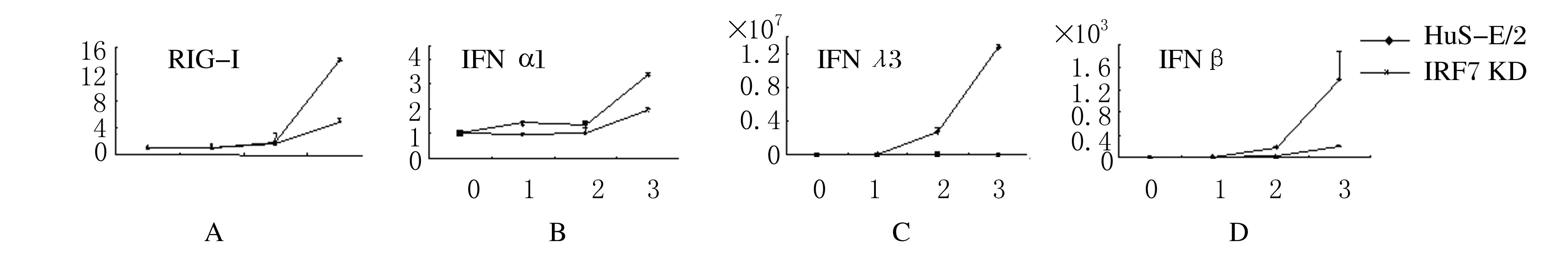
图4 实时PCR检测SV感染3 h内HuS-E/2细胞中RIG-I (A)、IFNα1(B)、IFNλ3(C)和IFNβ(D)的表达
[参考文献]
[1]Wakita T,Pietschmann T,Kato T,et al.Production of infectious hepatitis C virus in tissue culture from a cloned viral genome[J].Nat Med,2005,11(7):791-796.
[2]Aly HH,Qi Y,Atsuzawa K,et al.Strain-dependent viral dynamics and virus-cell interactions in a novel in vitro system supporting the life cycle of blood-borne hepatitis C virus[J].Hepatology,2009,50(3): 689-696.
[3]Aly HH,Watashi K,Hijikata M,et al.Serum-derived hepatitis C virus infectivity in interferon regulatory factor-7-suppressed human primary hepatocytes[J].J Hepatol,2007,46(1): 26-36.
[4]Yoneyama M,Fujita T.Recognition of viral nucleic acids in innate immunity[J].Rev Med Virol,2010,20(1): 4-22.
[5]Honda K,Taniguchi T.IRFs: master regulators of signalling by Toll-like receptors and cytosolic pattern-recognition receptors[J].Nat Rev Immunol,2006,6(9): 644-658.
[6]Kerkmann M,Rothenfusser S,Hornung V,et al.Activation with CpG-A and CpG-B oligonucleotides reveals two distinct regulatory pathways of type I IFN synthesis in human plasmacytoid dendritic cells[J].J Immunol,2003,170(9): 4465-4474.
[7]Thomas DL,Thio CL,Martin MP,et al.Genetic variation in IL28B and spontaneous clearance of hepatitis C virus[J].Nature,2009,461(7265): 798-801.
[8]Suppiah V,Moldovan M,Ahlenstiel G,et al.IL28B is associated with response to chronic hepatitis C interferon-alpha and ribavirin therapy[J].Nat Genet,2009,41(10): 1100-1104.
[9]Tanaka Y,Nishida N,Sugiyama M,et al.Genome-wide association of IL28B with response to pegylated interferon-alpha and ribavirin therapy for chronic hepatitis C[J].Nat Genet,2009,41(10): 1105-1109.
[10]Ge D,Fellay J,Thompson AJ,et al.Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance[J].Nature,2009,461(7262): 399-401.
[11]Chang S,Kodys K,Szabo G.Impaired expression and function of toll-like receptor 7 in hepatitis C virus infection in human hepatoma cells[J].Hepatology,2010,51(1): 35-42.
[12]Osterlund PI,Pietilä TE,Veckman V,et al.IFN regulatory factor family members differentially regulate the expression of type Ⅲ IFN (IFN-lambda) genes[J].J Immunol,2007,179(6): 3434-3442.
