大鼠前列腺炎模型中L6~S1背根神经节TRPV1和NGF的表达
2012-10-10张建华
陈 勇,张建华,赵 涛,孙 伟
(重庆市涪陵中心医院泌尿外科 408000)
跨器官痛觉致敏是近年提出的关于内脏疼痛的一个新理论[1-2],即一个病变内脏器官的疼痛继发性引起另一个相邻器官痛觉敏化,进而导致后者功能异常。研究发现,慢性前列腺炎疼痛呈现跨器官痛觉致敏的特点,推测前列腺疼痛产生机制可能与跨器官痛觉致敏有关,而背根神经节(dorsal root ganglion,DRG)神经元瞬时感受器电位香草酸受体1(transient receptor potential vanilloid-1,TRPV1)的过度表达是跨器官痛觉致敏产生的主要原因[2-3]。本实验通过制作大鼠前列腺炎模型[4],观 察 腰 骶 段 DRG TRPV1 和 神 经 生 长 因 子 (nerve growth factor,NGF)的表达,以了解DRG继发性改变在慢性前列腺炎疼痛中的作用。
1 材料与方法
1.1 材料 完全氟氏佐剂(CFA)购自Sigma公司,抗TRPV1和抗NGF抗体购自武汉博士德公司,二抗购自Santa Cruz公司。
1.2 方法
1.2.1 动物模型的分组与DRG标本制备 雄性成年SPF Wistar大鼠30只,体质量200g左右(重庆医科大学实验动物中心提供),随机分为实验组和对照组,两组分别设0、7、14d3个时相,共6组。实验组在大鼠下腹正中做一长约1cm的小切口,显露前列腺,前列腺内注射完全弗氏佐剂20μL,对照组注射等量生理盐水,关闭切口。继续饲养0、7、14d后分别用于实验。将达到实验天数的实验组和对照组大鼠分别断头处死,解剖获取L6~S1节段DRG,准确称取湿质量。
1.2.2 逆转录-聚合酶链反应(RT-PCR)检测 TRPV1、NGF mRNA表达 准确称质量后,提取总RNA[参照Tripure说明书进行,所有使用器皿均经焦碳酸二乙酯(DEPC)或高温干烤去RNA酶处理],RT-PCR按试剂盒(上海Promega公司)说明书进行。选用β-actin作为内参照物。PCR引物序列:β-actin上游引物:5′-CCC ATC TAT GAG GGT TAC GC-3′,下游引物:5′-TTT AAT GTC ACG CAC GAT TTC-3′,扩增片段长度150bp;TRPV1上游引物序列为5′-GCC CAA CGA AGA AAA CCA TAA-3′,下游引物序列为5′-ACA CGC TCA GCT CCC CAC-3′,扩增片段长度188bp;NGF上游引物序列5′-TGG CGG TCT TTT TTC GTT-3′,下游引物序列为 5′-GCA TTG CCT CCT TGA TTT GG-3′,扩增片段长度 114 bp。PCR反应条件:94℃预变性3min,94℃变性30s,55℃退水1min,72℃延伸2min,共35个循环,72℃再延伸5min。扩增产物经2%琼脂糖凝胶电泳,用Quantity One 4.4软件分析各产物条带光密度(OD)值,计算TRPV1、NGF mRNA的相对表达量。
1.2.3 蛋白质印迹检测TRPV1、NGF蛋白表达 10%SDS和乙醇清洗SDS-PAGE电泳装置,制备12%的分离胶和4%浓缩胶,取一定量的蛋白标本TRPV1 40μg和上样缓冲液1∶1混合,准确上样后进行SDS-PAGE电泳,浓缩胶80V,分离胶120V,取适当大小的凝胶和相同大小的PVDF膜在50V电压下转膜,观察转膜效果,PVDF膜置于5%去脂奶粉中封闭,依次加入一抗TRPV1(1∶400)、抗 NGF(1∶400),二抗(1∶1 000)杂交,室温下振荡封闭,化学发光显色,用Quantity One4.4软件分析图像,采用积分吸光度值(IA)相对比较蛋白的表达。
2 结 果
2.1 TRPV1表达 大鼠L6~S1节段DRG中TRPV1的mRNA及蛋白表达量比较,实验组7d与14d比较显著高于对照组和实验组0d(P<0.01);实验组7d与14d比较差异无统计学意义(P>0.05),见表1、2。
表1 各组大鼠L6~S1DRG神经元表达TRPV1mRNA的变化(±s)

表1 各组大鼠L6~S1DRG神经元表达TRPV1mRNA的变化(±s)
*:P<0.01,与对照组比较;▲:P<0.01,与0d比较。
组别0d 7d 14d实验组 0.411±0.021 0.789±0.065*▲ 0.783±0.037*▲对照组0.408±0.025 0.483±0.043 0.491±0.042
表2 各组大鼠L6~S1DRG神经元表达TRPV1蛋白的变化±s,IOD)
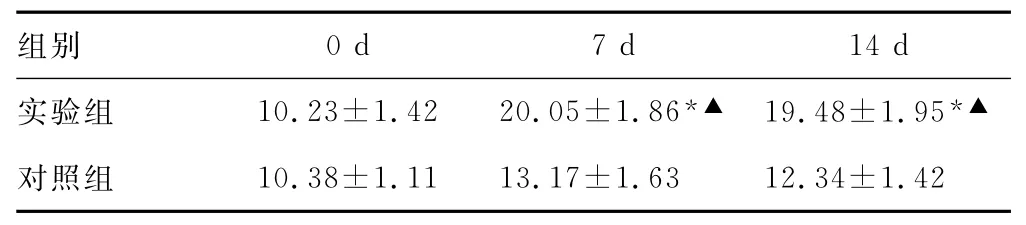
表2 各组大鼠L6~S1DRG神经元表达TRPV1蛋白的变化±s,IOD)
*:P<0.01,与对照组比较;▲:P<0.01,与0d比较。
组别0d 7d 14d实验组 10.23±1.42 20.05±1.86*▲ 19.48±1.95*▲对照组10.38±1.11 13.17±1.63 12.34±1.42
2.2 NGF表达 大鼠L6~S1节段DRG中NGF的蛋白及mRNA表达量比较,实验组7d和14d显著高于对照组和实验组0d(P<0.01);实验组14d低于实验组7d(P<0.05),见表3、4。
表3 各组大鼠L6~S1DRG神经元表达NGF mRNA的变化(±s)

表3 各组大鼠L6~S1DRG神经元表达NGF mRNA的变化(±s)
*:P<0.01,与对照组比较;▲:P<0.01,与0d比较;◆:P<0.05,与7d比较。
组别0d 7d 14d实验组 0.431±0.032 0.719±0.046*▲ 0.582±0.019*▲◆对照组0.427±0.025 0.438±0.068 0.489±0.054
表4 各组大鼠L6~S1DRG神经元表达NGF蛋白的变化(±s,IOD)
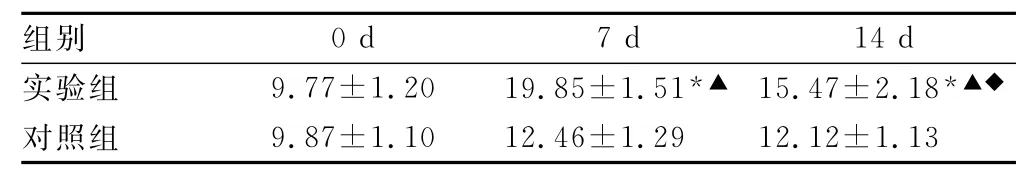
表4 各组大鼠L6~S1DRG神经元表达NGF蛋白的变化(±s,IOD)
*:P<0.01,与对照组比较;▲:P<0.01,与0d比较;◆:P<0.05,与7d比较。
组别0d 7d 14d实验组 9.77±1.20 19.85±1.51*▲ 15.47±2.18*▲◆对照组9.87±1.10 12.46±1.29 12.12±1.13
3 讨 论
慢性前列腺炎病因尚不十分清楚,治疗较为棘手,疼痛为其主要表现,也是患者就诊的主要原因[5]。前列腺疼痛不只局限于前列腺部位,而是分布在整个腰骶神经支配区,在没有原发病变的其他部位也可能出现自发疼痛;而且临床上有些前列腺疼痛在前列腺炎症消失后疼痛仍然存在。目前对疼痛产生的机制尚不清楚。
跨器官痛觉致敏是近年提出的关于内脏疼痛的一个新理论[1,3],即一个病变内脏器官的疼痛继发引起另一个相邻器官痛觉敏化,进而导致后者功能异常。脊髓前、脊髓、脊髓上(大脑)的3段不同但相互关联的神经通路构成盆腔跨器官痛觉致敏的解剖基础[1,6];这3段通路共同对盆腔器官的跨器官痛觉致敏起作用。目前认为脊髓前(背根神经节)起主要作用,同时对其研究较多[1-3],通常认为跨器官痛觉致敏外周通路的解剖基础是DRG神经元通过分支轴突联结到不同盆腔结构。
跨器官痛觉致敏理论的提出为阐明CP/CPPS疼痛的发生机制提供了一条崭新思路[3]。慢性前列腺炎疼痛具备跨器官痛觉致敏的特点,而且作者前期研究发现腰骶段DRG神经元有分支同时投射到前列腺与盆底、会阴部[7],也即前列腺与盆腔器官存在跨器官痛觉致敏产生的解剖学基础。因此,作者认为慢性前列腺炎疼痛产生与跨器官痛觉致敏密切相关,具体信号传导通路需进一步研究。
TRPV1广泛分布于初级感觉神经元末梢的伤害性感受器上,现已证明其参与炎症和痛觉过敏的形成[2,6]。TRPV1是一种非选择性阳离子通道,参与初级感觉神经元外周末端中伤害性刺激分子整合,可探测和整合诱发痛觉的化学和热刺激信号,主要有辣椒素(红辣椒的辛辣成分)、伤害性热(>43℃)及质子等。TRPV1的活性可以通过NGF、缓激肽等刺激来启动细胞内瀑布信号转导,以这种方式,NGF、缓激肽就能降低TRPV1阈值,以至在正常的情况下允许通道开放,从而诱导痛觉过敏[8]。TRPV1主要分布于背根神经节和三叉神经节,在前列腺与膀胱主要分布在上皮细胞和上皮下的初级感觉传入纤维浆膜表面[9],其主要生理功能是参与排尿反射,病理情况下与膀胱炎性痛、痛觉过敏以及膀胱刺激症有关。Miller等[10]报道慢性前列腺炎患者前列腺液的NGF浓度与患者的NIH-CPSI的疼痛评分成正相关,而NGF是一种炎症痛觉过敏的关键因子[11]。因此,作者推测NGF与TRPV1在慢性前列腺炎疼痛起重要作用。
CFA常用于制作疼痛模型,其原理是以结核杆菌等复合物作为抗原的迟发性过敏反应或自身免疫性疾病,急性期主要为炎症性痛,慢性期主要为神经源性痛[4]。本实验通过大鼠前列腺注射CFA制作慢性前列腺炎疼痛模型,发现腰骶段DRG神经元NGF的表达在7d达到高峰,14d时表达有所下降;而TRPV1在7d和14d呈现持续高表达。作者前期工作发现,前列腺注射CFA,前列腺炎症反应在7d时较为明显,但在14 d时炎症反应明显减轻[12],从而说明NGF表达随前列腺炎症消退而降低,但TRPV1表达并不随前列腺炎症的消退而降低,TRPV1持续的高表达与慢性前列腺炎疼痛的维持与泛化密切相关。Amaya等[8]发现炎症反应时,DRG的NGF表达增加可以引起TRPV1表达增加,并进一步引起痛觉过敏。因此推测,慢性前列腺炎患者的前列腺液NGF浓度增加[10],激活初级感觉神经元外周末端Aδ和C纤维,信息上传至DRG,上调DRG神经元TRPV1表达,开放离子通道,通过DRG会聚神经元轴突反射引起跨器官痛觉致敏,但NGF和TRPV1在DRG的信号传递通路尚需进一步研究。
[1] Malykhina AP.Neural mechanisms of pelvic organ crosssensitization[J].Neuroscience,2007,149(3):660-672.
[2] Peng HY,Chang HM,Lee SD.TRPV1mediates the uterine capsaicin-induced NMDA NR2B-dependent cross-organ reflex sensitization in anesthetized rats[J].Am J Physiol Renal Physiol,2008,295(5):1324-1335.
[3] 陈勇,吴小候,秦潮.盆腔内跨器官痛觉致敏产生机制的研究进展[J].生理科学进展,2010,41(1):65-68.
[4] 唐伟,宋波,卢根生,等.树酯毒素抑制大鼠前列腺炎神经肽表达的实验研究[J].第三军医大学学报,2006,28(24):2456-2458.
[5] Michele PM.Chronic prostatitis syndrome:a common,but poorly understood condition[J].Updates Series,2007(5):1-15.
[6] Peng HY,Chen GD,Tung KC,et al.Colon mustard oil instillation induced cross-organ reflex sensitization on the pelvic-urethra reflex activity in rats[J].Pain,2009,142(1):75-88.
[7] Chen Y,Song B,Jin XY,et al.Possible mechanism of referred pain in the perineum and pelvis associated with the prostate in rats[J].J Urol,2005,174(6):2405-2408.
[8] Amaya F,Shimosato G,Nagano M,et al.NGF and GDNF differentially regulate TRPV1expression that contributes to development of inflammatory thermal hyperalgesia[J].Eur J Neurol,2004,20(9):2303-2310.
[9] Stein RJ,Santos S,Nagatomi J,et al.Cool(TRPM8)and hot(TRPV1)receptors in the bladder and male genital tract[J].J Urol,2004,172(3):1175-118.
[10]Miller LJ,Fischer KA,Goralnick SJ,et al.Nerve growth factor and chronic prostatitis/chronic pelvic pain syndrome[J].Urology,2002,59(4):603-608.
[11]Ji RR,Samad TA,Jin SX,et al.p38MAPK activation by NGF in primary sensory neurons after inflammation increases TRPV1levels and maintains heat hyperalgesia[J].Neuron,2002,36(1):57-68.
[12]Chen Y,Wu XH,Liu J,et al.Distribution of convergent afferents innervating bladder and prostate at dorsal root ganglia in rats[J].Urology,2010,76(3):764e1-764e6.
