羧化单壁碳纳米管/二茂铁/离子液体复合电极对叶酸的电催化研究
2012-10-10马建国谢冬香毛燕妮张麟熹朱朝俞
马建国, 谢冬香, 毛燕妮, 张麟熹, 朱朝俞
(1.东华理工大学放射性地质与勘探技术国防重点学科实验室,江西 抚州 344000;2.核资源与环境教育部重点实验室,江西 抚州 344000)
叶酸是由喋啶,对氨基苯甲酸和谷氨酸残基组成的一种水溶性B族维生素,亦称为维生素BC或维生素M。其为机体细胞生长和繁殖所必需的物质,有助于蛋白质的代谢,并能与维生素B12共同作用促进红细胞的生成和成熟,是制造红血球不可缺少的物质。此外,研究还发现,孕妇经常补充叶酸,可防止新生儿体重过轻、早产以及婴儿腭裂(兔唇)等先天性畸形(刘志诚等,1993)。目前测定叶酸的方法主要有荧光分光光度法(安会梅等,2007)、流动注射化学发光法(蔡卓等,2009)等,但电化学法测定叶酸鲜有报道(Kalimuthu et al.,2009)。
离子液体是指由有机阳离子和阴离子构成的在室温下呈液态的盐类化合物。它具有常规溶液所不能比拟的优点,如蒸气压极小、不挥发、不可燃、毒性小,能够溶解多种有机物无机物和聚合物,导电性好,具有较宽的电化学窗口等,而且它还可以通过改变组成比例调节自身的酸性和其它物理化学性质(Dhanusuraman et al.,2009;邓友全,2006;Chiappe et al.,2005)。这一系列特点对于其用于构建电化学生物传感器具有良好的前景。
单壁碳纳米管(SWCNTs)可促进某些电活性物质和电极间的电子转移,增强某些反应的电催化活性,但由于单壁碳纳米管在水溶液中的分散性差,使其应用受到限制。为了改善单壁碳纳米管的分散性,可通过适当的化学方法对其进行改性。而羧基由于亲水性较好,在碳管表面接枝羧基既可以增加碳纳米管的溶解性和分散性,而且羧基作为吸电子基团,有助于增强碳纳米管的导电能力(Wang et al.,2005;张刚等,2001)。目前,针对改性碳纳米管和二茂铁(Fc)复合修饰电极的研究较为少见。
本文结合离子液体、碳纳米管和二茂铁各自的特点,利用合成的羧化单壁碳纳米管,离子液体和二茂铁的复合产物对玻碳电极进行改性,以制备离子液体-羧化单壁碳纳米管-二茂铁复合膜修饰电极,通过循环伏安法研究该修饰电极在不同条件下对叶酸的电催化作用,为其检测建立一种新型的测定方法和技术,并为其它生物分子的测定与表征开辟一条新思路。
1 实验部分
1.1 主要仪器与试剂
CHI660D电化学工作站(上海辰华仪器公司),三电极体系:玻碳电极为工作电极,饱和甘汞电极(SCE)为参比电极,铂片电极为辅助电极;UV-2550PC型紫外-可见分光光度计(日本岛津公司),在室温下以三氯甲烷作为溶剂进行测试;5700型傅立叶变换红外光谱仪(美国Nicolet公司),仪器主要指标:光谱范围 7 800~350 cm-1,分辨率为0.09 cm-1,快速扫描 65次/s,在 KBr压片上制样,测定透射光谱。
叶酸(上海化学试剂一厂)标准储备液:将0.022 1 g叶酸溶于50 mL 0.1 mol/L的磷酸缓冲溶液(PBS)中,配成1.00 ×10-4mol/L 的储备液(5℃冷藏,待用);二茂铁(广东西陇化工厂);单壁碳纳米管(中国科学院成都有机化学研究所)使用前按Chiang等(2001)进行纯化;离子液体按照Paulo等(1996)制备;PBS溶液由磷酸二氢钾溶液(0.1 mol/L)与磷酸氢二钾溶液(0.1 mol/L)配制而成,实验用水均为二次蒸馏水,所用试剂均为分析纯。
1.2 实验方法
(1)SWCNTs的羧化(D'Este et al.,2006)。将500 mg纯化后的 SWCNTs置于250 mL的浓H2SO4/70%HNO3=3/1混合溶液中,在室温下超声1 min,然后加入浓盐酸,继续超声15 min,得到羧化的单壁碳纳米管。将产物依次用氢氧化钠溶液和大量的去离子水洗至中性,用0.2 μm的滤膜过滤收集固体产物,并将产物在70℃下真空干燥24 h。
(2)修饰电极的制备。将玻碳电极依次用金相砂纸和颗粒直径为50 nm的Al2O3粉末打磨、抛光。然后再分别用1 mol/L硝酸、蒸馏水、无水乙醇超声清洗各15 min。再用蒸馏水冲洗干净,室温下自然晾干,备用。
取[BMIm]PF6离子液体5 mL置于25 mL烧杯里,加入适量的二茂铁和羧化单壁碳纳米管5 mg,搅拌均匀后超声,使溶液成均一的悬浊液,用10 μL微量进样器取该混合溶液滴涂于处理后的玻碳电极表面,再置于红外灯下烘干,待用。
(3)叶酸的测定。通过试验获得修饰电极的最佳实验条件后,分别取30 mL不同浓度的叶酸标准储备液置于50 mL烧杯中,缓慢通入氮气,然后以修饰电极为工作电极,将CHI660D电化学工作站中的三电极体系置于烧杯中,静置溶液体系,在-0.2~1.0 V电位范围内测定叶酸的浓度。
2 结果与讨论
2.1 羧化碳纳米管的表征
由于本实验中的单壁碳纳米管在羧化过程中要尽量保持碳管的导电性能不被破坏,所以在超声处理时控制时间约为1 h。羧化后的产物经过红外谱图和紫外-可见光谱图表征,结果见图1所示。由图1(A)红外谱图可以看出,与纯化SWCNTs(a)相比,羧化后的单壁碳纳米管在波数为2 916 cm-1的位置有一个较为明显的—COOH伸缩振动峰。而在波数为1 760 cm-1的位置处则有一个不太明显的C=O伸缩振动峰,这可能是因为羧化的程度不高导致的。紫外-可见光吸收光谱表征可以说明碳管修饰前后的表面变化。变化的量度主要是通过范霍夫规整度进行比较。因为修饰前的单壁碳纳米管的表面的大量物质结构都会产生相应的吸收光谱峰,被称之为范霍夫奇点。碳管修饰后,将导致表面大量范霍夫奇点消失,即紫外吸收峰减少(Bahr et al.,2002)。这种表面结构上的变化表明碳管表面的π键体系因发生了共价键改性而被破坏,从而减少了范霍夫奇点。图1(B)的紫外-可见光吸收谱图显示羧化前后的单壁碳纳米管的吸收曲线发生明显变化。其中羧化前的碳纳米管的紫外吸收曲线在370,480,550,650 nm 左右均出现了明显的宽吸收峰,而羧化后的碳管在这些位置的吸收峰均消失了,吸收曲线在300~800 nm之间变的较为平滑。通过以上表征结果说明SWCNTs的羧化是成功的。
2.2 电化学实验条件的选择
2.2.1 缓冲溶液的选择
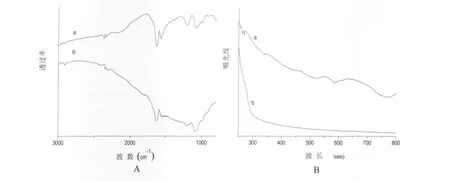
图1 纯化单壁碳纳米管和羧化单壁碳纳米管的红外谱图(A)和紫外-可见光谱图(B)Fig.1 The IR(A)and UV-vis(B)spectrum of the purified SWCNTs and carboxylic SWCNTs
考察了5.0×10-5mol/L叶酸在不同的缓冲溶液Na2HPO4-C6H8O7·H2O,NaH2PO4-NaOH,C6H8O7·H2O-Na3C6H5O7·2H2O和PBS中[BMIM]PF6/SWCNTs—COOH/Fc修饰电极的电化学行为。结果表明,叶酸在上述这几种溶液中都出现氧化还原峰,其中在PBS缓冲溶液中的峰形最好,氧化还原电流最大。同时,在pH值范围3.0~8.0内的PBS溶液中,对浓度为5.0×10-5mol/L的叶酸溶液进行循环扫描,发现氧化还原峰电流随pH值增加而增大,当pH=6.8时达到最大,随后其值又随着pH值的增加而降低。所以实验选择在pH=6.8的PBS缓冲溶液中检测叶酸。
2.2.2 扫速的选择
扫描速率反映了电极表面的电化学反应机理。图2是在5.0×10-5mol/L叶酸溶液中,扫描速率在0.05 ~0.4 V/s范围内,[BMIm]PF6/SWCNTs—COOH/Fc修饰电极的循环伏安曲线。由图可知,随着扫速的增大,ipa与ipc均变大,峰电位差ΔEp也随之增大。这是因为扫描速率越高,峰所对应的电化学反应速率越高,峰电流也越大。实验证明,在0.05~0.4 V/s扫速范围内,电极的氧化峰电流与扫速平方根成良好的线性关系(图2),线性关系式为:ipa= -27.828 ×10-5VI/2+1.074 2 ×10-5,其中相关系数R=0.997 8。这说明叶酸在该修饰电极上的电化学反应是受扩散电流控制的(董绍俊等,2003)。而且由图2可以看出,峰电流随扫速增大而增大,但是为避免扫速过高带来的充电电流过大对测定造成影响,降低信噪比。经过试验发现,选择扫速0.15 V/s为宜。
2.3 不同修饰电极的电催化能力比较
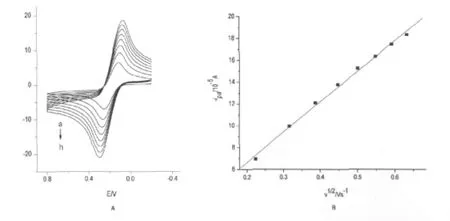
图2 不同扫描速率的叶酸循环伏安法曲线(A)和氧化峰电流与扫速平方根关系图(B)Fig.2 Cyclic voltammograms of FA at modified electrode with different scan rates(A)and relationship between oxidation peak current and scan rate(B)
用循环伏安测定在前面讨论得到的最佳实验条件下研究了不同组分的修饰电极对叶酸氧化峰电流的影响,如图3所示。结果显示在pH=6.8的PBS 中,当扫描速率为0.15 V/s时,5.0 ×10-5mol/L叶酸不同电极上的循环伏安图存在较大差异。其中叶酸在[BMIm]PF6/SWCNTs—COOH/Fc复合膜修饰电极作用下,峰电流增大最为显著。这是因为羧基亲水性好,用它改性单壁碳纳米管可以增加碳纳米管的亲水性,使碳纳米管分散性更好,而且羧基是吸电子基,所以羧基改性碳纳米管的导电能力增强。这些都说明了复合膜修饰后的玻碳电极能够促进叶酸在电极表面的电子传递速率,对叶酸具有很好的电催化作用。
2.4 样品浓度对测试的影响及电极稳定性实验
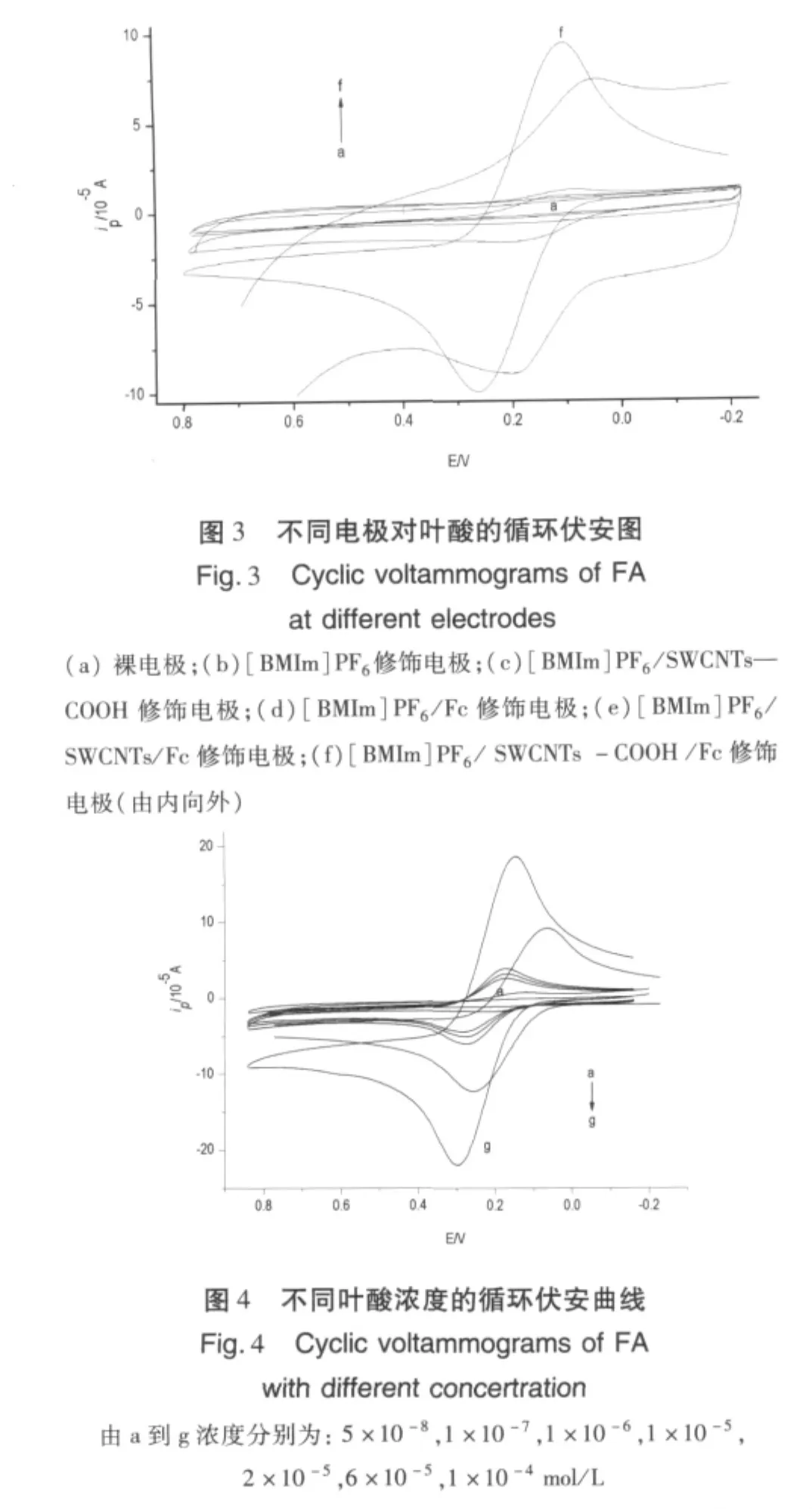
为比较不同浓度叶酸中修饰电极的电化学行为,试验了[BMIm]PF6/SWCNTs—COOH/Fc修饰电极在浓度分别为5 ×10-8,1 ×10-7,1 ×10-6,1 ×10-5,2 ×10-5,6 ×10-5,1 ×10-4mol/L 的叶酸溶液中的循环伏安曲线,研究结果见图4。由图可知,氧化峰电流ipa、ipc随着叶酸的浓度降低而降低,当叶酸浓度达到5×10-8mol/L时,几乎没有氧化还原峰出现。叶酸氧化峰电流与其浓度在0.1~60 μmol/L范围内呈良好线性关系,线性方程为:ipa=-1.3965C -1.6172,相关系数 R=0.9962,且叶酸在修饰电极上的检出限为8.6×10-8mol/L。
另外,在5.0×10-5mol/L叶酸溶液中,我们用同一支电极连续测定10次,对叶酸的电流响应变化很小。将电极在空气中放置10 d后,对叶酸的电流响应减小9.6%,表明该修饰电极具有良好的重现性和稳定性。
2.5 干扰实验
在pH=6.8的PBS缓冲溶液中,固定叶酸的浓度为5.0×10-5mol/L,考察一些常见的物质对叶酸的电化学检测的干扰情况。实验结果表明:当叶酸的浓度为5.0×10-5mol/L时,与之共存的一些常见无机离子(如Na+,NH4+,Zn2+,Fe3+,Cu2+,Cl-,SO42-)以及相同浓度的 VB2,VB12葡萄糖、柠檬酸、蔗糖等有机物均不干扰测定。
2.6 样品回收实验
在最佳实验条件下,本实验取实际叶酸片剂作为测试样品(每片的叶酸含量为5 mg),经研钵粉碎后,按照不同比例溶解在PBS中,并在250 mL容量瓶中稀释、定容、摇匀。分别得到系列浓度的叶酸样品溶液。在最佳实验条件下,采用加标回收法通过[BMIm]PF6/SWCNTs—COOH/Fc膜修饰电极测定叶酸的回收率,得到回收率为97.47% ~101.26%,实验效果较好,具体结果见表1。
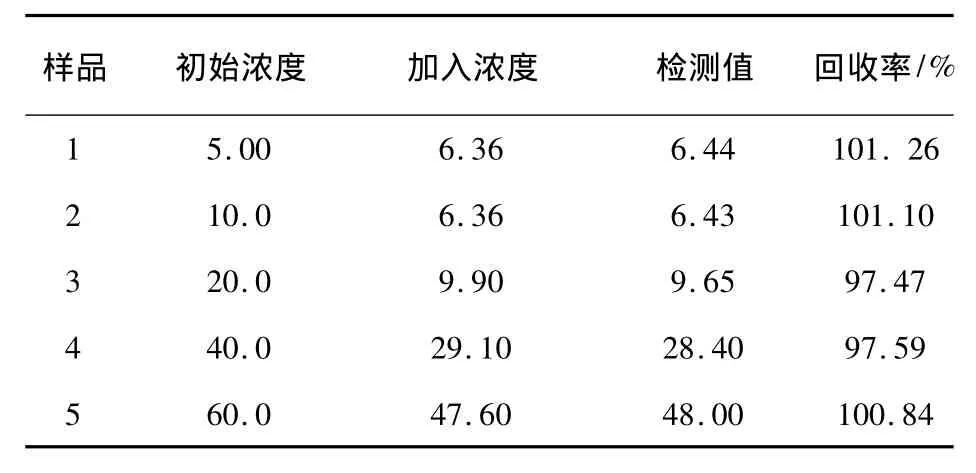
表1 叶酸加标回收率Table1 Recovery of FA in standard solution(10-7mol/L)
3 结论
本文采用滴涂法制备的[BMIm]PF6/SWCNTs—COOH/Fc复合膜修饰电极在 pH=6.8的PBS缓冲溶液中,0.15 V/s的扫描速率下的电化学行为是受扩散控制的氧化-还原过程。实验证明它对叶酸具有很好的电催化氧化作用,并且灵敏度高、重现性好、稳定性高、检出限较低,可以用于实际样品的检测。该方法也为新型生物化学传感器的研制奠定了基础。
安会梅,贾蕊,朱若华.2007.荧光分光光度法测定奶粉及尿液中叶酸——基于同时高锰酸钾氧化及光化学反应[J].理化检验:化学分册,43(10):870-872.
蔡卓,江彩英,赵静等.2009.铈(Ⅳ)-亚硫酸钠体系流动注射化学发光法测定叶酸[J].化学研究与应用,12(3):370-372.
邓友全.2006.离子液体—性质、制备与应用[M].北京:中国石化出版社:48-55.
董绍俊,车广礼,谢远武.2003.化学修饰电极[M].北京:科学出版社:158-164.
刘志诚,于守洋.1993.营养与食品卫生学[M].北京:人民教育出版社:75-78.
张刚,段文晖,倪军,等.2001.几种纳米管的电子性质[J].材料研究学报,15(1):138-140.
Bahr J L,Tour J M.2002.Covalent chemistry of single-wall carbon nanotubes[J].J.Mater.Chem.12(7):1952-1958.
Chiang I W,Brinson B E,Huang A Y,et al.2001.Purification and Characterization of Single-Wall Carbon Nanotubes(SWNTs)Obtained from the Gas-Phase Decomposition of CO(HiPco Process)[J].J.Phys.Chem.B,105(35):8297-8301.
Chiappe C,Pieraccini D.2005.Ionic liquid:solvent properties and organic reactivity[J].J.Phys.Org.Chem,18(4),275-297.
D'Este M,Nardi M D,Menna E.2006.co-functionalization approach to soluble and functional single-walled carbon nanotubes[J].Eur.J.Org.Chem,11:2517-2522.
Dhanusuraman Ragupathy,Anantha Iyengar Gopalan,Kwang-Pill Lee.2009.Synergistic contributions of multiwall carbon nanotubes and gold nanoparticles in a chitosan-ionic liquid matrix towards improved performance for a glucose sensor[J].Electrochem.Commu,11(2):397-401.
Kalimuthu P,John S A.2009.Selective electrochemical sensor for folic acid at physiological pH using ultrathin electropolymerized film of functionalized thiadiazole modified glassy carbon electrode[J].Biosensors and Bioelectronics,24(12):3575-3579.
Paulo A Z Suarez,Jeane E L Dullius,Sandra Einloft,et al.1996.The use of new ionic liquids in two-phase catalytic hydrogenation reaction by rhodium complexes[J].Polyhedron,15(7):1217-1222.
Wang Yubing,Iqbal Zafar,Malhotra V Sanjay.2005.Functionalization of carbon nanotubes with amines and enzymes[J].Chem.Phys.Lett,402(1):96-101.
