缺氧诱导因子-1α对脂多糖所致心肌细胞线粒体功能损伤的影响
2012-09-28杨乐邹晓静
杨乐 邹晓静


【摘要】目的 探讨心肌细胞缺氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α)对脂多糖(lipopolysaccharide, LPS)诱导心肌细胞线粒体功能损伤的影响。方法 培养新生乳鼠心肌细胞,随机(随机数字法)分为4组。① C组:常规心肌细胞培养,不予任何处理;②LPS组:给予1μg/ml LPS,培养2 h;③YC-1+LPS组:预给HIF-1α特异性抑制剂YC-1 4 μmol/L培养8 h,再加入1μg/ml LPS,培养2 h;④YC-1组:仅给予4 μmol/L YC-1培养8h。利用荧光分光光度计测定线粒体膜电位(mitochondrial membrane potential, MMP) ,荧光素酶法测定细胞ATP含量,比色法测定细胞色素C氧化酶(cytochrome c oxidase, COX)活性,Western blot测定细胞色素氧化酶亚单位1,2的蛋白表达水平。结果 与C组相比,LPS显著抑制心肌细胞MMP、COX活性,ATP含量也显著降低(P<0.05),并抑制COX-1蛋白表达(P<0.05),上调COX-2蛋白表达(P<0.05)。与LPS组相比,HIF-1α抑制剂YC-1能进一步降低心肌细胞MMP、COX活性及ATP含量(P<0.01),显著增加COX-1表达并使COX-2表达的下调(P<0.01)。结论 HIF-1α抑制剂YC-1可能通过改变COX-1及COX-2表达,加重LPS所致的心肌细胞线粒体功能的损伤,提示HIF-1α对LPS诱导的心肌细胞线粒体损伤可能具有保护作用。
【关键词】脂多糖;缺氧诱导因子-1α;心肌细胞;线粒体
Effects of HIF-1α on mitochondrial function of cardiomyocytes stimulated by lipopolysaccharideYANG Le, ZOU Xiao-jing* . *Department of Anesthesiology, Union Hospital of Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430022, China
Corresponding author: ZOU Xiao-jing, Email: xjzou68@yahoo.com
【Abstract】Objective To investigate the effects of HIF-1α, on mitochondrial function of cardiomyocytes stimulated by lipopolysaccharide (LPS). Methods Cultured neonatal cardiomyocytes were randomly (random number) distributed to four groups (n=5). Control group: the neonatal cardiomyocytes were cultured in normal condition without any treatmeat; LPS group: cardiomyocytes were exposed to 1μg/ml LPS for 2 h; YC-1+LPS group: cardiomyocytes were exposed to 4 μmol/L YC-1 for 8 h before LPS treatment; YC-1 group: cardiomyocytes were exposed to 4μmol/L YC-1 for 8 h. As indexes of mitochondrial function, MMP, the content of ATP and the activity of cytochrome oxidase were measured, COX1/2 protein expression was determined by Western blotting. Results Compared with control group, LPS decreased MMP, the content of ATP and the activity of COX obviously(P<0.05), depressed the expression of COX-1 protein (P<0.05), induced the expression of COX-2 protein (P<0.05). Compared with the LPS group, MMP, the content of ATP and the activity of COX were markedly attenuated (P<0.01), the expression of COX-1 was significantly increased and the expression of COX-2 was decreased in theYC-1+LPS group (P<0.01).Conclusions YC-1 attributes to the dysfunction of mitochondrial of myocyte by alterating the expression of COX-1 and 2, HIF-1α may attenuate the mitochondrial dysfunction of cadiomyocytes stimulated by LPS.
【Key words】Lipopolysaccharide; Hypoxia inducible factor-1α; Cardiomyocyte; Mitochondrial
脓毒症是感染所致的全身炎症反应综合征,是多器官功能障碍的重要原因[1]。脓毒症患者通常伴有心功能障碍,包括收缩性和舒张性功能障碍,有研究表明脓毒症大鼠心肌出现力学和酶学双重改变[2-3]。目前研究认为脓毒症心肌抑制可能与线粒体呼吸功能障碍及氧化磷酸化功能受损有关[4]。本课题组前期实验发现,脂多糖(LPS)可诱导原代培养乳鼠心肌细胞缺氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α)表达明显上调,但HIF-1α与脓毒症心肌抑制的关系尚未可知。HIF-1α可调控与线粒体分子氧利用有关的多个代谢途径,本实验拟建立脓毒症心肌抑制的细胞模型,利用HIF-1α抑制剂YC-1研究HIF-1α对脓毒症心肌细胞线粒体功能的影响。
1 材料与方法
1.1 试剂
LPS购自sigma公司,3-(5'-Hydroxymethyl-2'-furyl)-1-benzylindazoh (YC-1) 购自美国Alexis公司,线粒体膜电位检测试剂盒(JC-1)及ATP检测试剂盒购自上海碧云天生物技术有限公司,细胞色素C氧化酶检测试剂盒购自上海杰美基因医药科技有限公司,羊抗COX-1多克隆抗体及羊抗COX-2多克隆抗体购自Santa Cruz公司。
1.2 心肌细胞培养
健康新生1~2 d Wistar大鼠,清洁级,雌雄不拘,5~10 g,由华中科技大学同济医学院实验动物中心提供,碘伏消毒,取出心脏于4 ℃无菌D-Hanks液洗净残血,剔除心房及心底大血管,将心室肌剪成1 mm×1 mm×1 mm组织块,用0.1%胰酶于37 ℃水浴振荡分次消化5~8次,每次8 min。收集除第1次外的细胞悬液,1 000 r/min 离心8 min,弃上清,用含10%胎牛血清的DMEM高糖培养基重悬细胞至培养瓶。37 ℃,5% CO2培养箱中,静置90 min差速贴壁后,取上清,加入终浓度为0.1 mmol/L 5-溴脱氧尿苷,培养48 h后换无血清DMEM高糖培养基培养24 h后进行实验。
1.3 实验分组及药物干预
实验随机分为4组。① 健康对照组:常规心肌细胞培养,不予任何处理;②LPS组:给予1 μg/ml LPS,培养2 h;③LPS+YC-1组:预给HIF-1α特异性抑制剂YC-1 4 μmol/L培养8 h组[5-6],再加入1 μg/ml LPS,培养2 h;④YC-1组:仅给予4 μmol/L YC-1培养8 h组。
1.4 线粒体制备
采用蔗糖梯度离心法[7]提取线粒体。0.25%胰酶消化原代培养心肌细胞,1 000 r/min离心收集细胞。用缓冲液A(134 mmol/L NaCl, 5 mmol/L KCl, 0.7 mmol/L Na2HPO4, 10 mmol/L Tris,pH 7.5)清洗后,重悬于1.5 ml缓冲液B(10 mmol/L NaCl,1.5 mmol/L CaCl2,10 mmol/L Tris,pH 7.5),冰上放置5 min后转入玻璃匀浆器匀浆,然后立即加入0.3 ml 缓冲液C(2 mol/L 蔗糖,35 mmol/L EDTA,50 mmol/L Tris,pH 7.5 )混匀,3000 r/min 离心4 min,取上清于14 000 r/min 离心20 min,所得沉淀为线粒体组分。缓冲液D (0.21 mol/L 甘露醇,70 mmol/L 蔗糖,5 mmol/L Tris,5 mmol/L EDTA,pH 7.5)清洗2次得到線粒体。上述所有缓冲液均在冰浴条件下使用。蛋白定量:应用考马斯亮兰法,采用美国PE公司生产的多孔板(荧光、紫外线、可见光)高效分析仪(型号:HTS 7000 Plus),加入线粒体提取液,在波长595 nm测定吸光度后计算蛋白质含量。以上操作均在0~2 ℃进行,分离介质始终保持有冰渣状态。
1.5 线粒体膜电位检测
采用JC-1荧光探针检测。JC-1是一种能渗透到细胞器内并特异性与细胞中线粒体结合的荧光染剂。在线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成聚合物产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体产生绿色荧光。0.25%胰酶消化细胞,1000 r/min离心收集细胞。加入无Ca2+、Mg2+的PBS缓冲液漂洗2遍,加入1 ml PBS缓冲液,再将1 g/L JC-1加入,使之终浓度为1.5 mg/L,37 ℃负载15 min,1000 r/min离心5 min后去除JC-1,PBS洗3遍后用荧光分光光度计检测。检测JC-1单体时即绿色荧光时可以把激发光设置为490 nm,发射光设置为530 nm;检测JC-1聚合物即红色荧光时,可以把激发光设置为525 nm,发射光设置为590 nm。计算红绿荧光比值,比值与MMP成正比。
1.6 荧光素酶ADP/ATP发光检测
取1×106细胞,加入1 ml裂解液后匀浆。4 ℃ 12 000 r/min离心10 min,保留上清。冰浴上溶解待用试剂,ATP标准溶液稀释成0.001 μmol/L、0.01 μmol/L、0.1μmol/L、1μmol/L和10μmol/L 5个浓度。按照1∶100的比例用ATP检测试剂稀释液稀释ATP检测试剂。在检测孔或检测管内加上10 μl样品或标准品,迅速混匀,间隔6 s后立即用液闪仪测定相对发光强度值。根据标准曲线计算出样品中ATP的浓度。各组蛋白定量,把ATP的浓度换算成nmol/mg蛋白的形式。
1.7 细胞色素C氧化酶活性测定
基于还原型细胞色素C转化为氧化型细胞色素C的变化来测定COX的活性。参照说明书采用比色法测定酶活性(μmol/mg)。酶活性单位定义为25 ℃,pH 7.0时,每单位酶在单位时间内氧化1 μmol细胞色素C所需要的酶量,即为1个酶活性单位。
1.8 COX亚单位1,2(COX-1,2)蛋白表达测定
用TRI reagent提取各组细胞蛋白质。取蛋白质20 μg以10%SDS-PAGE电泳分离;半干电转移蛋白到PVDF膜,5%牛血清白蛋白封闭,加一抗羊抗COX-1(1∶ 500),羊抗COX-2(1∶ 500)及兔抗α-actin(1∶ 500)4℃孵育过夜。洗涤后加入二抗(HRP标记的羊抗兔IgG)室温孵育1 h。洗涤后,显色剂ECL曝光,显影,定影。以 -actin为内参照。对结果进行吸光度扫描分析,以ACOX-1/A -actin及ACOX-2/A-actin表示蛋白的相对表达量。
1.9 统计学方法
数据采用均数±标准差(x±s)表示,采用SPSS 13.0统计软件,多组间资料比较采用单因素方差分析(One-Way ANOVA)检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 心肌细胞MMP、COX活性及ATP的变化
与对照组相比,LPS显著抑制心肌细胞MMP、COX活性及ATP含量(P<0.05),YC-1可显著增强LPS对心肌细胞的这种效应,即与LPS组相比近一步抑制MMP、COX活性及ATP含量(P<0.01)。见表1。
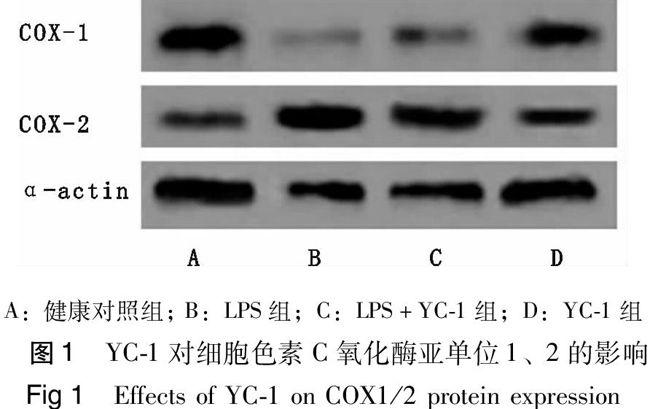
2.2 YC-1对线粒体COX亚单位表达的影响
如图1、表2所示,与健康对照组相比,LPS显著抑制COX-1蛋白表达(P<0.05),上调COX-2蛋白表达(P<0.05)。与LPS组相比,预先给予YC-1可显著升高COX-1蛋白表达,降低COX-2蛋白表达(P<0.01)。
3 讨论
本课题组的前期工作发现LPS诱导原代培养乳鼠心肌细胞HIF-1α蛋白表达显著上调。作为一种对氧气敏感的转录因子超家族,HIF-1α主要负责众多的低氧诱导基因的表达调控,与一系列的细胞效应如线粒体活性氧的产生,能量代谢,血管发生等密切相关。目前认为HIF-1α对细胞缺血缺氧性损伤具有保护效应[8-9]。LPS导致心肌损伤,心功能障碍与LPS诱导心肌细胞氧化应激密切相关[10],HIF-1α作为氧调控信息通路中的重要因子,对LPS诱导的心肌细胞损伤是否也具有心肌保护作用?YC-1是一种新型HIF-1α抑制剂,通过使HIF-1α的C末端激活区失活而对其发挥翻译后水平的抑制[11]。本实验通过观察HIF-1α抑制剂YC-1对线粒体功能的影响来探讨HIF-1α在LPS诱导的心肌细胞损伤中的可能作用。
线粒体功能障碍是脓毒症心肌抑制的关键环节[12],主要表现为线粒体呼吸功能障碍,细胞无法有效利用氧分子而导致细胞性低氧状态,并且ATP合成下降无法满足心肌能量代谢需求[4]。MMP、ATP含量及COX活性是评价线粒体功能的重要指标。由于线粒体内膜两侧质子及其他离子不对称分布而形成MMP,其对维持线粒体内膜对各种物质的选择性与通透性及线粒体正常的形态结构与功能都具有重要作用,线粒体膜电位下降将导致线粒体功能严重受损。本研究中,LPS使心肌细胞MMP显著下降,同时伴有COX活性降低及ATP含量下降,在LPS作用的新生乳鼠心肌细胞上再次验证了脓毒症心肌细胞线粒体功能受损。COX存在于线粒体内膜,是线粒体氧化呼吸产能和呼吸链电子传递的限速酶。COX作为线粒体呼吸链的终端酶,构成电子传递链的重要环节,催化其底物亚铁细胞色素C传递电子给氧分子形成水,并与氧化磷酸化偶联产生ATP为细胞功能活动提供能量,故被视为线粒体呼吸链的标志酶,其活性的丧失意味着呼吸电子链的中断及氧分子利用障碍,导致三磷酸腺苷(ATP)生成不足[13]。在本實验结果中,LPS抑制COX活性,减少ATP含量,提示LPS可至心肌细胞线粒体氧化磷酸化功能受损,导致心肌细胞能量代谢障碍。而与LPS组相比,YC-1则进一步降低MMP,抑制COX的活性,减少ATP的合成,提示HIF-1α与COX酶活性关系密切。在LPS诱导的脓毒症心肌损伤中,诱导HIF-1α表达可能通过调节COX酶活性发挥细胞保护作用。
LPS可显著抑制COX-1蛋白表达同时诱导COX-2蛋白表达上调,而HIF-1α抑制剂YC-1则显著抑制了LPS作用下心肌细胞COX亚单位表达的变化。COX有13个亚单位,3个催化亚单位,10个结构亚单位。结构亚单位由核DNA编码,催化亚单位COX-1,COX-2和COX-3由线粒体DNA编码,在真核细胞中遗传高度保守。在哺乳动物细胞COX-1呈优势表达,在某些组织可选择性表达COX-2。COX-1与COX-2一起构成COX的活性中心[14],是调控线粒体氧化调节能力的关键所在。利用盲肠结扎穿孔的脓毒症动物模型研究发现,脓毒症心肌组织COX活性丧失,其亚单位COX-1的mRNA及蛋白水平显著下降,给予外源性细胞色素C可改善脓毒症小鼠的心室功能[15],结果与本实验一致。LPS可能通过影响COX活性中心的COX1/2蛋白表达而抑制COX活性。研究证明,低氧条件下HIF-1α活化,它与定位于COX-2基因第一个内含子的5区的低氧反应元件结合,诱导COX-2 mRNA表达上调,并上调线粒体蛋白酶LON以加速COX-1蛋白的降解,通过改变COX-1/2蛋白表达比例以增加电子传递速度,加快COX更新,优化线粒体呼吸链功能,增加ATP合成[16]。本研究结果提示,在LPS诱导的心肌细胞损伤中,HIF-1α可能通过调节COX-1/2的表达比例,提高COX活性,从而改善线粒体功能。
参考文献
[1] 岳茂兴. 脓毒症的临床救治 [J]. 中华急诊医学杂志, 2006,15(12):1151-1152.
[2] Kumar A, Haery C, Parrillo JE. Myocardial dysfunction in septic shock [J]. Crit Care Clin, 2000,16(2):251-287.
[3] 王国兴, 沈潞华, 谢苗荣, 等. 脓毒症时大鼠心脏的变化及血管紧张素转化酶抑制剂的保护作用 [J]. 中华急诊医学杂志, 2007,16(2):138-142.
[4] Levy RJ, Vijayasarathy C, Raj NR, et al. Competitive and noncompetitive inhibition of myocardial cytochrome C oxidase in sepsis [J]. Shock, 2004, 21(2):110-114.
[5] Chung JG, Yang JS, Huang LJ, et al. Proteomic approach to studying the cytotoxicity of YC-1 on U937 leukemia cells and antileukemia activity in orthotopic model of leukemia mice [J]. Proteomics, 2007, 7(18):3305-3317.
[6] Yeo EJ, Chun YS, Park JW. New anticancer strategies targeting HIF-1 [J]. Biochem Pharmacol, 2004, 68(6):1061-1069.
[7] Park JW, Youn YC, Kwon OS, et al. Protective effect of serotonin on 6-hydroxydopamine and dopamine-induced oxidative damage of brain mitochondria and synaptosomes and PC12 cells [J]. Neurochem Int, 2002, 40(3):223-233.
[8]Tekin D, Dursun AD, Xi L. Hypoxia inducible factor 1 (HIF-1) and cardioprotection [J]. Acta Pharmacol Sin, 2010, 31(9):1085-1094.
[9]刘庆新, 陈金波, 朱玉红, 等. 脑出血灶周缺氧诱导因子-1a表达与脑水肿的关系 [J]. 中华急诊医学杂志, 2007,16(9):921-924.
[10] Yuan H, Perry CN, Huang C, et al. LPS-induced autophagy is mediated by oxidative signaling in cardiomyocytes and is associated with cytoprotection [J]. Am J Physiol Heart Circ Physiol, 2009, 296(2): H470-H479.
[11] Feng Y, Zhu H, Ling T, et al. Effects of YC-1 targeting hypoxia-inducible factor 1 alpha in oesophageal squamous carcinoma cell line Eca109 cells [J]. Cell Biol Int, 2011,35(5):491-497.
[12]Flierl MA, Rittirsch D, Huber-Lang MS, et al. Molecular events in the cardiomyopathy of sepsis [J]. Mol Med, 2008,14(5/6):327-336.
[13] Simmons RA, Suponitsky-Kroyter I, Selak MA. Progressive accumulation of mitochondrial DNA mutations and decline in mitochondrial function lead to beta-cell failure [J]. J Biol Chem, 2005, 280(31):28785-28791.
[14]Pecina P, Houstkova H, Hansikova H, et al. Genetic defects of cytochrome c oxidase assembly [J]. Physiol Res, 2004,53 Suppl 1:S213-223.
[15] Levy RJ, Deutschman CS. Cytochrome C oxidase dysfunction in sepsis [J]. Crit Care Med, 2007, 35(9 Suppl):S468-S475.
[16] Fukuda R, Zhang H, Kim JW, et al. HIF-1 Regulates cytochrome xxidase subunits to optimize efficiency of respiration in hypoxic cells [J]. Cell, 2007, 129(1):111-122.
(收稿日期:2012-02-07)
(本文编辑:何小军)
DOI:10.3760/cma.j.issn.1671-0282.2012.08.009
基金项目:国家自然科学基金(30901405、81102691)
作者单位:430030 武汉,华中科技大学同济医学院附属同济医院急诊内科(杨乐);华中科技大学同济医学院附属协和医院麻醉科(邹晓静)
通信作者:邹晓静,Email:xjzou68@yahoo.com
中华急诊医学杂志2012年8月第21卷第8期Chin J Emerg Med,August 2012,Vol.21,No.8
P836-839
