硝化细菌去除氨气试验研究
2012-09-28周欢丽
周欢丽
(贵州省环境科学研究设计院,贵阳 550081)
随着公众环保意识的提高,人们对大气环境质量提出了越来越高的要求,只注重粉尘、二氧化硫和氮氧化物的大气污染防治研究已不能满足人们对空气质量的要求,一个新的污染问题——生活垃圾所产生的恶臭污染逐渐引起广泛重视,恶臭污染防治研究日益活跃[1-2]。
恶臭治理技术从最初的扩散稀释、水洗,发展到后来的吸附、焚烧、化学吸收,直至新兴的生物脱臭、光催化氧化、臭氧氧化、等离子体分解等除臭技术,不外乎借助于物理、化学、生物手段,或其联合工艺,通过稀释中和、吸收转化或生物降解等过程,使恶臭减轻或消除[3]。其中,利用微生物脱臭的研究集中在几个方面,一是应用亚硝化细菌处理生活污水中氨氮;二是采用固定化硝化细菌对收集的气态氨进行处理;三是采用复合微生物菌剂对生活垃圾的气态氨进行除臭处理,其总体代谢选择性和有效微生物的比例较低。为了提高对恶臭气体的生物处理效率,以及能就地处理生活垃圾,通过对模拟生活垃圾加入自己筛选、分离和纯化、培养的硝化细菌,进行除氨气脱臭实验。
1 硝化细菌降解氨氮的机理
自然界的硝化菌通过将氨氧化成亚硝酸盐和将亚硝酸盐氧化成硝酸盐,完成硝化作用。根据其利用的无机能源不同,分为两类亚群:亚硝化细菌和硝化细菌。
亚硝化细菌将氨氧化成亚硝酸盐的反应过程可概括为:
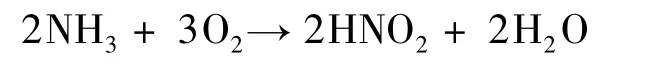
硝化细菌将亚硝酸氧化为硝酸盐,其氧化过程如下:
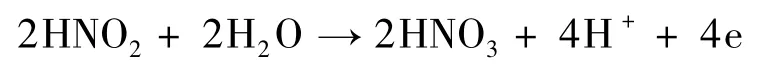
2 材料与方法
2.1 培养基
硝化细菌培养基:NaNO21 g,MgSO4·7H2O 0.03 g,MnSO4·4H2O 0.01 g,K2HPO40.75 g,Na2CO31 g,NaH2PO40.25 g,加蒸馏水至 1 000 mL,pH保持自然。固体培养基加5%琼脂。
亚硝化细菌培养基:(NH4)2SO42.0 g,NaH2PO40.25 g,MgSO4·7H2O 0.01 g,K2HPO40.75 g,MnSO4·4H2O 0.03 g,Ca2CO35.0 g,加蒸馏水至1 000 mL,pH保持自然。固体培养基加5%琼脂。
富集培养基:(NH4)2SO41 g,MgSO4·7H2O 0.5 g,NaCl0.5 g,FeSO4·7 H2O0.4 g,K2HPO40.5 g,NaHCO31.5 g,CaCl20.1 g,加蒸馏水至1 000 mL,pH保持自然。固体培养基加5%琼脂。
氨化细菌培养基:氨化细菌培养基:蛋白胨10 g,K2HPO41 g,FeSO40.001 g,MgSO40.5 g,NaCl 0.5 g,微量元素溶液1 mL,加蒸馏水至1 000 mL,用10%碳酸钠调 pH 为 7.2 ~7.4。
微量元素溶液:硼酸0.5 g,钼酸钠0.5 g溶于100 ml蒸馏水。
2.2 菌株分离与纯化
分别采集河水污泥、贵州大学(南区)动物科学学院实验楼旁的土壤、贵州大学(南区)奶牛场附近的土壤,分装于三个不同的灭菌袋中。
由于自然环境中硝化细菌的数量很少,为了提高分离效率,采用先富集培养再分离纯化的方法。将采集到的污泥和土壤稀释后,接入富集培养基中,使硝化细菌的数量从天然环境中劣势菌群转变为人工环境中的优势菌群[4],然后采用浓度梯度平板培养法从富集培养基液中分离菌株,再用平板划线培养进行纯化[5],并进行 Griess,s滴定检测,作革兰氏染色鉴定,在显微镜下(20×50)观察菌株形态,根据《伯杰氏细菌鉴定手册》(第九版)对菌株作初步鉴定。对所得氨化细菌进行奈氏试剂滴定检测。
2.3 除氨实验
将分离纯化的硝化细菌和氨化细菌分别接种到相应的液体培养基中培养3天,制作悬浮液,浓度分别为:1.2 ×108个/mL 和3.2 ×109个/mL。
取两只锥形瓶(一只作实验用,一只作对照组),上部悬挂一支称量盒,并做灭菌处理(图1)。将鸡蛋表面用75%酒精反复擦拭无菌处理,敲开蛋壳,倒入大三角瓶摇匀,然后加入制备好的氨化细菌和硝化细菌悬浮液,置于26℃的恒温培养箱中。称量盒内放入吸收液(0.01 mol/L的硫酸溶液),用于吸收瓶内的氨气。每隔6个小时对瓶内氨气含量进行一次检测:用移液枪吸取0.2 mL吸收液,加入到0.2 mL酒石酸钾钠溶液,摇匀,再加入0.2 mL的纳氏试剂,室温放置10 min左右,在波长为420 nm处扫描,记录吸光值,据所得标准曲线(R=0.999 6)计算氨含量[6]。对照组仅添加氨化细菌悬浮液。
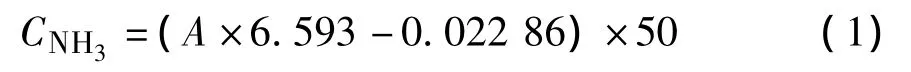
式中:CNH3——所取吸收液中氨含量,mg/L;
A——所取吸收液的吸光值。

图1 除氨实验示意
2.4 数据处理
本实验中得出的数据分析结果均采用SPSS V11.5软件完成t检验,P <0.05被认为是具有统计学意义的。
3 结果与分析
3.1 菌株鉴定
菌种的初步鉴定结论:从三株菌种的菌落形态、菌株形态和生理生化反应的实验结果(表1,图2),初步鉴定菌株X-D-4、X-D-5、X-D-10属硝化杆菌科(Nitrobacteriace)的硝化细菌群;菌株Y-D-1、Y-D-2、N-D-1属硝化杆菌科(Nitrobacteriace)的亚硝化细菌群。
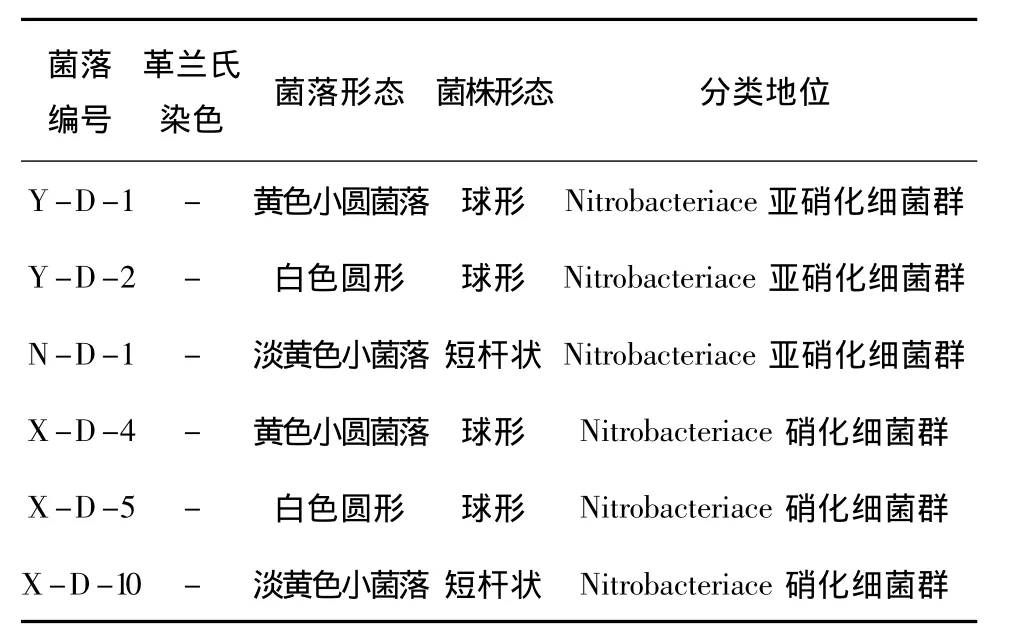
表1 菌株初步鉴定结果
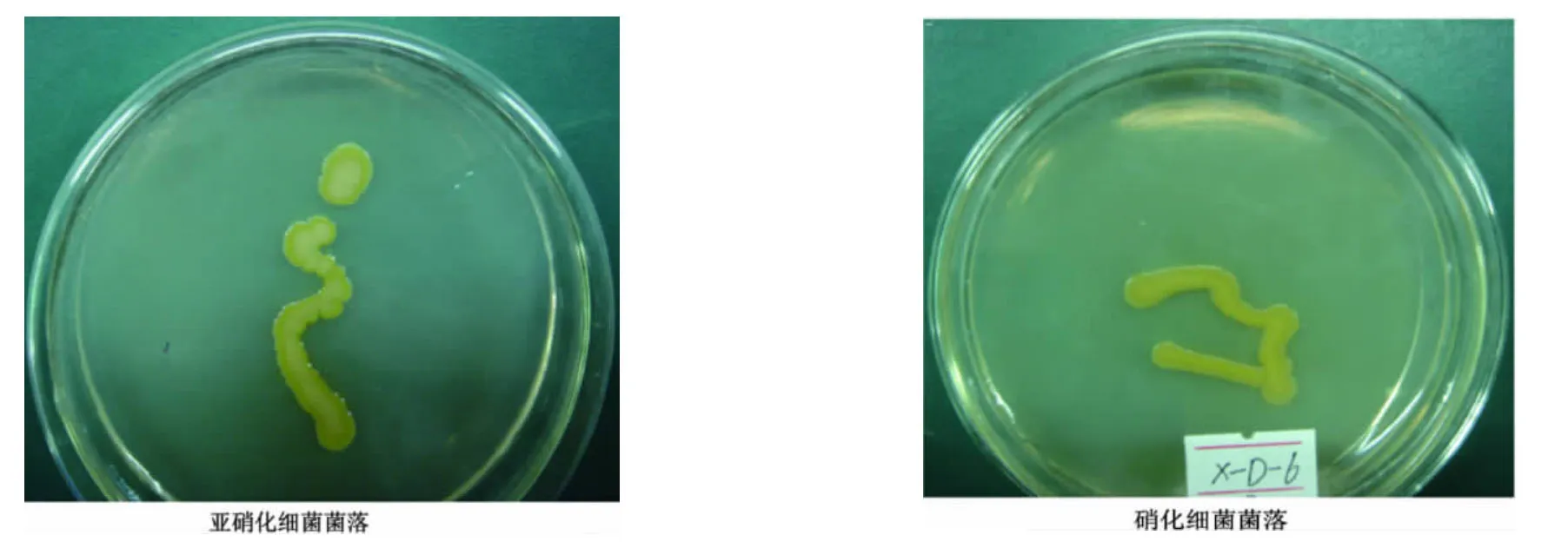
图2 菌落形态
3.2 氨化曲线
根据吸收液中氨气的增加来计算氨化作用的速率。
结果表明:自接种氨化细菌至10 h这一时期,氨化细菌进入对数生长期,氨气急剧增长,在20 h左右达到最大值;之后进入稳定期,氨气产生量趋于稳定;在60 h之后进入衰退期,表明鸡蛋作为培养基质已然耗尽(图3)。这变化趋势与前人研究类似[7]。
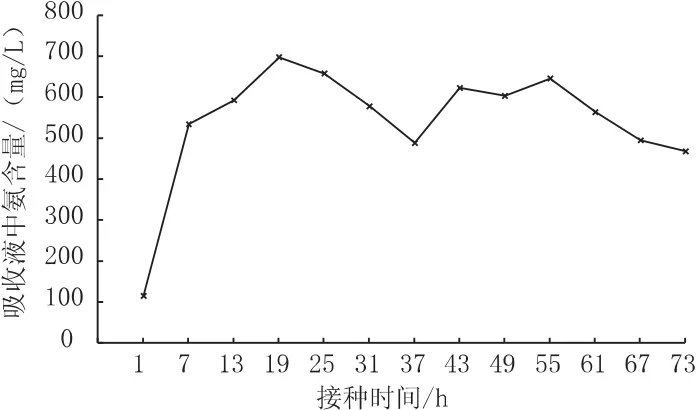
图3 实验中氨化曲线
3.3 硝化细菌除氨效果
对硝化细菌除氨效果进行分析,从表2可见,在1~20 h阶段,氨气量随着时间增加而增加,表明氨化细菌和硝化细菌处于对数增长期;此后出现降低,说明氨化细菌和硝化细菌处于稳定生长期,同时硝化细菌对氨化细菌产生的氨气加以利用,因此,氨气量大大减少,与对照组相比最高去除率达41%;随后,由于底物消耗殆尽,氨气量也随之减少。
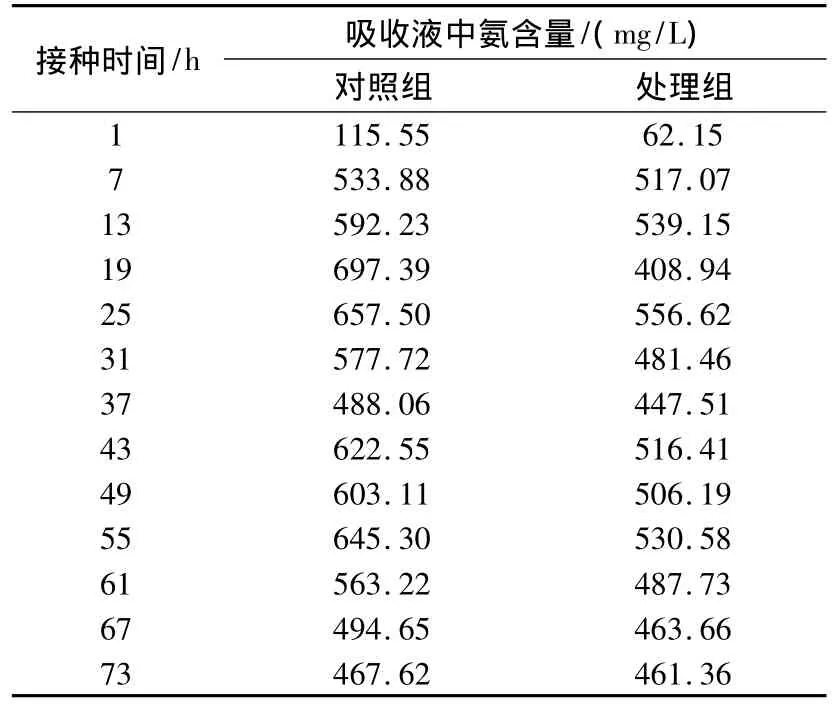
表2 硝化细菌对氨气的去除效果
利用SPSS V11.5对两组数据进行t检验。从表3可见,添加硝化细菌前后,方差分别为0.196和0.173,t=4.199,df=12,P=0.000 16 < 0.01,可以认为处理组和对照组有极显著差异,即添加硝化细菌可使氨气浓度极显著下降。

表3 硝化细菌去氨效果t-检验表(α=0.05)
4 结论
(1)本研究从污泥、土壤中采用先富集培养再分离纯化的方法筛选到6株细菌,经初步从形态学和生理生化反应判定,它们均属于硝化杆菌科,其中3株属于硝化细菌群,另外三株属于亚硝化菌群。
(2)氨化细菌发生氨化反应产生的氨气是生活垃圾中一种主要恶臭气体。本研究将筛选得到的硝化细菌加入反应体系,一方面主要通过其氧化作用中和氨化细菌所产生的氨气,另一方面则是在反应体系中与“氨气生产者”——氨化细菌产生竞争关系,导致营养基质快速消耗,两方面的原因均减少了氨气的排放量(与对照组相比,减少了41%)。
(3)本研究提出了硝化细菌应用于氨气除恶臭的有效性及可行性,提高了恶臭气体的生物处理效率,拓展了微生物除臭研究的新思路。
[1]吴银彪,夏治强.恶臭治理中的生物方法[J].中国环保产业,1996(4):36-37.
[2]韩艳忠,韩梅,吴英春.微生物除臭评价与分析[J].江苏环境科技,2006,19(A01):6-7.
[3]Brauer H,Varma G.Air polution Control Equipment[M].1981,New York:Bellin Heideberg.
[4]陈捷音.水中亚硝化细菌和硝化细菌检测方法的探讨[J].环境研究与监测,2007,20(2):21-23.
[5]黄秀梨等.微生物学实验指导[M].1999,北京:高等教育出版社-施普林格出版社.
[6]贾艳,徐铁玲,陈素艳.纳氏试剂分光光度法测定空气中氨[J].环境科学导刊,2010(1):91-92.
[7]李辉,徐新阳,李培军,等.人工湿地中氨化细菌去除有机氮的效果[J].环境工程学报,2008,2(8):1044-1047.
