溶液反应笼效应的改进
2012-09-25刘国杰黑恩成
刘国杰 黑恩成
(华东理工大学化学系 上海 200237)
在溶液反应动力学中,几乎所有物理化学教材都会提及Franck-Rabinowitch笼效应,它简洁明了地描绘了溶液反应的特征,给人以深刻的印象。但笼效应只是一个初级模型,并不涉及溶剂分子与反应物和产物分子间的作用强弱,因此,其实用价值是很有限的。本文试图引入溶剂压的概念,用其表示溶剂对溶质的作用强弱,从而使笼模型能够定性或半定量地说明许多溶液反应的动力学现象。
1 笼模型[1]
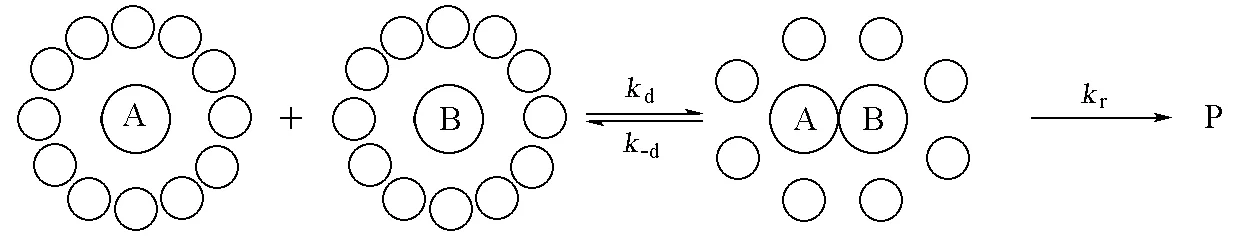
由于液体的密度远高于气体,反应物分子在溶液中的运动远不及在气相中自由。在溶液中,分子的碰撞直径要比两个分子间的间隙大(图1),反应物分子要通过溶剂分子的间隙并不是件容易的事。因此,至少在一段时间内,反应物分子犹如被囚禁在周围溶剂分子所构成的笼子内,并且只能在笼子内作往复运动,就像振动一样。仅当反应物分子因碰撞而获得足够的能量后,才有可能挤出这个笼子而迁入另一个笼子。因此,反复的振动和扩散便是反应物分子在溶液中的运动特征。如果反应是在反应物分子A与B间进行,那么只有在两个反应物分子迁入同一个笼子时才有可能,此时,反应物分子A与B反复地相互碰撞,最后,或者反应变成产物分子P,或者不反应离开这个笼子。
根据上述模型,不难写出分子A与B的反应机理为:
式中{AB}代表处在同一个笼子内的反应物分子A和B,也称遭遇对;kd为扩散速率系数;kr为遭遇对的反应速率系数;k-d为遭遇对不反应而重新离开同一笼子的扩散速率系数。
当反应达稳定状态时,由稳定态近似处理可得:
kdcAcB-k-dc{AB}-krc{AB}=0
(1)
(2)
故反应速率方程为:
(3)
溶液反应的反应速率系数为:
(4)
式(4)有下列两种极限情况:
① 当kr≫k-d时,式(4)分母中的k-d相比于kr可以忽略不计,此时,式(4)和式(3)可分别简化为:
k=kd
(5)
(6)
即溶液反应的速率完全由反应物分子迁移到同一笼子中的速率所控制,这种情况称为扩散控制。
② 当kr≪k-d时,式(4)分母中的kr相比于k-d可以忽略不计,此时,式(4)和式(3)可分别简化为:
(7)
(8)
式中K{AB}=kd/k-d,为反应物分子形成遭遇对的平衡常数。此时的反应速率不仅与平衡常数K{AB}有关,而且还取决于遭遇对反应成产物的速率,故称活化控制。
上述推导便是使用笼模型所得的结果。显而易见,这个模型并没有考虑到溶剂与反应物和遭遇对间的作用强弱以及这种作用对kd、k-d和kr产生的影响,因此,对于指定的反应,难以说明在什么样的溶剂中反应会出现上述两种极限情况,也不能解释何种溶剂会影响反应速率的快慢等动力学现象。本文将引进溶剂压的概念来改进这个模型。
2 溶剂压和溶质与溶剂间的相互作用
设想图1所示的溶剂笼可由下列方法得到:首先在溶剂中制造一个体积为一个溶质分子所占溶液体积的空腔;然后,再将一个溶质分子从完全自由的初态引入这个空腔中,从而得到一个实际的溶剂笼(图2)。

图1 溶剂笼

图2 设想溶剂笼形成的模型
于是,将溶质分子引入空腔所需做的可逆功即Gibbs自由能增量当为:
(9)
应该指出,溶质分子一经引入空腔,相界面实际上随之消失,图2中用虚线表示这个相界面,式(9)中的σ便是这个相界面的界面张力。由于引入的溶质分子要与构成其笼子的溶剂分子发生作用,σ的值已不同于原来空腔的界面张力。式(9)中的δV为一个溶质分子所占溶液的体积,∂As/∂V为恒温、恒压和溶液组成不变的条件下,空腔的界面积随体积的变化率。按照Laplace方程,式中的σ∂As/∂V应为虚线所示的相界面施加于溶质分子的附加压力,虽然σ是个虚值,但这个附加压力却是实在的,显然,它只可能来自与溶质分子相邻的溶剂,故称为溶剂压[2]。若用Δp表示溶剂压,则式(9)可表示为:
δG=Δp·δV
(10)
由此可见,溶质分子引入空腔需做的可逆功大小取决于这个溶剂压。由于溶质分子与构成其笼子的溶剂分子间的作用越强,即吸引力越大时,溶质分子引入空腔需做的可逆功越小,即Δp越小,反之亦然,故溶剂压Δp是表征溶质分子与构成其笼子的溶剂分子间作用强弱的重要指标。Δp越大,作用越弱;Δp越小,作用越强。
然而,溶剂压是与紧邻溶质分子的溶剂的内压力密切相关的,这可由下面的热力学关系得知:
σ≈UAs-TSAs
(11)
式中UAs和SAs分别为比表面热力学能和比表面熵。式(11)得自热力学定义G=H-TS≈U-TS,将它在恒温、恒压和溶液组成不变的条件下对界面积As求偏导,即得式(11)。这是一个适用于任何相界面的一般式,当然亦适用于图2虚线所示的相界面。
式(11)可进一步改写为:
(12)
式中∂U/∂V实为(∂U/∂V)T,p,nj。因压力对凝聚相的影响可以忽略不计,偏导数的下标p略去亦无妨,故∂U/∂V便是该相界面上溶剂的内压力,亦即紧邻溶质分子的溶剂的内压力,下面用pi表示。于是,根据式(12),溶剂压也可表示为:
(13)
式中α=UAs/(UAs-TSAs)。
由于SAs=-(∂σ/∂T)p>0,又因σ≈UAs-TSAs>0,所以UAs>TSAs>0,即对于指定的系统,α是一个大于1的因子。将式(13)代入式(10)可得:
δG=piδV/α
(14)
由式(13)和式(14)可见,溶剂压与紧邻溶质分子的溶剂内压力pi成正比。pi越大,溶质分子与构成其笼子的溶剂分子间作用越弱;反之,pi越小,则它们间的作用越强。
已知物质的内压力是分子间作用力大小的热力学量度。当分子间的作用力为吸引力时,内压力为大于0的正值,且吸引力越大,内压力越大;而当分子间的作用力为排斥力时,内压力为小于0的负值,且排斥力越大,内压力越小。据此,溶质分子与构成其笼子的溶剂分子间的作用有如下两种情况:
① 溶质分子与构成其笼子的溶剂分子间作用较弱,因此,溶质分子周围的溶剂分子间排列不太紧密,如图3(a)所示。此时,溶剂分子间的作用为吸引力,内压力和溶剂压都是正值。根据热力学,溶质的化学势会因承受溶剂压而增大,这便使它较易挤出笼子而迁移,从而使kd值变大。
② 溶质分子与构成其笼子的溶剂分子间作用较强,因此,溶剂分子较紧密地排列在溶质分子的周围,如图3(b)所示。此时,随着溶剂分子间排斥力增大,内压力和溶剂压会变得很小。溶质分子的化学势便因此而变小,它逸出笼子的能力也随之减小,即kd值变小。但是,如果溶质分子是遭遇对,则因它不易逸出笼子,不仅k-d值变小,而且还因遭遇的溶质分子间碰撞频率剧增,kr值变大。倘若遭遇对还会发生溶剂化作用,那么,因反应活化能降低[3],kr值将变得更大。
图3的示意是基于近代溶液理论——径向分布函数理论[4],该理论认为,液体和溶液的密度分布是按图4示意。图4中的纵坐标为溶剂的径向分布函数g(r),也即距离某一指定的溶质分子A为r处溶剂分子的数密度ρ(r)与平均数密度ρ之比,横坐标为溶剂与该溶质分子A的距离r。

图3 溶质分子与构成其“笼子”的溶剂分子○间的作用示意图(a) 弱作用;(b) 强作用

图4 溶剂的径向分布函数g(r)与r的关系
图4表明,在溶质分子周围的溶剂分子并不是均匀分布的,而是在出现了几个迅速衰减的峰值之后才变成数密度为ρ的均匀分布。其中g(r)值最大的第一个峰称为第一配位圈,这便是紧邻溶质分子的溶剂径向分布函数,其值要比1.0大得多,即第一配位圈中溶剂分子的数密度要比平均数密度大得多,而且溶质分子与这些溶剂分子间吸引力越大,这个峰越高。所以,溶质分子与构成其笼子的溶剂分子间的作用强弱虽对溶剂的平均数密度影响很小,但却能显著地改变与溶质分子紧邻的溶剂分子的数密度。
由此可见,溶剂压与笼模型中的kd,k-d和kr都有密切的关系。
3 溶液反应的类型及它们的动力学特征
对于指定的反应,按照溶剂与溶质分子间的作用强弱,原则上可将溶液反应分成以下4种类型:
① 溶剂对反应物和遭遇对作用都很弱。此类溶液反应可示意为:

由于溶剂对反应物和遭遇对作用都很弱,可以认为,溶剂对溶液反应的影响很小。N2O5在若干溶剂中的分解反应便是一个例子。表1是实验测得的动力学数据[5],由表1可见它们的反应速率系数k、指前因子A和活化能Ea都与气相反应相差不大。由于这些溶剂与反应物和遭遇对(或产物)的作用都很弱,Laidler[6]认为,溶剂仅起了填充空间的作用,故对反应速率影响很小。

表1 25℃时的k、A和Ea
② 溶剂对反应物为弱作用,而对遭遇对为强作用。此类溶液反应可示意为:



表2 100℃时反应(C2H5)3N+C2H5Br(C2H5)4N+Br-的k、A和Ea
注:表中的溶剂按极性的递增排列。
③ 溶剂对反应物有强作用,而对遭遇对为弱作用。此类溶液反应可示意为:
由于溶剂对反应物作用较强,反应物分子逃逸笼子的能力很小,kd值较小。但是,遭遇对则相反,因溶剂对遭遇对为弱作用,遭遇对承受的溶剂压较大,致使它的化学势较大,故遭遇对较易从笼子中逃逸,k-d较大。此外,遭遇的反应物分子间在笼子中的碰撞频率也因此而减少,kr变小,故有可能kr≪k-d。这将导致如下两个结果:
一是,此类溶液反应不仅可用稳定态近似处理,而且也适合平衡态近似处理。因为kr≪k-d是平衡态近似处理的适用条件,机理中的第②步,即遭遇对变成产物是此类反应的速控步,溶液反应的速率就取决于速控步速率,即:
(15)
遭遇对的浓度c{AB}可由反应物与遭遇对间的平衡关系来决定。严格说来,它们间的平衡常数K{AB}应由反应物和遭遇对的活度来定义,即:
(16)
式中γA,γB和γ{AB}分别为反应物A、B和遭遇对的活度因子,cӨ=1mol·dm-3。故将式(16)代入式(15),可得:
(17)
此时溶液反应的速率系数为:
(18)
式中k0=krK{AB}/cӨ,为γA=γB=γ{AB}=1时的速率系数,它相当于理想稀溶液中反应的速率系数,亦称参考态速率系数,式(18)即为Brönsted-Bjerrum方程。这个方程能用来描述离子强度对离子反应速率的影响[6],即原盐效应。这是因为离子有比遭遇对更强的水化能力,即溶剂对反应物作用较强,对遭遇对作用较弱,因此,水溶液中的离子反应属于此类溶液反应。
二是,此类溶液反应属于活化控制。如前所述,当kr≪k-d时,式(4)分母中的kr相比于k-d可以忽略不计,式(4)可以简化为:
k=krK{AB}
(19)
此时,反应速率系数不仅与平衡常数K{AB}有关,而且还取决于遭遇对变成产物的反应速率系数kr,这便是溶液反应呈活化控制的特征。此外,由于K{AB}和kr都较小,故此种溶剂使溶液反应的速率变得较慢。
④ 溶剂对反应物和遭遇对都有强作用。此类溶液反应可示意为:

由于强作用使反应物和遭遇对周围的溶剂分子较紧密地排列,溶剂压变得很小,以致反应物和遭遇对的化学势都变小,它们逃逸笼子的能力也变小,亦即kd和k-d都很小。但是,遭遇的反应物分子间的碰撞频率却加剧,使kr变大。如果遭遇对还会发生溶剂化作用,则有可能kr≫k-d,此时,溶液反应的速率将如式(6)所示,完全取决于反应物分子的扩散速率,亦即反应处于扩散控制。
综上所述,将溶剂压的概念应用于溶液反应的笼模型,能够产生很好的效果,它为这个模型补充了溶剂对反应物和遭遇对的作用强弱,以及这种作用对kd、k-d和kr的影响,使笼模型能够用来说明溶液反应的许多动力学现象。但是,正如式(13)所示,Δp与紧邻溶质分子的溶剂内压力成正比,故溶剂压的测定和计算要涉及径向分布函数,后者必须用中子衍射等方法才能测定,或者通过求解诸如PY、HNC等近似的积分方程或MC、MD计算机模拟来获得[4],这些都是溶液理论研究中的前沿课题。本文仅限于用这个概念来定性或半定量地解释溶液反应的某些动力学现象。
参 考 文 献
[1] Pilling M J.反应动力学.陶愉生译.北京:科学出版社,1980
[2] 刘国杰,黑恩成.大学化学,2010,25(1):68
[3] 王琪.化学动力学导论.长春:吉林人民出版社,1982
[4] 胡英,刘国杰,徐英年,等.应用统计力学-流体物性的研究基础.北京:化学工业出版社,1990
[5] Eyring H,Daniels F.JAmChemSoc,1930,52:1473
[6] Laidler K J.Reaction Kinetics.Volume 2-Reactions in Solution.Oxford:Pergamon Press,1963
[7] 吴和融,王彬芳.高分子物理学.上海:华东化工学院出版社,1990
[8] Grimm H G,Ruf H,Wolff H.ZPhysChem,1931,B13:301
