大肠杆菌O157:H7实验感染动物排菌动态检测
2012-09-21孙茂华孟祥升夏兴霞赵攀登张雪寒何孔旺王永山
孙茂华,孟祥升,夏兴霞,赵攀登,张雪寒,何孔旺,王永山
(本文编辑:张仲书; 英文编辑:王建东)
肠出血性大肠杆菌O157:H7感染具有暴发流行趋势、强烈的致病性与致死性以及抗生素治疗可能会加剧病情等特点。人感染O157:H7后,出现急性腹泻、出血性结肠炎(HC),并在5% ~10%的病例中引发溶血性尿毒综合征(HUS)及血栓性血小板减少紫癜(TTP)等严重并发症,严重者可导致死亡[1]。1982年该菌首先在美国发现,此后在世界各地散发或流行,1996年在日本大阪地区流行,患者逾万、死亡11人;2001年在中国江苏、安徽等地发生了多次食源性感染O157:H7事件,导致177人死亡。O157:H7已成为全球性的公共卫生和食品安全问题[2-4]。
人主要是经食源性或与带菌动物接触感染O157:H7,带菌动物的粪便是污染环境、食品以及水源的主要来源。从腹泻患者、畜禽粪便、市售肉类以及猪、鸽、牛、鸡、鸭等动物中均有分离出O157:H7的报道[5-6]。反刍动物是其主要的储存宿主,受感染动物通常不表现临床症状,但可经粪便排菌,因此是O157:H7的危险传染源[7]。鼠与人类生活关系密切,鼠类可以通过其排泄物污染人类的食品、食具以及生活环境,造成疾病的传播[8]。目前,我们对自然感染O157:H7动物的排菌情况还知之甚少,是O157:H7防控研究中的薄弱环节。
本实验以牛和小鼠为O157:H7感染动物模型,评价大肠杆菌O157:H7胶体金免疫层析检测试纸条[9-10]在O157:H7带菌动物监测中的应用前景。
1 材料与方法
1.1 主要试剂 大肠杆菌O157:H7检测试纸条与山梨醇麦康凯琼脂培养基(为O157:H7的鉴别培养基,含100μg/ml卡那霉素、50μg/ml新生霉素、40 μg/ml万古霉素和2.5μg/ml亚碲酸盐)均由江苏省农业科学院兽医研究所生物兽药实验室研制[4]。具有卡那霉素、新生霉素、万古霉素和亚碲酸盐四种抗性的大肠杆菌国际代表菌株O157:H7 EDL933株由江苏省农业科学院兽医研究所提供。该菌株在山梨醇麦康凯琼脂培养基上的菌落特征为:菌落透明、光滑湿润。
1.2 实验动物与分组 荷斯坦奶牛12头,雌性,(10±2)周龄,普通级,购自南京卫岗奶牛场。随机分成四个组,每组3头,实验前检测粪便O157:H7为阴性。ICR小鼠20只,雄性,6周龄,清洁级,购自扬州大学实验动物中心。随机分成四个组,每组5只。实验前检测粪便O157:H7为阴性。实验动物许可证号:SYXK(苏)2010-0005。
1.3 菌液制备 将冻存于-80℃的 O157:H7 EDL933菌种划线于山梨醇麦康凯平板,37℃过夜培养,次日挑取单菌落接种于5 m l的LB培养基中,37℃培养8 h。取O157:H7 EDL933纯培养物,划线接种于LB琼脂平板上,37℃培养18~24 h,用生理盐水将菌苔洗脱下来。取少量菌苔洗脱液做10倍比连续稀释,每个稀释度取1ml菌液与10~15 ml溶化后冷却至45℃左右的LB琼脂培养基混匀,倒入培养皿(直径90 mm)中,水平放置,待琼脂凝固后,于37℃温箱中培养,计数菌落,计算菌液中的细菌含量[菌落数/ml,(CFU/ml)]。
1.4 动物感染 所有实验动物在感染前3 d饮用5 g/L链霉素溶液,检测肠道粪便菌数CFU/g少于103时,断水断食12 h,然后采用灌胃途径感染动物。灌胃12 h后恢复饮食、饮水(0.5 g/L链霉素溶液)。
奶牛实验组:三个感染组,O157:H7的灌服剂量 CFU/头分别为 108、1010、1012;一个对照组,只灌服生理盐水。
ICR小鼠实验组:三个感染组,O157:H7的灌服剂量 CFU/只分别为 106、108、1010;一个对照组,只灌服生理盐水。
感染后,观察实验动物的精神、行为、食欲、粪便等临床症状。收集粪便,检测O157:H7排出状况。连续观察至粪便中无O157:H7检出。
1.5 粪便收集与处理 动物感染O157:H7后,分别于2、4、6、12和24 h后收集粪便,之后每天收集一次。取牛粪便1 g(鼠粪便0.2 g),悬于生理盐水中,获得10%(W/V)的样品悬液,震荡混合均匀,800 r/min离心5 min(离心半径8 cm),收集上清,然后5000 r/min离心3 min(离心半径8 cm),弃上清,1 ml生理盐水重悬菌体沉淀,检测菌液。
1.6 检测
1.6.1 试纸条检测 直接检测:分别取200μl上述菌液,滴加到O157:H7检测试纸条测试端,平放1~5 min,判定结果,无阳性反应者进行增菌检测。增菌检测:取上述菌液100μl,加入到3 ml改良EC肉汤培养基中(含20μg/ml新生霉素),37℃振摇培养9 h,取200μl菌液用O157:H7试纸条检测。
1.6.2 鉴别培养基菌落计数 将检测菌液分别进行10倍比连续稀释,每个稀释度取1ml,与10~15ml溶化后冷却至45℃左右的O157:H7山梨醇麦康凯琼脂培养基混匀,倒入培养皿(直径90mm)中,水平放置,待琼脂凝固后,于37℃温箱中培养,计数菌落,计算菌液中的细菌含量(CFU/g)。
2 结果
2.1 奶牛感染组 奶牛感染O157:H7后未见明显的异常,也没有出现腹泻症状。用大肠杆菌O157:H7检测试纸条和鉴别培养基菌落计数两种方法平行检测粪便处理物。牛在感染O157:H7后第2天开始从粪便排菌,第4~6天达到峰值,排菌时间最长持续28 d。
感染牛粪便中O157:H7菌数与感染剂量呈正相关。108CFU剂量组在第4天;1010CFU剂量组在第2、4、6 天;CFU 1012剂量组在第 2、4、6、8 天的粪便处理液用O157:H7检测试纸条直接检测为阳性。细菌培养计数均超过106CFU/ml。
感染牛从粪便排出O157:H7的持续时间与感染剂量也呈正相关。108CFU剂量组牛排菌时间可持续10 d;1010CFU剂量组牛排菌时间可持续16 d;而1012CFU剂量组牛排菌时间可持续28 d。
用大肠杆菌O157:H7检测试纸条(直接检测、增菌检测)与细菌培养计数两种方法检测牛感染O157:H7后的粪便排菌量和持续时间,两种方法的检测结果一致,试纸条更简便、快捷、直观,在1~5 min内可得出检测结果。
三个实验组牛感染O157:H7后的粪便排菌动态如表1所示。
2.2 小鼠感染组 小鼠感染O157:H7后1~3 d内均表现出昏睡、厌食、被毛蓬松,但没有明显的腹泻症状,只有少数在攻毒后2~3 d内有稀便。临床症状与感染剂量有关,高剂量组比低剂量组临床症状重,低剂量组从第3天逐渐恢复体况,采食量逐渐增加,精神好转。用大肠杆菌O157:H7检测试纸条和鉴别培养基菌落计数两种方法平行检测粪便处理物。小鼠在感染O157:H7后4 h开始从粪便排菌,6 h达到峰值,排菌时间最长可持续15 d。
感染鼠粪便中O157:H7菌落数与感染剂量呈正相关。106CFU剂量组在6 h;108CFU剂量组在4、6、12 h;1010CFU 剂量组在4、6、12、24 h 的粪便处理液用O157:H7检测试纸条直接检测为阳性。细菌培养计数均超过106CFU/ml。
感染鼠从粪便排出O157:H7的持续时间与感染剂量也呈正相关。106CFU剂量组小鼠排菌时间可持续8 d;108CFU剂量组小鼠排菌时间可持续10 d;而1010CFU剂量组小鼠排菌时间可持续15 d。
用大肠杆菌O157:H7检测试纸条(直接检测、增菌检测)与细菌培养计数两种方法检测小鼠感染O157:H7后的粪便排菌量和持续时间,两种方法的检测结果一致,试纸条更简便、快捷、直观,在1~5 min内可得出检测结果。
三个实验组小鼠感染O157:H7后的粪便排菌动态如表2所示。
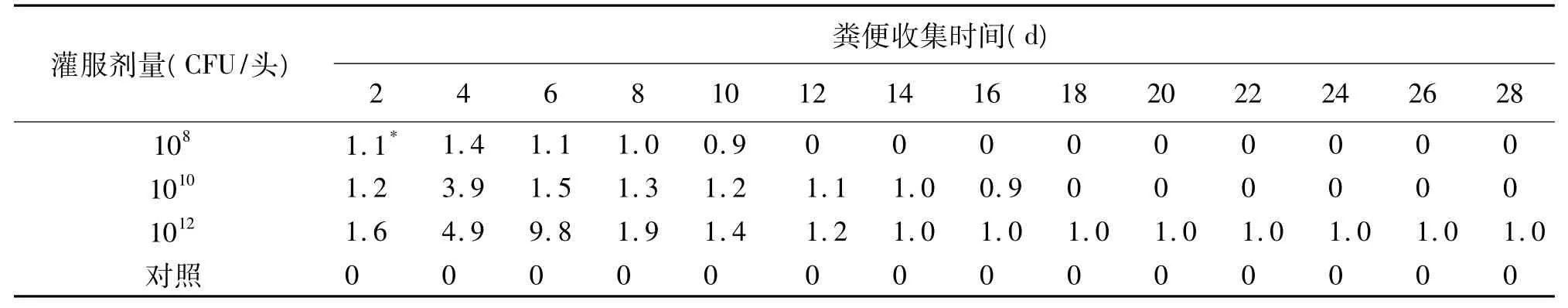
表1 牛感染O157:H7后的粪便排菌动态
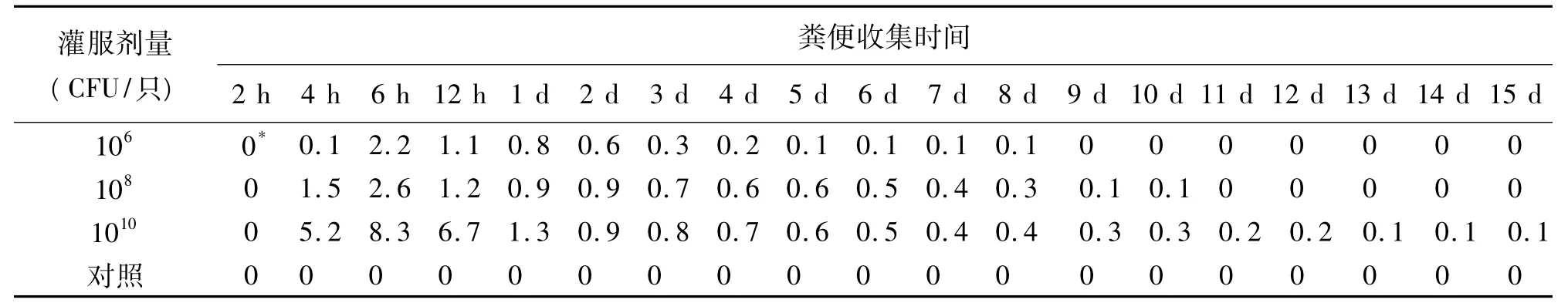
表2 小鼠感染O157:H7后的粪便排菌动态
3 讨论
大肠杆菌O157:H7主要生存在多种家畜、家禽,尤其是牛、羊等反刍动物体内,此外,从鹅、鸡、马、鹿、海鸥、绵羊、山羊、鸽子、鸭、兔、狗、猫的粪便中也可分离出O157:H7。O157:H7会引起幼龄动物腹泻,从而污染农畜产品。食源性以及与带菌动物接触是人感染O157:H7的主要途径,世界各地暴发流行的O157:H7的感染都是因食用被O157:H7污染的食物引起的。
牛是O157:H7的主要宿主,牛的饲养量巨大,是环境污染的重要源头,来源于牛的制品在民众生活中占有重要地位。而鼠与人类生活关系密切,有人类居住的地方几乎都受到鼠害侵袭,鼠类可以通过其排泄物污染人类的食品、食具以及生活环境,从而造成疾病的传播。因此,以牛和鼠为O157:H7感染动物模型,检测O157:H7的排菌状况,实际意义更强。
本实验参考 Wadolkowski和 Fujii等[11-12]的方法在感染前通过饮水给动物饲喂链霉素,排除肠道正常菌群,在动物消化道内为O157:H7驯化了一个定居和生长的环境,使O157:H7能在肠道中成为优势菌群。采用灌胃攻毒方式,使小鼠感染具有卡那霉素、新生霉素、万古霉素和亚碲酸盐四种抗性的O157:H7,灌胃攻菌后继续给予小鼠0.5 g/L的链霉素溶液饮用。牛在感染O157:H7后2 d开始从粪便排菌,4 d达到峰值,排菌时间最长可持续28 d。小鼠在感染O157:H7后4 h开始从粪便排菌,6 h达到峰值,排菌时间最长可持续15 d。牛、鼠感染O157:H7后的排菌时间和持续时间存在差异,与这两种动物的消化道结构有关。大肠杆菌O157:H7胶体金免疫层析检测试纸条与O157:H7鉴别培养基细菌培养计数的检测结果一致,而试纸条更简便、快捷、直观,在1~5 min内可得出检测结果,便于O157:H7临床样品的快速检测以及在粪便、食品、环境污染物、水样等现场检测样品中的快速筛查。
[1]Tarr PI.Escherichia coliO157:H7:clinical,diagnostic and epidemiological aspects of human infection [J].Clin Infect Dis,1995,20(1):1-10.
[2]WHO.Enterohaemorrhagic Escherichia coil infection Japan[J].Wkly Epid Rec,1996,30:229.
[3]李洪卫,景怀琦,逢 波,等.徐州市2000年肠出血性大肠埃希菌0157:H7感染性腹泻的调查[J].中华流行病学杂志,2004,23(2):119-122.
[4]倪大新,汪 华,顾 玲,等.江苏省1999年大肠埃希菌0157:H7宿主动物带菌情况调查[J].中华流行病学杂志,2002,3(2):102-104.
[5]Hancock D,Besser T,Lejeune J.The control of VTEC in the animal reservoir[J].Int JFood Microbiol,2001,66(1-2):71-78.
[6]Ogden ID,Hepburn NF,MacRae M,etal.Long-term survival of Escherichia coliO157 on pasture following an outbreak associated with sheep at a scout camp [J].Lett Appl Microbiol,2002,34(2):100-104.
[7]Meyer-Broseta S,Bastian SN,Arne PD,etal.Review of epidemiological surveyson the prevalence of contamination of healthy cattle with Escherichia coil serogroup O157:H7[J].lnternational Journal of Hygiene and Environmental Health,2001,203:347-361.
[8]刘 洁,夏兴霞,王永山,等.大肠杆菌0157:H7抗体胶体金免疫层析检测试纸条的研制[J].中国预防兽医学报,2010,32(5):375-378.
[9]夏兴霞,刘 洁,王永山,等.动物源性人兽共患细菌病防控生物新制剂的研究I.分泌抗大肠杆菌0157:H7单克隆抗体杂交瘤细胞株的建立[J].江苏农业学报,2009,25(2):291-295.
[10]夏兴霞,王永山,孟祥升,等.大肠杆菌O157:H7单克隆抗体胶体金免疫层析检测试纸条的研制[J].中国动物传染病学报,2010,18(4):47-53.
[11]Wadolkowski EA,Burris JA,O’Brien AD.Mousemodel for colonization and disease caused by enterohemorrhagic Escherichia coli O157:H7[J].Infect Immun,1990,58(8):2438-2445.
[12]Fujii J,Kita T,Yoshida S,etal.Direct evidence of neuron impairment by oral infection with verotoxin-producing Escherichia coli O157:H7 in mitomycin-treated mice[J].Infect Immun,1994,62(8):3447-3453.
