亚麻EST-SSR标记开发
2012-09-20郑东泽
苏 钰,李 明,姜 硕,郑东泽
(东北农业大学农学院,哈尔滨 150030)
亚麻(Linum usitatissimum L.)作为一种优质的纤维作物和油料作物,在工农业领域具有重要的经济价值。近年来,分子标记技术在亚麻种质资源遗传多样性、分子标记辅助育种、异基因标记、染色体连锁图谱构建等研究方面得到广泛应用[1],且主要是RAPD、AFLP和RFLP标记。与上述标记技术相比SSR标记具有多态性高、呈共显性遗传、数量丰富、易于用PCR检测和在基因组上分布均匀等优点[2],基于EST开发的SSR标记由于源自编码区,可直接用于基因作图和基因发掘,并因其信息量大、通用性好、开发简单等优越性成为近年来分子标记研究热点。目前小麦[3]、水稻[4]、棉花[5]、大豆[6]等作物研究中开发出的EST-SSR标记已在遗传图谱构建、通用性与比较作图、遗传多样性分析、品种鉴别方面得到了广泛应用,而已报道的亚麻EST-SSR标记数目较少[7],远不能满足研究需要。本研究利用从NCBI公共数据库下载的EST序列开发出65对EST-SSR引物,以期增加亚麻的可用EST-SSR标记数量,为EST-SSR标记技术在亚麻遗传育种的应用研究奠定基础。
1 材料与方法
1.1 试验材料及总DNA的提取
用于EST-SSR引物多态性研究的20份亚麻材料来自东北农业大学亚麻研究室(见表1)。所有材料播种于东北农业大学香坊实验实习基地,于苗期取幼嫩叶片洗净,存放于-70℃冰箱中,10 d后液氮研磨,采用改进后的CTAB法提取亚麻总DNA。MgCl2、dNTP、Taq酶及分子质量标准购自于天根生化科技有限公司。
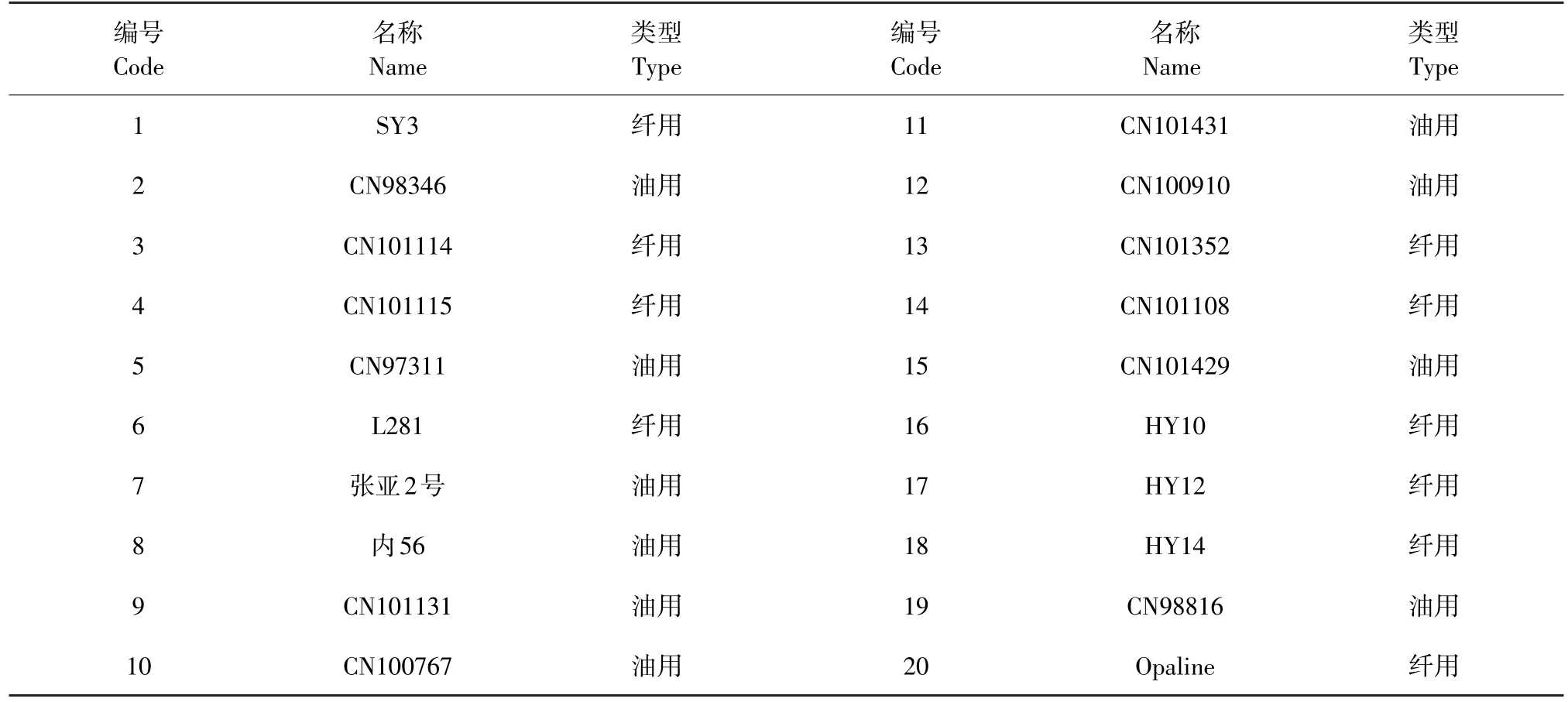
表1 试验所用材料及编号Table1 Name and type of accessions used in the experiment
1.2 EST-SSR序列获得与引物设计
从 NCBI数据库(http://www.ncbi.nlm.nih.gov/dbEST/index.html)下载了2009年11月5日之前提交的7 947条亚麻EST序列,并以FASTA格式保存。利用在线软件SSRIT(http//www.gramene.org/db/searches/ssrtool)对下载的EST序列进行SSR搜索。搜索标准为:二核苷酸重复次数≥9,三核苷酸重复次数≥6,四到六核苷酸重复次数≥5。
应用Primer Premier 5.0软件进行引物设计。引物设计原则EST序列长度大于100 bp,SSR序列的开始和结束位置分别距5'和3'端不少于50 bp,引物长度18~24 bp,退火温度T值40~60℃,而且上游和下游引物的Tm值相差不大于5℃,GC含量40%~60%,PCR扩增产物长度100~500 bp,且尽量避免引物二级结构Dimer、Hairpin、False primer以及连续6个碱基配对的出现。挑选软件分析分值在95分以上的引物对,由上海生工生物技术有限公司合成。
1.3 PCR体系及SSR扩增条件
PCR反应体系(20 μL):1×PCR缓冲液,1.25 mmol·L-1Mg2+,1 U Taq聚合酶,0.25 mmol·L-1dNTP,0.25 mmol·L-1SSR引物,50 ng模板DNA。扩增程序为:94℃预变性4 min,94℃变性1 min,各引物最适合退火温度复性1 min,72℃延伸1 min,35次循环,72℃延伸10 min,4℃终止。应用MJ PTC-100型PCR仪扩增。
1.4 电泳检测与数据处理
6%聚丙烯酰胺凝胶电泳检测PCR产物。PCR反应液中加入5 μL Loading Buffer,94℃变性10 min。电压1 800 V预电泳30 min,取4 μL变性产物上样,电泳1 h,硝酸银染色,照相并统计条带。利用NTSYS-PC2.10软件对电泳数据进行分析,构建聚类图。应用北京六一厂ECP3000型电泳仪,北京六一厂DYCZ-20D型电泳槽电泳。
2 结果与分析
2.1 亚麻DNA质量检验结果
1%琼脂糖凝胶电泳检测,结果表明提取的亚麻基因组DNA带型完整,质量优良能够满足后续试验要求。将浓度统一稀释至50 ng·μL-1,-20℃保存。
2.2 EST序列中SSR分布特点
利用SSRIT软件在下载的7 947条EST序列中检索出239条含有SSR的序列,占EST总数的3.0%。在检索出EST-SSR序列中,含有二核苷酸重复、三核苷酸重复和四核苷酸重复,未检索出五、六核苷酸重复。其中三核苷酸重复发生频率最高共160条,占检出总数的67.0%,其次是二核苷酸重复49条,占检出总数的20.5%;四核苷酸重复30条,占检出总数12.5%(见表2)。
检索出的EST-SSR序列重复类型分布有明显差别,在49条二核苷酸重复中CT(15条)、TA(12条)两种类型出现频率最高,其次是AT(7条)和TC(7条)出现频率相同,共占二核苷酸重复类型总数的83.7%;在160条三核苷酸重复中TCT(15条)、TAA(14条)、TTC(11条)三种重复类型出现频率最高,其次是GAA(9条)、CAA(9条)和CTT(9条)出现频率相同,共占41种三核苷酸重复类型总数的41.9%;在30条四核苷酸重复中AGAA(19条)为主要重复类型,占11种四核苷酸重复类型总数的63.3%,其他重复类型除CTTT(2条)外皆出现一次(见表3)。
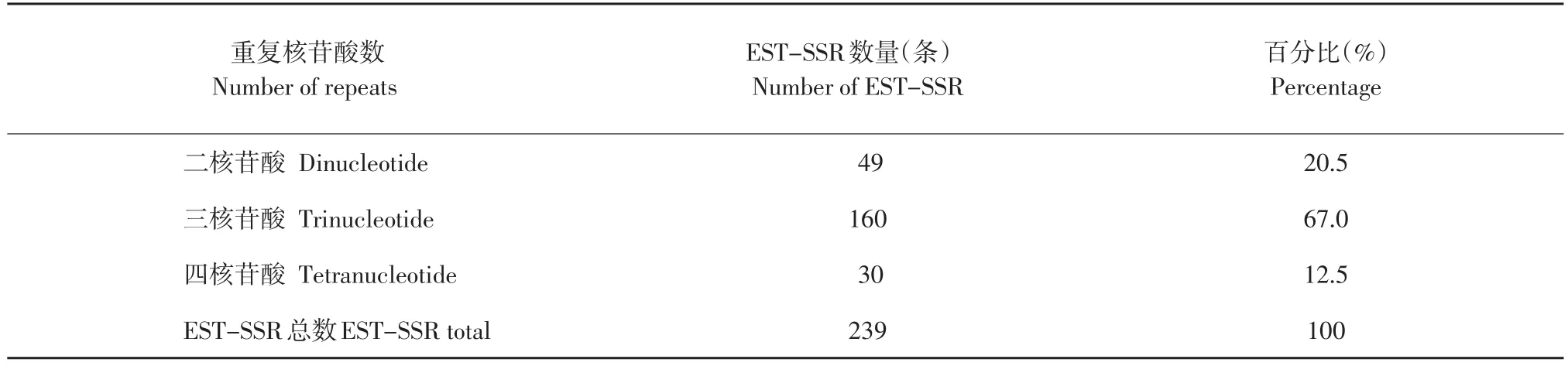
表2 EST-SSR序列中不同重复核苷酸数的数量及百分比Table2 Number and percentage of repeat types in EST-SSR
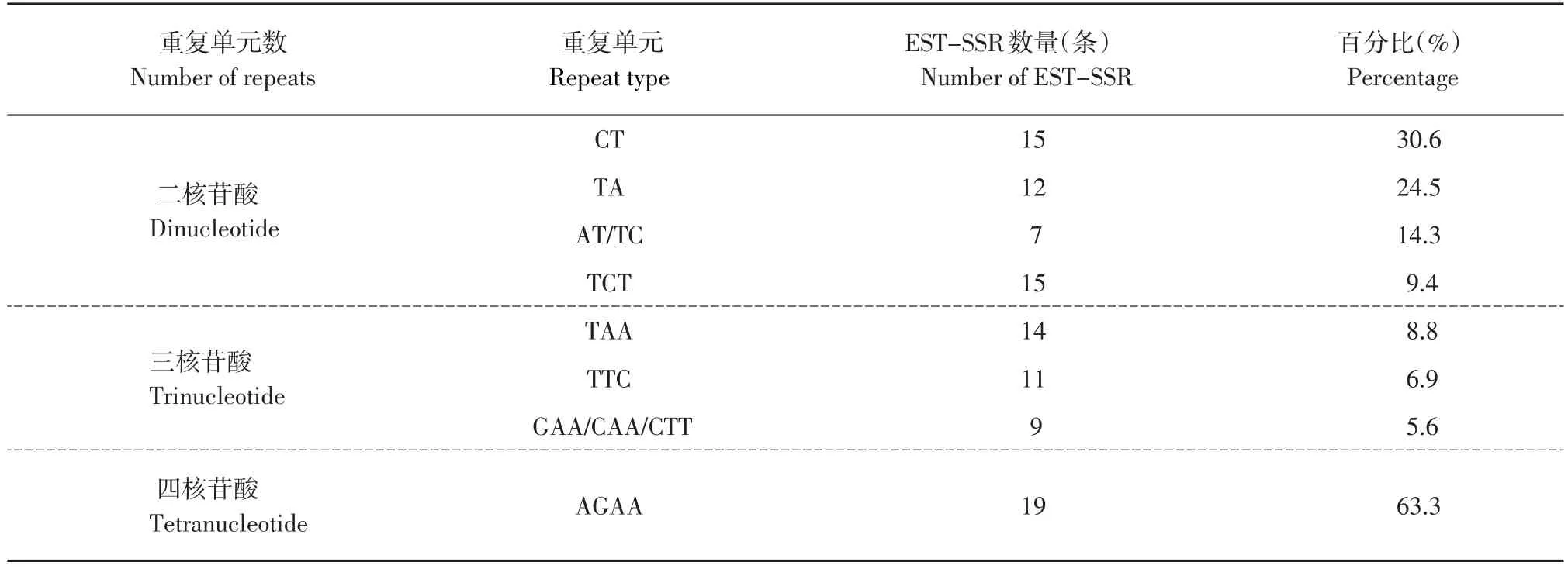
表3 EST-SSR序列中不同重复类型及其数量和百分比Table3 Percentage,number and type of SSR in EST-SSR
2.3 EST-SSR标记筛选及多态性分析
根据239条EST-SSR序列共设计了65对引物。在20份亚麻材料中有52对引物能够扩增出清晰的目的条带,引物可用率为80%;其中32对引物在不同的亚麻材料间显示出多态性,占引物总数的49.2%。32对引物共扩增出条带82条,其中多态性条带49条,占扩增总条带的59.8%。在32对具有多态性的引物中含三核苷酸重复的引物最多23个,二核苷酸重复6个,四核苷酸重复3个。共含有25个重复类型,其中含TC和TCT重复的引物3个;含TA、ATT和ATG重复的引物两个;含其他重复类型的引物各1个(见表4)。图1为引物SYES12和引物SYES45在20份亚麻材料中扩增产物电泳检测结果。
2.4 20份亚麻材料聚类分析
结果见图2。
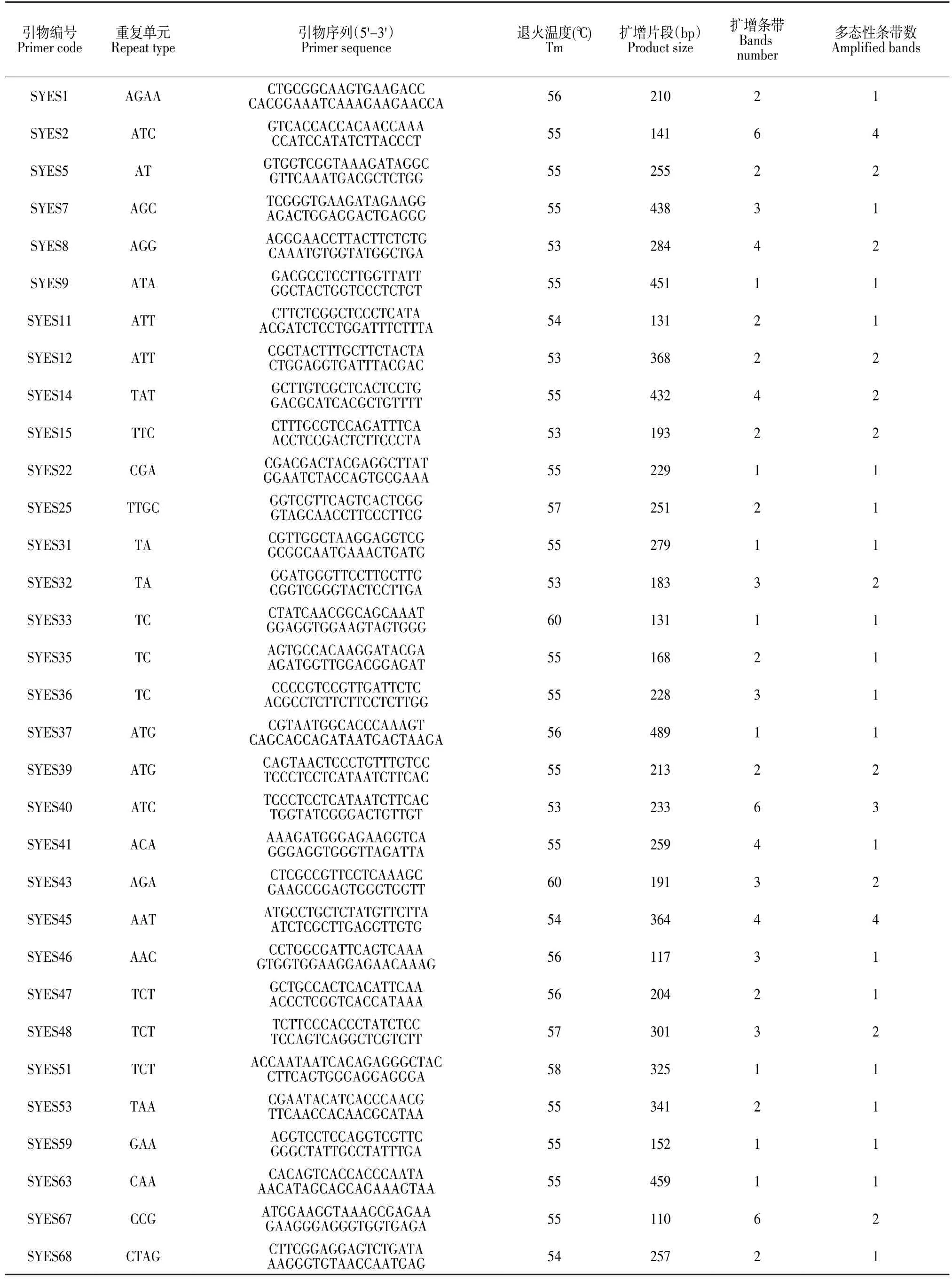
表4 亚麻EST-SSR引物序列Table4 Sequences of EST-SSR primers of flax
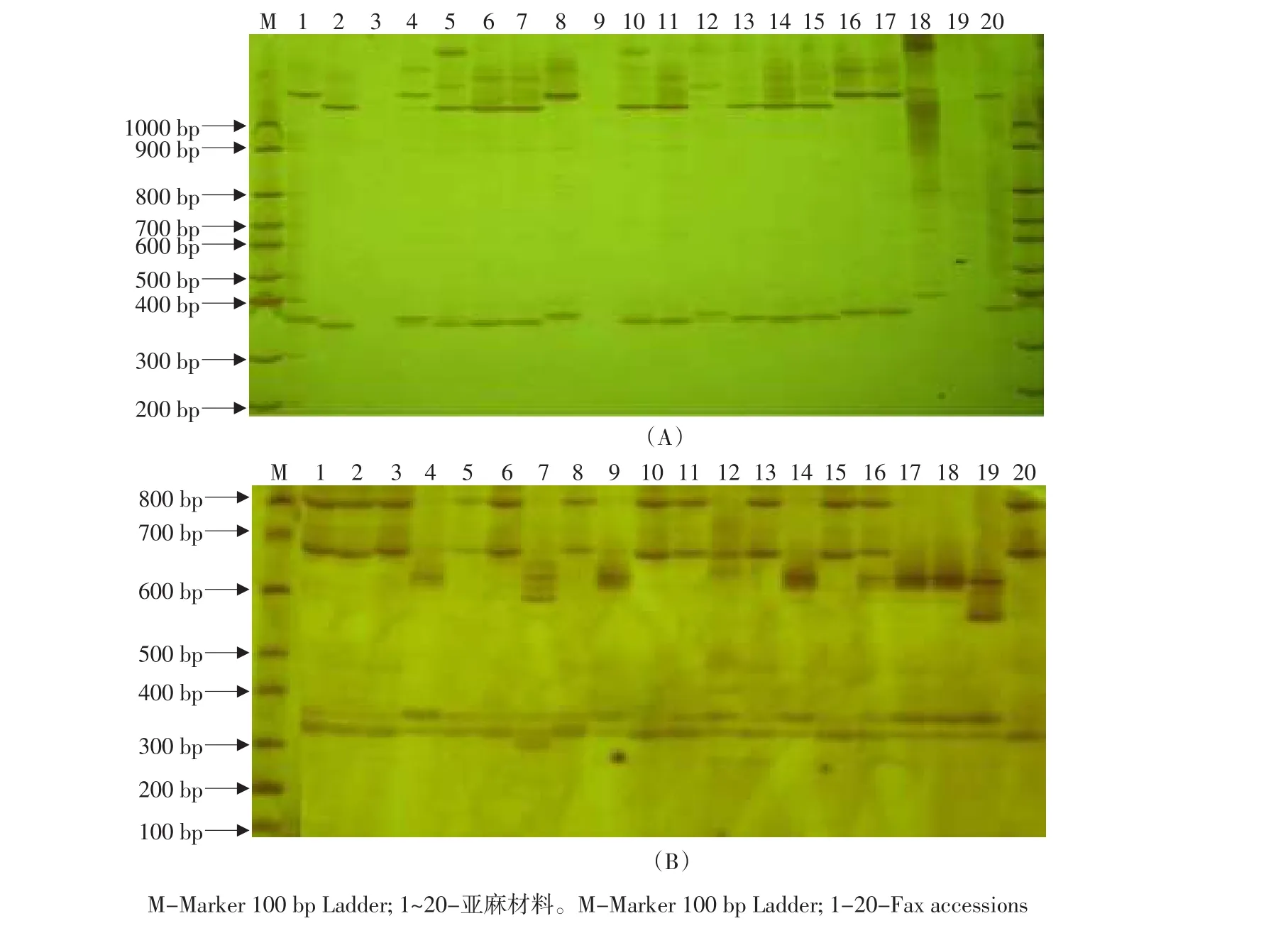
图1 引物SYES12(A)和SYES45(B)在20份亚麻材料中扩增结果Fig.1 Amplification by EST-SSR primers in 20 flax accessions
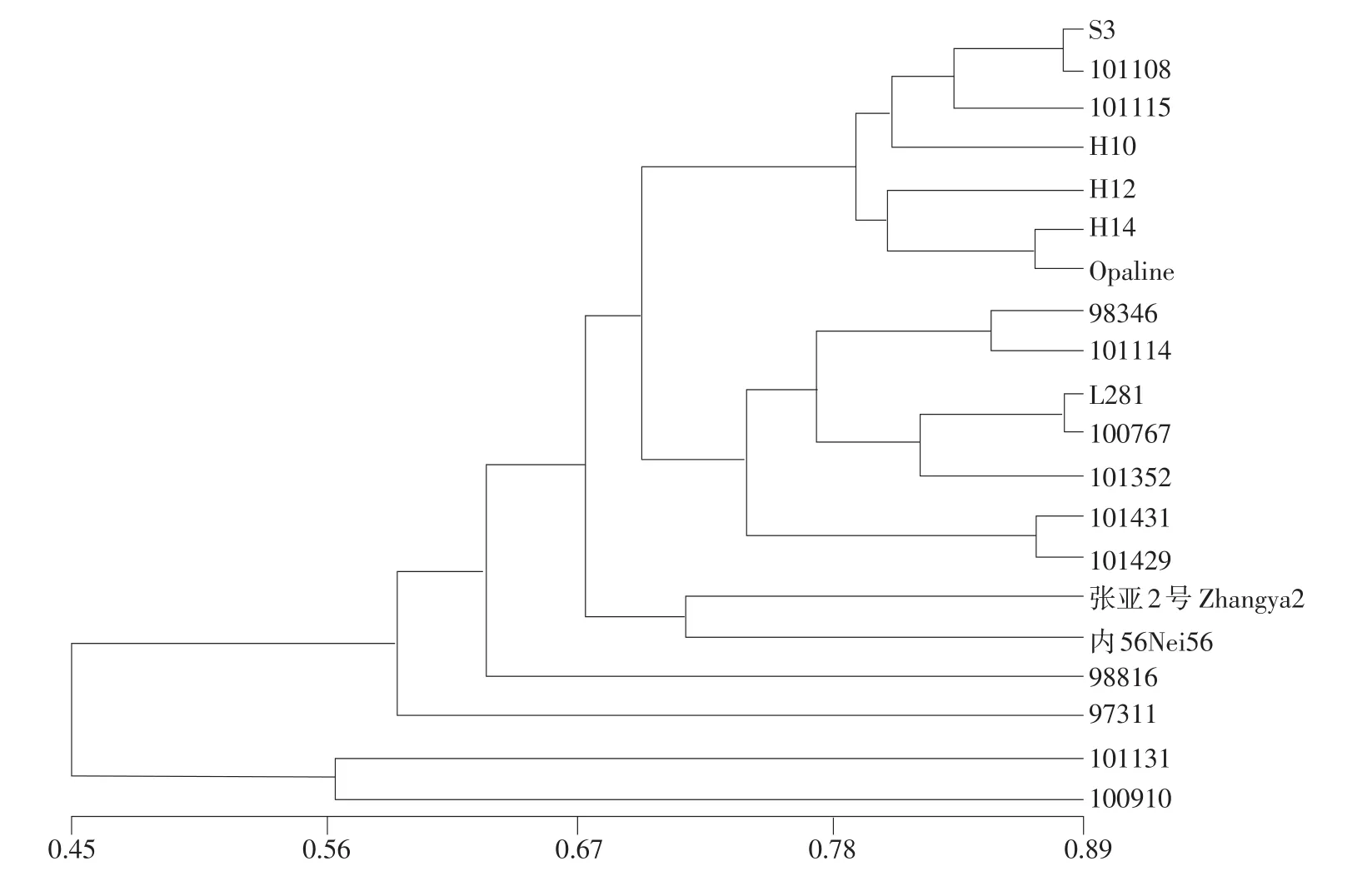
图2 20份亚麻材料EST-SSR标记聚类Fig.2 Dendrogram of 20 flax accessions generated by EST-SSR data using UPGMA method
利用筛选出的32个EST-SSR分子标记对20份亚麻材料进行聚类分析,由图2可知,遗传相似系数变异范围为0.45~0.89。以0.65为阈值可将20个品种分为五大类,其中16份材料被聚类在第一大类,另外的4个油用品种CN98816、CN97311、CN101131和CN100910分别为一大类,且与第一大类亲缘关系越来越远。第一大类在0.70处又可被分为三类,S3、 CN101108、 CN10115、 H10、 H12、 H14 和Opaline 7个纤维用品种被首先聚为一类;第二类中包括3个纤维用品种CN98346、CN101114、L28和4 个油用品种 CN10076、CN101352、CN101431、CN101429;第三类包括张亚2号和内56这两个国内选育的亚麻品种。从整体来看,聚类图上半部分的10个品种均为纤维用品种,而10个油用品种全部在下半部分。可见利用EST-SSR分子标记的遗传多样性分析可准确的对不同亚麻材料进行亲缘关系鉴定。
3 讨论与结论
本研究结果表明亚麻EST中SSR出现频率为3%。Kantety等研究发现,玉米、燕麦和小麦等禾谷类作物SSR出现频率在7%~10%,水稻4.7%[8];大豆SSR出现频率较低,少于1%[6],主要反映了SSR在不同物种间分布存在差异,也可能是由于搜索标准如重复类型、重复次数不同,分析方法不同或分析的数据量不同导致的。在检出的亚麻EST-SSR中三核酸重复为主导类型占重复总数的67%,其次是二核酸重复和四核酸重复,与一般EST序列分析统计结果相同[9-10]。
多态性是评价引物的重要指标,本研究开发的多态性引物数量占有扩增条带的引物总数49.2%。与已有亚麻EST-SSR引物开发数据有所差异,高于龙松华[11]和Cloutier等[12]研究报道的26.3%和43.3%,但低于张建平等[7]报道的77.8%。这主要与引物多态性验证所选择的亚麻材料本身的遗传差异大小有关,前两者选择的材料都为常规材料但遗传差异较小,而后者虽遗传差异相对较大却是由于所选材料中含有杂交材料和不育材料造成的,可见选择有代表性的多态性验证材料对于新引物的开发有重要意义。其次,引物开发所用的EST序列来源不同和多态性条带的稳定性也会影响引物的多态性比例。由于国内外一些研究中开发的EST-SSR引物并未完全公布,故目前可用的亚麻EST-SSR引物数有限。本研究公布全部32对具有稳定多态性的EST-SSR引物序列,增加了亚麻可用分子标记数量,也为今后利用不同cDNA文库开发SSR和亚麻遗传图谱的构建奠定基础。
遗传多样性研究的核心是基因多样性,目前国内外亚麻遗传多样性研究分析多基于RAPD标记,与之相比EST-SSR标记能够更好的反应基因表达转录部分信息。本研究基于EST-SSR分子标记对20份亚麻品种进行的聚类分析可准确的从亲缘关系上区分油用品种和纤维用品种,验证了EST-SSR引物在遗传多样性分析中的可行性,同时为相关基因开发研究提供了有价值资源。
[1]何东锋,陈信波,高国赋,等.亚麻分子标记应用研究进展[J].湖南农业科学,2009(5):21-23.
[2]Wayne P,Machray G C,Provan J.Polymorphism revealed by simple sequence repeats[J].Trends in Plant Science,1996,1(7):215-222.
[3]Zhang L Y,Leroy P,Bernard M,et al.Investigation of characteristics and polymorphism of wheat EST-SSRS and their genetic mapping[J].Journal of Triticeae Crops,2008,28(1):11-20.
[4]Yu J K,La R M,Kantety R V,et al.EST derived SSR markers for comparative mapping in wheat and rice[J].Molecular Genetics and Genomics,2004,271(6):742-751.
[5]张艳欣,林忠旭,李武,等.海岛棉EST-SSR引物的开发与应用研究[J].科学通讯,2007,8(5):1779-1787.
[6]高运来,朱荣胜,刘春燕,等.黑龙江部分大豆品种分子ID的构建[J].作物学报,2009,35(2):211-218.
[7]张建平,王斌,赵丽娟,等.亚麻EST序列中SSR标记的筛选[J].西北植物学报,2009,29(5):910-915.
[8]Kantety R V,Mauricio R L,Matthews D E,et al.Data mining for simple sequence repeats in expressed sequence tags from barley,maize,rice,sorghum and wheat[J].Plant Molecular Biology,2002,48(5-6):501-510.
[9]Cardle L,Ramsay L,Milbourne D,et al.Computational and experimental characterization of physically clustered simple sequence repeats in plants[J].Genetics,2000,156(2):847-854.
[10]Kota R,Varshney R,Thiel T,et al.Generation and comparison of EST-derived SSRs and SNPs in barley[J].Hereditas,2001,135(2-3):145-151.
[11]龙松华,李翔,邓欣,等.亚麻EST-SSR信息分析与标记开发[J].武汉植物学研究,2010,28(5):634-638.
[12]Cloutier S,Niu Z X,Datla R,et al.Development and analysis of EST-SSRs for flax[J].Theor Appl Genet,2009,119:53-63.
