小型西瓜离体培养技术研究
2012-09-20王喜庆
王喜庆
(黑龙江省农科院园艺分院,哈尔滨 150069)
西瓜(Citrullus vulgaris)属葫芦科,西瓜属。西瓜组培始于20世纪70年代,Andrus等1971年首次报道用无籽西瓜下胚轴培养诱导形成丛生芽,建立无籽西瓜无性繁殖系[1]。许智宏等以西瓜顶芽为外植体诱导出丛生芽,并成功地获得了试管苗[2],随后国内外很多学者做了大量研究,涉及外植体的选择、激素配比、组培苗的驯化及玻璃化的防止方法等[3-6],并取得良好进展。近年来,小型西瓜生产发展迅速,市场前景良好,经济效益可观,各育种单位已经深入开展小型西瓜育种工作,目前一个重要目标是育成无籽小西瓜。采用离体诱变西瓜四倍体,能使加倍、选择、快繁同时进行,并可克服细胞嵌和体现象,加快小型西瓜育种工作进程。但目前对小型西瓜进行组织培养与快繁技术研究报道还较少。刘独臣等以茎尖、子叶等为外植体进行小西瓜组培研究工作[7]。西瓜组培受基因型的限制较大,要利用组织培养与化学诱导相结合的方式获得三倍体,必须首先完善小型西瓜的组织培养体系。试验以子叶为外植体材料,研究小型西瓜组织培养体系,以期为组织培养诱导四倍体,育成无籽小西瓜提供基础条件和技术支持。
1 材料与方法
1.1 材料
黑龙江省农科院园艺分院选育的小型西瓜品种龙盛1号的母本H35。
1.2 方法
选取饱满的小型西瓜种子,去壳后在无菌水中浸泡2 h,用10%次氯酸钠溶液消毒10 min,无菌水冲洗3次,然后接种于MS培养基(蔗糖20 g·L-1,琼脂5 g·L-1)发芽,28 ℃暗培养1 d,当胚根稍露出时,放置培养室内培养。
当子叶展平,但没有真叶出现时,选取苗龄一致的子叶,将其横切,分别取近胚轴端和远胚轴端,表面向上接入芽分化培养基中,每瓶放5个外植体,每处理5瓶,重复3次,放置培养室培养。
1.3 培养基及培养条件
1.3.1 培养基及其制备
①种子萌发培养基:MS。
②芽诱导培养基:MS+6-BA(0.5、1、2、3 mg·L-1)+NAA(0、0.1、0.3、0.5 mg·L-1)。
③ 芽增殖培养基:MS+6-BA(1、2、3 mg·L-1)+NAA(0、0.1 mg·L-1)。
④ 壮苗培养基:1/2MS+KT(0.1、0.2、0.3 mg·L-1)+IAA(0.01、0.02 mg·L-1)。
⑤ 生根培养基:1/2MS+NAA(0.1、0.3 mg·L-1)或 IBA(0.01、0.02 mg·L-1)。
MS为基本培养基,添加不同的激素,培养基pH 5.8;分装,121℃灭菌20 min,冷却备用。培养室温度保持在(25±2)℃,光照强度保持在3 000 lx,每天光照12 h。
1.3.2 接种与培养
将已消毒种子平放于萌发培养基上,待子叶展平时切取不带茎尖的子叶横切,分别接种在芽诱导培养基上;挑选长势较好、大小均一的丛生芽团块,切成约1 cm×1 cm的小块,接种到芽增殖培养基上,接种后15 d观察统计,芽增殖等情况;后再挑选长势较好、大小均一的小芽接种到壮苗培养基上进行复壮培养,接种后15 d,取长势较好的试管苗接种到生根培养基上,每瓶5株;将分化长出2~3条小根的小苗瓶放置温室炼苗,出瓶驯化。
2 结果与分析
2.1 外植体类型对丛生芽诱导的影响
从表1可以看出,西瓜子叶近轴端和远轴端部位分化形成丛生芽的能力差异显著,远轴端外植体的丛生芽诱导率最高可达2.6%;近轴端外植体丛生芽诱导率最高可达100%。结果表明,子叶近轴端外植体再生能力强,诱导率高,丛生芽集中在下胚轴和子叶交接处,其他部位没有芽的分化。这与张全美的研究结果一致[8]。
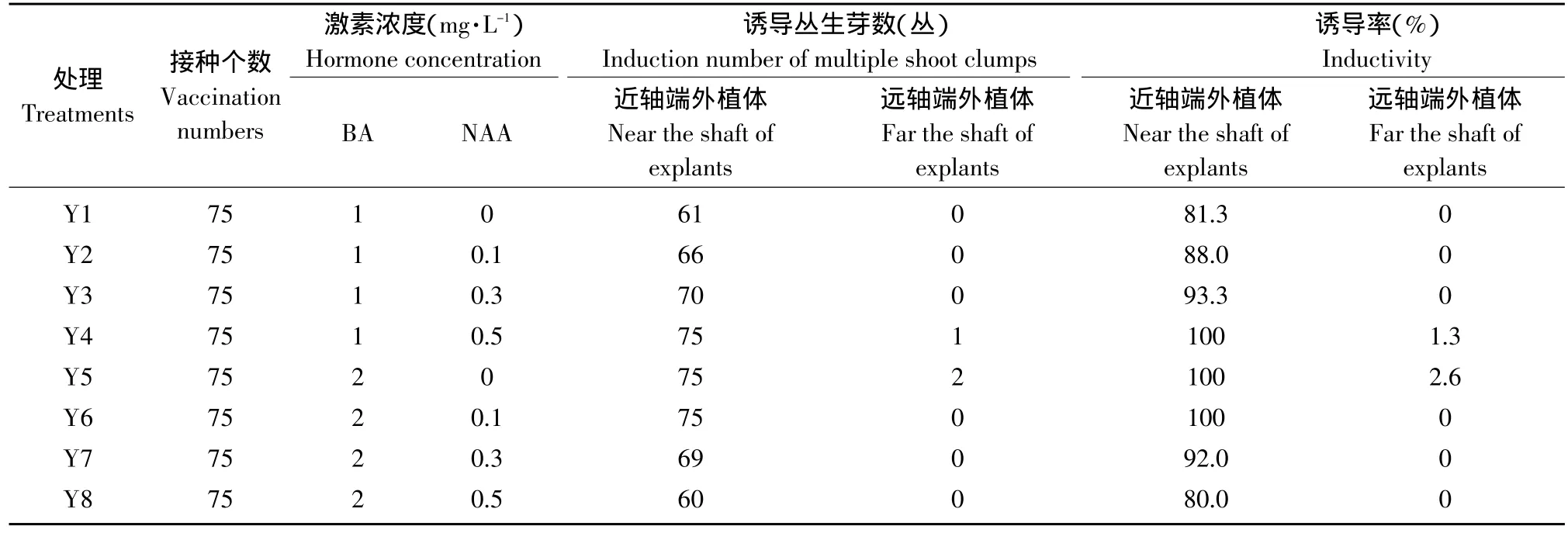
表1 外植体类型对丛生芽诱导的影响Table1 Influence of explant type on cluster buds induction
2.2 外源激素浓度对丛生芽分化的影响
将子叶近轴端接在不同处理培养基上,10 d左右外植体下胚轴和子叶的交接处分化产生淡绿色芽点,继续培养逐渐转为绿色,15 d后可形成丛生芽。调查试验结果发现,相同浓度的NAA下,BA浓度越高,对丛生芽形成越多,但当BA达到3 mg·L-1时抑制丛生芽的形成,最佳激素配比为2.0 mg·L-1BA、0.1 mg·L-1NAA(见表2),此时诱导率和每个外植体诱导的丛生芽数分别为100%和6.3个。
2.3 不同激素配比对丛生芽增殖的影响
诱导出的丛生芽在继代2~3次后,极易玻璃化,所以将基本培养基无机盐浓度降低,采用1/2MS为基本培养基,调整激素浓度,在诱导出的丛生芽中,选取生长健壮的芽团,分割成1 cm×1 cm的小块,转接到不同激素配比的培养基上,15 d后调查统计增殖情况(见表3)。
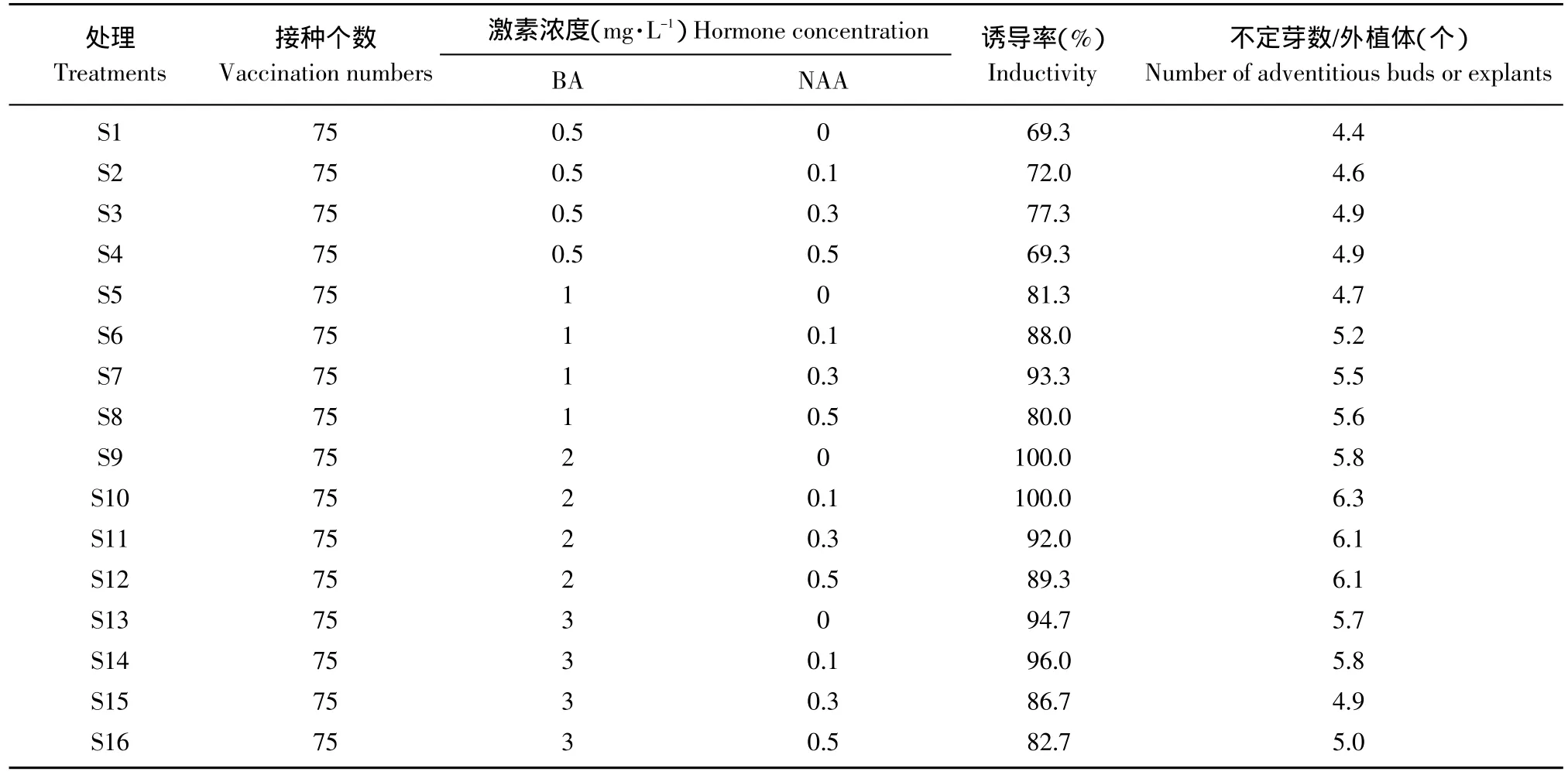
表2 不同激素配比对丛生芽分化的影响Table2 Influence of different hormone ratio on multiple shoot clumps differentiation

表3 不同激素配比对丛生芽增殖的影响Table3 Influence of different hormone ratio on multiple shoot clumps proliferation
当NAA为0 mg·L-1时,在BA为2和3 mg·L-1的两种培养基中,丛生芽增殖率较高,无显著差异。但BA为2 mg·L-1的培养基中,丛生芽颜色浓绿,生长健壮,所以选择BA为2 mg·L-1、NAA为0 mg·L-1的培养基作为丛生芽的增殖培养基。丛生芽一般15 d左右继代1次。
2.4 壮苗培养基的确定
由于丛生芽比较弱小,若直接切取丛生芽进行生根培养,不易直接生根,生根后移栽成活率也很低。因此,在丛生芽长到1 cm时,切取生长正常健壮的单芽,接种到壮苗培养基上。两周后调查结果,当KT为0.2 mg·L-1、IAA为0.01 mg·L-1时,苗伸长较好,而且玻璃化现象少,壮苗多(见表4)。
2.5 生根培养
当苗高1.5~2.5 cm、具3片叶时,转入1/2MS为基本培养基的生根培养基内诱导生根。每瓶接种5株小苗,15 d后小苗基部分化出根。调查试验结果,以添加0.3 mg·L-1NAA和IBA的生根效果无显著差异,但当IBA浓度为0.3 mg·L-1时,苗比较健壮(见表5)。

表4 不同激素配比对小西瓜组培苗复壮的效果Table4 Influence of different hormone ratio on mini-watermelon seedlings of tissue regeneration
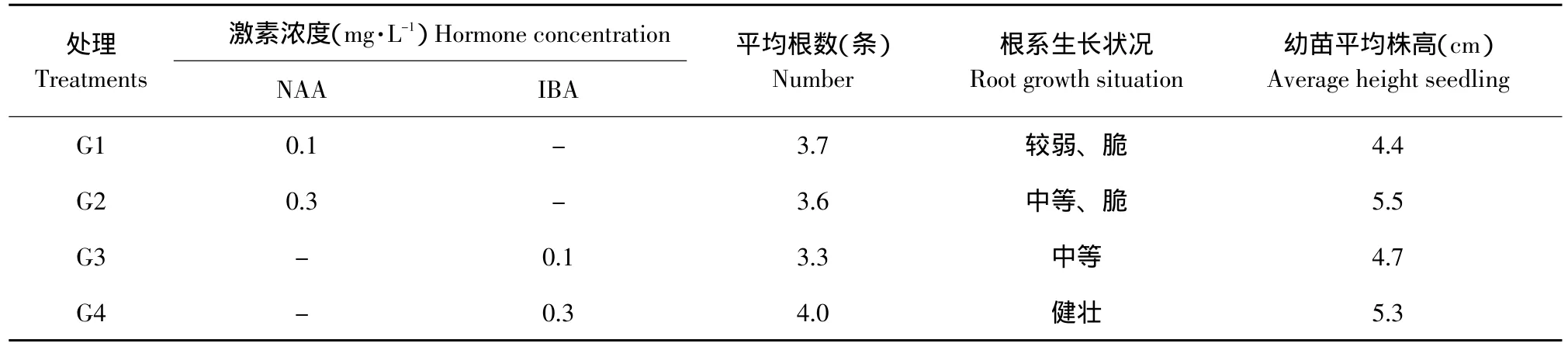
表5 两种生长素和不同浓度对不定芽生根的影响Table5 Influence of two hormones and different concentrations on in vitro shoot rooting
3 试管苗的移栽与管理技术
当试管苗株高达到5 cm,根长约1.5~2.0 cm时,即可移栽。首先将培养瓶在室温、适当遮荫的自然光下炼苗7 d,打开瓶盖再炼苗2 d。出瓶时用镊子小心取出幼苗,将根部琼脂洗干净,栽入穴盘。基质采用蛭石∶草炭∶园土=2∶1∶2,1个月后成活率达30%。小西瓜组培苗移栽后的管理相对要求较高,水分管理,要做到少量多次,湿度大容易烂苗,空气湿度要保持在70%,适当遮荫。1个月后新根长出1 cm转入常规栽培养护管理。
4 讨论与结论
通过本试验,掌握小型西瓜丛生芽诱导、丛生芽增殖、分化苗壮苗及生根等不同阶段的培养基配方,探讨各阶段较为理想的培养条件及小西瓜组培苗驯化栽培的最佳基质。
4.1 不同消毒方法对种子萌发的影响
本试验预备试验阶段考察不同消毒方法对种子萌发的影响。由于西瓜的种皮较厚,一般都采取剥离种皮后浸种,使用常规的升汞和酒精消毒,会降低种子萌发率,所以本试验采用10%次氯酸钠消毒10 min,消毒效果较好,污染率极低。
4.2 不同外植体对不定芽诱导的影响
本试验将4~6 d苗龄的无菌苗子叶分割为近轴端和远轴端两部分分别培养,进行不定芽诱导比较试验,结果表明子叶近轴端外植体再生能力强,诱导率高。造成这一差异的原因,与植物组织的生长状态和组织、器官内源激素分布不均有关。
4.3 利用壮苗培养来提高生根率
由子叶近轴端诱导出的丛生芽成簇状,丛生芽比较弱小,茎节间较短,如果直接切取丛生芽进行生根培养,不易直接生根,生根后移栽成活率也很低,所以增加壮苗培养阶段来使节间增长,培养壮苗。
4.4 激素种类对芽诱导的影响
有研究表明BA配合IAA使用有利于芽的分化[7,10],本试验采取BA与NAA配合使用来诱导丛生芽,诱导效果较好,与Compton和Gray研究结果一致[3],在含有BA的培养基中加入IAA时,增加愈伤组织形成,却阻止芽的形成,这一差异或许与试验选用的基因型材料不同有关。
4.5 解决玻璃化现象的方法
小西瓜试管苗在丛生芽诱导和继代过程中,玻璃化现象严重。可以通过提高琼脂和铁盐的浓度,降低硝酸盐浓度等手段来解决,这与刘独臣等研究结果一致[7]。对培养温度和继代时间也较为敏感,温度高于25℃时,继代时间超过15 d,玻璃化现象严重。选取不同的小型西瓜试材试验,基因型不同,诱导率和驯化成活率可能会有差异,这部分工作还有待于在今后工作中进一步研究探讨。
[1]Andrusc F,Seshadriv S,Grimball P C.Produetion of seedless watermelon[J].USDA Tech Bull,1971,5(3):245-251.
[2]许智宏,卫志明,刘桂云.用离体培养无性系繁殖三倍体无籽西瓜[J].植物生理学报,1979,5(3):245-251.
[3]Choi P S,Soh W Y,Kim Y S.Genetic transformation and plant regeneration of watermelon using Agrobacterium tumefaciens[J].Plant Cell Reports,1994,13:344-348.
[4]Compton M E,Gray D J.Adventitious shoot organogenesis and plant regeneration from cotyledons of tetraploid watermelon[J].Hort Science,1994,29:211-213.
[5]Hakan V.Adventitious shoot organogenesis and plant regeneration from cotyledons of diploid diyarbakyr watermelon(Citrullus lanatus cv.OS.rmeo)[J].Biol,2003(27):101-105.
[6]Helmle J M,Mathe A,Mozsar K,et al.Contribution to the micropropagation of triploid watermelon[J].Acta Horticulture,1992,30:163-168.
[7]刘独臣,房超,刘小俊,等.小西瓜茎尖离体再生体系的建立[J].西南农业学报,2009,21(5):1373-1377.
[8]张全美.西瓜植株高校再生体系建立及四倍体离体诱导研究[D].杭州:浙江大学,2004.
