环氧合酶2-1195G>A基因多态性和肿瘤风险的meta分析
2012-09-20顾玲高天翼宋国齐李瑞许晔琼陈丽萍聂珍琳王书奎
顾玲,高天翼,宋国齐,李瑞,许晔琼,陈丽萍,聂珍琳,王书奎
1.南京师范大学 生命科学学院;2.南京医科大学附属南京第一医院中心实验室,江苏 南京 210006
0 前言
肿瘤是一种与遗传和环境有关的多因素疾病。遗传突变会影响基因的转录以及下游产物的表达水平,基因过表达引起基因拷贝数的增加可能会使机体易发生肿瘤[1]。因此,基因与环境的相互作用在肿瘤的发生过程中发挥了重要作用。人类的环氧合酶2位于1号染色体q25.2~q25.3,长度约7.5 kb[2],包含10个内含子和11个外显子。环氧合酶2作为炎症因子,参与人体的许多病理生理过程,包括炎症发生、细胞增殖、肿瘤发生和血管形成[3-6]。环氧合酶2的过表达可以促进肿瘤血管生成、抑制细胞凋亡、增强肿瘤的侵袭能力及诱导肿瘤的免疫耐受。与此同时,越来越多的动物实验证据表明选择性的环氧合酶2抑制剂可以减少肿瘤发生。目前,人们研究认为,环氧合酶2 -1195G >A的突变导致启动子区增加了c-MYB 的结合位点,c-MYB与此位点的结合增强环氧合酶2的转录和表达活性[7]。近年来,诸多研究结果显示人体许多器官的肿瘤包括淋巴癌[8-9]、结肠癌[10-15]、食道癌[6,16-19]等均发现伴随-1195G > A 的突变,但研究结论却不一致。为验证环氧合酶2-1195G > A与肿瘤的发生是否存在相关性,我们在此收集可靠数据,通过meta分析求证两者之间的关系。
1 资料与方法
1.1 搜索策略
使用Pubmed网站上的主题词“环氧合酶2”“多态性”和“肿瘤”搜索相关文献。搜索的限制条件为英文文献,研究对象为人类。此外,通过对参考文献进行人工搜索以筛选符合条件的文章。若是不同文章研究对象相同或较小的研究样本是较大研究的一部分,我们只选择较大人群的研究和最新的研究。此篇研究的纳入排除标准为:① 环氧合酶2-1195G > A突变与肿瘤的相关研究;② 病例对照研究;③ 可以在文献中提取到有关基因型的数据。
1.2 数据提取
所有数据由两位工作人员分别提取、整理,并核对无误后方可用于数据分析。对于数据中有异议的地方须双方协调达成一致。对于每篇纳入文献,须提取的数据包括:第一作者、发表年限、种群、国家、病例对照组的基因频率。对种群进行分层分析时,我们将其分为亚洲人群、欧洲人群及混合人群,其中混合人群为病例来源一个以上的种群 [6,8-18,20-31]。
1.3 统计方法
计算对照组中G等位基因频率以检验样本的群体代表性。各组之间的一致性采用χ方检验,显著性水准为P<0.05。环氧合酶2与肿瘤之间的相关性用OR值与95%CI表示。总体研究中,我们对AA、AG基因型与野生型GG做了比较;AA合并AG基因型与GG以及AA与AG合并GG的基因型分别进行了对比分析,此外我们还对A突变基因的显性模型和隐形模型分别做了分析。
通过Q检验分析各个文献结果OR值的一致性,结果由P值决定。若P>0.1代表各组之间一致性较好,那么OR则通过固定效应模型求得,否则采用随机效应模型计算[32]。此外,我们对可能存在的混杂因素进行分层初步判断数据异质性的来源。OR值通过Z检验确定其可信度。通过漏斗图和Egger,s检验验证数据是否存在发表偏移[33]。最后对数据进行敏感性分析以确定结果的稳定性。
1.4 主要方法
本文纳入的文献主要运用以下4种测序方法:
(1) 聚合酶链反应和限制性片段长度多态性(PCRRFLP):是用PCR仪扩增目的DNA片段,扩增产物用特异性内切酶消化切割成不同大小片段,经过凝胶电泳,在凝胶成像与分析系统上分辨。不同等位基因的限制性酶切位点分布不同,产生不同长度的DNA片段条带。
(2) Taqman:Taqman荧光探针是一寡核苷酸,两端分别标记一个荧光发射基团和一个荧光淬灭基团。探针完整时,发射基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5’-3’外切酶活性将探针酶切降解,使荧光发射基团和淬灭基团分离,从而荧光监测系统可接收到荧光信号,即每扩增1条DNA链,就有1个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步,从而实现定量。
(3)直接测序法:利用一种DNA聚合酶来延伸结合在待定序列模板上的引物。直到掺入一种链终止核苷酸为止。每一次序列测定由一套4个单独的反应构成,每个反应含有所有4种脱氧核苷三磷酸(dNTP),并混入限量的一种不同的双脱氧核苷三磷酸(ddNTP)。由于ddNTP缺乏延伸所需要的3-OH基团,使延长的寡聚核苷酸选择性地在G、A、T或C处终止。终止点由反应中相应的双脱氧而定。每一种dNTPs和ddNTPs的相对浓度可以调整,使反应得到一组长几百至几千个碱基的链终止产物。它们具有共同的起始点,但终止在不同的核苷酸上,可通过高分辨率变性凝胶电泳分离大小不同的片段,凝胶处理后,可用X-光胶片放射自显影或非同位素标记进行检测。
(4) TDI-FP:以特异探针及荧光素标记的ddNTP为底物,在DNA聚合酶及其缓冲液中循环杂交延伸后,应用荧光偏振技术可以测量平面偏振光激发后产生的水平和垂直的荧光。当荧光染料被平面偏振光激发后,发生荧光偏振,由于大分子比小分子旋转得慢,荧光标记的Acyclo终止碱基掺入寡核苷酸引物下游后偏振值将增加,故由此来确定哪一种荧光标记的Acyclo终止碱基已被掺入整合。
1.5 主要仪器设备

2 结果
2.1 数据特征
按照搜索策略检索文献,最终搜索到120篇文献。根据纳入排除标准:其中有92篇因不涉及-1195G/A突变、2篇为非病例对照研究、1篇无基因型数据被排除。最终余下25篇文献可用于meta分析[6,8-31]。
有关纳入的25篇文献的数据特征,见表1。在这25篇文献中,有10篇文献的研究对象为欧洲人群,12篇为亚洲人群,只有3篇报道为各人群混杂的美国人。各个研究的样本容量范围为107~1300,病例组和对照组的总样本例数为9482和12206。对照组的基因分布频率符合哈温平衡。
2.2 数据质量
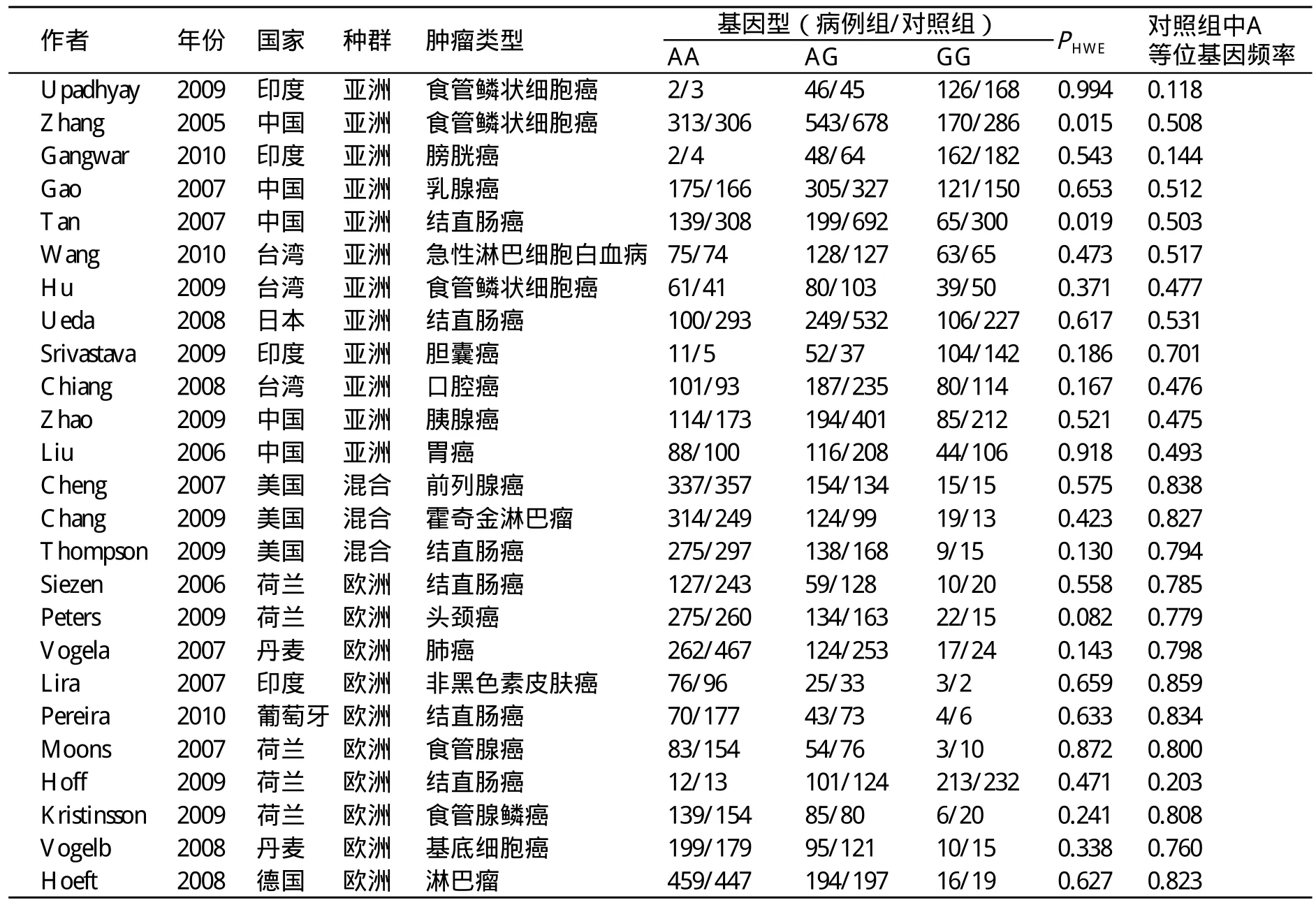
表1 纳入本项研究的所有人群信息
对照组A等位基因的分布频率在不同人群之间存在统计学差异。在亚洲人群中A等位基因频率为0.46,显著低于欧洲人群的0.75和混合人群的0.82。
在总的分析中,我们发现突变基因型与肿瘤发生在各个遗传模型中均存在相关。纯合子基因型AA vs GG(P=0.030,OR=1.23,95% CI:1.03~1.48, P =0.000),杂合子基因 AG vs GG(P=0.007,OR=1.13,95%CI:1.03~1.23,P=0.173), 显性模型 AA/AG vs GG(P=0.026,OR=1.15,95%CI:1.02~1.31,P=0.008),隐性模型 AA vs AG/GG(P=0.020, OR=1.14, 95%CI:1.02~1.28, P =0.000),见图1。对人群进行分层,A/G的突变是亚洲人群发生肿瘤的危险因素,AA vs GG(P=0.001,OR=1.48,95%CI:1.18~1.86,P=0.000),AG vs GG(P=0.000,OR=1.20,95%CI:1.09~1.32,P=0.453),AA/AG vs GG(P=0.000,OR=1.28,95%CI:1.12~1.46,P=0.038),AA vs AG/GG(P=0.003,OR=1.33,95%CI:1.11~1.60,P=0.000)。同样 ,在“其他”组中也发现了相似的结果, AA vs GG(P=0.013,OR=1.31,95%CI:1.06~1.63,P=0.084),AG vs GG(P=0.084,OR=1.12,95%CI:1.00~1.27,P=0.232),AA/AG vs GG(P=0.051,OR=1.15,95%CI:1.02~1.31,P=0.092),AA vs AG/GG(P=0.004,OR=1.22,95%CI:1.07~1.09,P=0.050)。按照肿瘤的类型分层,只在鼻咽癌中发现1个阳性结果。AG vs GG(P=0.018,OR=1.24,95%CI:1.04~1.49,P=0.038),见表2。

图1 Cox-2-1195G>A基因多态性与肿瘤风险的相关性
2.3 异质性分析
总体而言,病例对照组的纯合子基因型AA、杂合子基因AG、显性模型AA/AG、隐性模型AG/GG与纯合子基因型GG之间存在异质性,P值分别为0.000、0.173、0.008、0.000。为了寻找组间异质性来源,我们对数据进行了分层分析,发现异质性主要来源为种群因素而非肿瘤类型的差异。
2.4 敏感性分析
敏感性分析发现文献Kristinsson[18]和Vogel[25]是欧洲人群产生异质性的主要来源,移除这2篇文献后再对数据分析,显示异质性降低。同理,Uede[14]是亚洲人群异质性的来源。通过敏感性分析,发现没有其他文献会影响总OR值,表明数据的结果是可靠的。
2.5 发表偏倚
Begger’s 漏斗图和Egger’s 检验用来检测发表偏倚。漏斗图形状显示所有的基因型无明显不对称性。当用Egger’s 检验检测时,漏斗图无不对称性(AA/AG vs GG, P= 0.117),见图 2。

图2 AA/GG比GG模型发表偏倚检测的Begger’s漏斗图。每一点分别对应1个独立的研究。Log [OR], 为OR值的自然对数。水平线,为平均效应大小。
3 讨论
本次meta分析纳入了25个病例对照研究,包括9428个病例和12206个对照,探讨了环氧合酶2 -1195G> A基因多态性和肿瘤发病风险之间的关系。我们的研究发现所有不同的基因型均能增加肿瘤的发病风险。
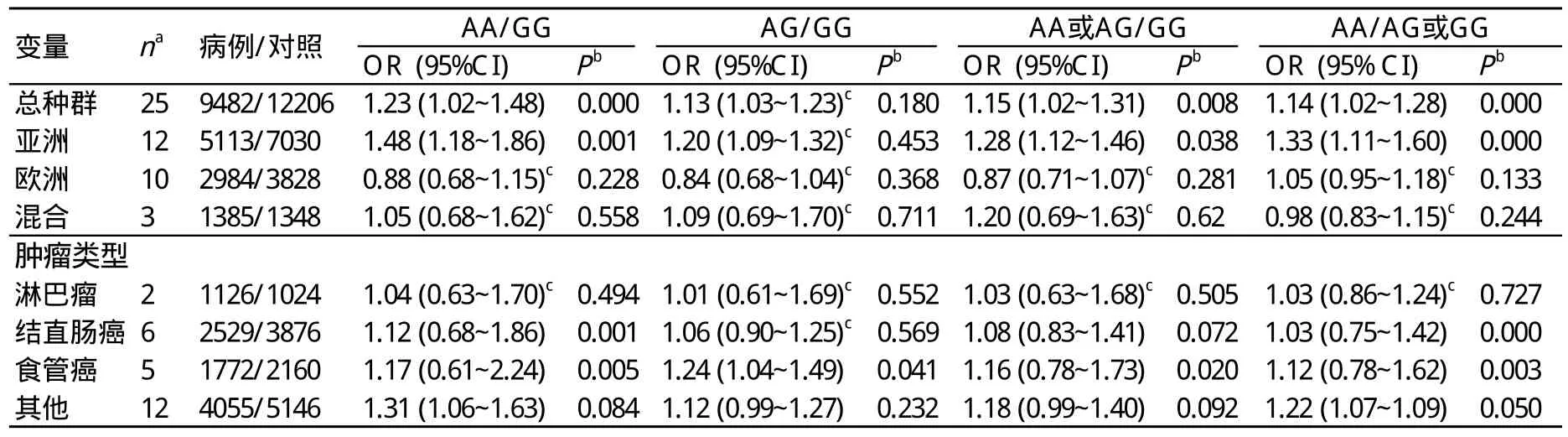
表2 Cox-2-1195G>A基因多态性和肿瘤风险的分层分析
环氧合酶2的过表达可影响肿瘤细胞的肿瘤性基因特征,如诱导抵抗细胞程序性死亡,调节胞外矩阵粘附力,促进血管生成,增加转移潜能和影响抗癌效果等[34-39]。近来,有研究发现基因多态性-1195G>A产生了一个c-MYB结合位点,从而提高了环氧合酶2基因的转录活性。c-MYB是一种在造血系统和胃肠道中有活性的转录因子,作用于多种基因调节细胞分裂、分化和生存过程中的精细平衡[40],进一步证明了-1195G>A的多态性可能改变个体对肿瘤的易感性。但是,也有研究报道了-1195G的等位基因可降低肿瘤的发病风险[13]。为了解决这一矛盾,我们对所有合乎条件的病例对照研究运用meta分析来评估其相关性。
我们的研究发现,-1195G>A的基因多态性在亚洲人群中显示与肿瘤相关,但在欧洲人群和混杂人群中未发现相关性,有遗传背景的种族差异以及居住环境可能是引起这种现象的原因[41]。比如,对照组中亚洲人G等位基因频率为0.46,在欧洲人群中,这一数值却为0.75,随后,独立样本的t检验显示这两者之间存在显著差异。肿瘤是一种多因素的复杂疾病,环氧合酶2-1195G>A变异对肿瘤发展的影响可能还与一些暂未发现的基因有关。入选标准的不同和选择偏倚等因素,也对结果产生影响。上述原因都可以导致结果的不一致性。未见非洲人群-1195G>A的基因多态性研究,所以这种种族差异可能是由于样本量较小产生的。因此,需要更多的研究特别是在非洲人群中的研究来进一步证实,种族差异在基因多态性与肿瘤的发病风险关系中是否起作用。
根据肿瘤类型进行分层分析,结果显示除了AG基因型的食管癌外,-1195基因型并没有增加肿瘤的发病风险。对于-1195A等位基因是否增加食管鳞状细胞癌的风险,各个研究结果间存在着差异[6,42-43]。Guo等[42]、Zhang等[6]、Hu等[19]的研究显示环氧合酶2-1195G>A与增加中国人群中的食管鳞状细胞癌风险明显相关,且环氧合酶2的遗传性变型可能影响食管癌的易感性。但是,Kristinsson等[18]研究指出Cox-2-1195GG基因型和AG/GG基因型增加了食管癌的风险。Moons等[17]论证了只有环氧合酶2AG纯合子能增加食管癌的风险,该结论与我们研究的结果一致。不同的研究结果提示可能有多种因素参与基因多态性的调节。事实上,吸烟[44]、幽门螺旋杆菌[19]、喝酒[45]、非甾体类抗炎药[45-49]及种族差异均与食管癌相关,而且这些因素也可能与环氧合酶2基因型存在交互作用,或者可能是统计的混杂因素。然而,上述的研究中未完全包含这些因素,需要更多的研究进一步探讨各基因型与这些因素之间的关系。在结直肠癌的研究中,只有一个报道[15]了-1195G>A等位基因与中国人群结直肠癌有关,其余研究均未发现阳性相关。鉴于这一亚洲人群中唯一的阳性结果,需要我们进行大样本的研究来验证其结果。在“其他”项的研究中,将一些单个独立的研究合并后,其OR值显示-1195G>A基因多态性与肿瘤发病风险相关。对于不同类型肿瘤,-1195G>A基因多态性可能作用不同。即使相同部位的肿瘤中,由于遗传的基因多态性对肿瘤的影响,再加上一些研究的样本量相对较小,所以一些较小的联系在这些研究中就不会检测出来,从而导致研究结果的不一致性。将单个或不同类型的肿瘤合并后,选择偏倚会对统计结果产生很大的影响。比如,关于淋巴瘤的研究只有两个,样本量有限,所以在对其结果下结论时需谨慎。需要更多前瞻性的研究来评估环氧合酶2过表达与疾病间的关系。
本次meta分析仍存在一定的局限性:① 所有纳入的文献都是英文的,可能漏掉了一些用其他语言发表的合适的研究;② 总结果为各个研究未经矫正的OR值计算而来,一些潜在的混杂因素需被校正(如年龄、性别、吸烟和环境因素等);③ 可能存在误分类而影响分析结果;④ 出版偏倚,可能有合适的研究还未在线发表或出版。
本研究的优势:① 在尽可能多的研究中提取数据,大大增加了本研究的效力;② 符合纳入标准的病例对照研究质量良好;③ 在我们的研究中未发现发表偏倚,使得结果更可信。
总之,本研究发现环氧合酶2-1195G>A基因多态性与总人群的肿瘤发病风险有关,在亚洲人群中更为显著。遗传分布的种族差异起了很大的作用。环氧合酶2-1195G>A基因多态性可能触发环氧合酶2的过表达从而诱导肿瘤的发生。需要进一步运用蛋白水平的研究来阐明基因多态性在肿瘤发生过程中的影响,以及基因-基因、基因-环境间的交互作用等。
[1]Pharoah PD,Dunning AM,Ponder BA,et al.Association studies for finding cancer-susceptibility genetic variants[J].Nat Rev Cancer,2004,4(11):850-860.
[2]Tazawa R,Xu XM,Wu KK,et al.Characterization of the genomic structure, chromosomal location and promoter of human prostaglandin H synthase-2 gene[J].Biochem Biophys Res Commun,1994,203(1):190-199.
[3]Vane JR,Bakhle YS,Botting RM.Cyclooxygenases 1 and 2[J].Annu Rev Pharmacol Toxicol,1998,38:97-120.
[4]Taketo MM.Cyclooxygenase-2 inhibitors in tumorigenesis (Part II)[J].J Natl Cancer Inst,1998,90(21):1609-1620.
[5]Taketo MM.Cyclooxygenase-2 inhibitors in tumorigenesis (part I)[J].J Natl Cancer Inst,1998,90(20):1529-1536.
[6]Dubois RN,Abramson SB,Crofford L,et al.Cyclooxygenase in biology and disease[J].FASEB J,1998,12(12):1063-1073.
[7]Zhang X,Miao X,Tan W,et al.Identification of functional genetic variants in cyclooxygenase-2 and their association with risk of esophageal cancer[J].Gastroenterology,2005,129(2):565-576.
[8]Chang ET,Birmann BM,Kasperzyk JL,et al.Polymorphic variation in NFKB1 and other aspirin-related genes and risk of Hodgkin lymphoma[J].Cancer Epidemiol Biomarkers Prev,2009,18(3):976-986.
[9]Hoeft B,Becker N,Deeg E,et al.Joint effect between regular use of non-steroidal anti-inflammatory drugs,variants in inflammatory genes and risk of lymphoma[J].Cancer Causes Control,2008,19(2):163-173.
[10]Pereira C,Pimentel-Nunes P,Brandao C,et al.COX-2 polymorphisms and colorectal cancer risk: a strategy for chemoprevention[J].Eur J Gastroenterol Hepatol.,2010,22(5):607-613.
[11]Thompson CL,Plummer SJ,Merkulova A,et al.No association between cyclooxygenase-2 and uridine diphosphate glucuronosyltransferase 1A6 genetic polymorphisms and colon cancer risk[J].World J Gastroenterol,2009,15(18):2240-2244.
[12]Siezen CL,Bueno-de-Mesquita HB,Peeters PH,et al.Polymorphisms in the genes involved in the arachidonic acid-pathway,fish consumption and the risk of colorectal cancer[J].Int J Cancer,2006,119(2):297-303.
[13]Hoff JH,te Morsche RH,Roelofs HM,et al.COX-2 polymorphisms-765G-->C and -1195A-->G and colorectal cancer risk[J].World J Gastroenterol,2009,15(36):4561-4565.
[14]Ueda N,Maehara Y,Tajima O,et al.Genetic polymorphisms of cyclooxygenase-2 and colorectal adenoma risk: the Self Defense Forces Health Study[J].Cancer Sci,2008,99(3):576-581.
[15]Tan W,Wu J,Zhang X,et al.Associations of functional polymorphisms in cyclooxygenase-2 and platelet 12-lipoxygenase with risk of occurrence and advanced disease status of colorectal cancer[J].Carcinogenesis,2007,28(6):1197-1201.
[16]Upadhyay R,Jain M,Kumar S,et al.Functional polymorphisms of cyclooxygenase-2(COX-2)gene and risk for esophageal squmaous cell carcinoma[J].Mutat Res,2009,663(1-2):52-59.
[17]Moons LM,Kuipers EJ,Rygiel AM,et al.COX-2 CA-haplotype is a risk factor for the development of esophageal adenocarcinoma[J].Am J Gastroenterol,2007,102(11):2373-2379.
[18]Kristinsson JO,van Westerveld P,te Morsche RH,et al.Cyclooxygenase-2 polymorphisms and the risk of esophageal adeno-or squamous cell carcinoma[J].World J Gastroenterol,2009,15(28):3493-3497.
[19]Hu HM,Kuo CH,Lee CH,et al.Polymorphism in COX-2 modifies the inverse association between Helicobacter pylori seropositivity and esophageal squamous cell carcinoma risk in Taiwan: a case control study[J].BMC Gastroenterol,2009,(9):37.
[20]Zhao D,Xu D,Zhang X,et al.Interaction of cyclooxygenase-2 variants and smoking in pancreatic cancer: a possible role of nucleophosmin[J].Gastroenterology,2009,136(5):1659-1668.
[21]Liu F,Pan K,Zhang X,et al.Genetic variants in cyclooxygenase-2:expression and risk of gastric cancer and its precursors in a Chinese population[J].Gastroenterology,2006,130(7):1975-1984.
[22]Gangwar R,Mandhani A,Mittal RD.Functional polymorphisms of cyclooxygenase-2(COX-2)gene and risk for urinary bladder cancer in North India[J].Surgery,2011,149(1):126-134.
[23]Peters WH,Lacko M,Te Morsche RH,et al.COX-2 polymorphisms and the risk for head and neck cancer in white patients[J].Head Neck Jul,2009,31(7):938-943.
[24]Chiang SL,Chen PH,Lee CH,et al.Up-regulation of inflammatory signalings by areca nut extract and role of cyclooxygenase-2 -1195G>a polymorphism reveal risk of oral cancer[J].Cancer Res,2008,68(20):8489-8498.
[25]Vogel U,Christensen J,Wallin H,et al.Polymorphisms in genes involved in the inflammatory response and interaction with NSAID use or smoking in relation to lung cancer risk in a prospective study[J].Mutat Res,2008,639(1-2):89-100.
[26]Vogel U,Christensen J,Wallin H,et al.Polymorphisms in COX-2,NSAID use and risk of basal cell carcinoma in a prospective study of Danes[J].Mutat Res,2007,617(1-2):138-146.
[27]Lira MG,Mazzola S,Tessari G,et al.Association of functional gene variants in the regulatory regions of COX-2 gene (PTGS2)with nonmelanoma skin cancer after organ transplantation[J].Br J Dermatol,2007,157(1):49-57.
[28]Cheng I,Liu X,Plummer SJ,et al.COX2 genetic variation, NSAIDs,and advanced prostate cancer risk[J].Br J Cancer,2007,97(4):557-561.
[29]Srivastava K,Srivastava A,Pandey SN,et al.Functional polymorphisms of the cyclooxygenase (PTGS2)gene and risk for gallbladder cancer in a North Indian population[J].J Gastroenterol,2009,44(7):774-780.
[30]Gao J,Ke Q,Ma HX,et al.Functional polymorphisms in the cyclooxygenase 2 (COX-2)gene and risk of breast cancer in a Chinese population[J].J Toxicol Environ Health A,2007,70(11):908-915.
[31]Wang CH,Wu KH,Yang YL,et al.Association study of cyclooxygenase 2 single nucleotide polymorphisms and childhood acute lymphoblastic leukemia in Taiwan[J].Anticancer Res,2010,30(9):3649-3653.
[32]Mantel N,Haenszel W.Statistical aspects of the analysis of data from retrospective studies of disease[J].J Natl Cancer Inst,1959,22(4):719-748.
[33]Egger M,Davey Smith G,Schneider M,et al.Bias in meta-analysis detected by a simple, graphical test[J].BMJ,1997,315(7109):629-634.
[34]Chan MW,Wong CY,Cheng AS,et al.Targeted inhibition of COX-2 expression by RNA interference suppresses tumor growth and potentiates chemosensitivity to cisplatin in human gastric cancer cells[J].Oncol Rep,2007,18(6):1557-1562.
[35]Johnson GE,Ivanov VN,Hei TK.Radiosensitization of melanoma cells through combined inhibition of protein regulators of cell survival[J].Apoptosis,2008,13(6):790-802.
[36]Palayoor ST,Arayankalayil MJ,Shoaibi A,et al.Radiation sensitivity of human carcinoma cells transfected with small interfering RNA targeted against cyclooxygenase-2[J].Clin Cancer Res,2005,11(19 Pt 1):6980-6986.
[37]Philip M,Rowley DA,Schreiber H.Inflammation as a tumor promoter in cancer induction[J].Semin Cancer Biol,2004,14(6):433-439.
[38]Zrieki A,Farinotti R,Buyse M.Cyclooxygenase inhibitors down regulate P-glycoprotein in human colorectal Caco-2 cell line[J].Pharm Res,2008,25(9):1991-2001.
[39]van Rees BP,Ristimaki A.Cyclooxygenase-2 in carcinogenesis of the gastrointestinal tract[J].Scand J Gastroenterol,2001,36(9):897-903.
[40]Ramsay RG,Barton AL,Gonda TJ.Targeting c-Myb expression in human disease[J].Expert Opin Ther Targets,2003,7(2):235-248.
[41]Hirschhorn JN,Lohmueller K,Byrne E,et al.A comprehensive review of genetic association studies[J].Genet Med,2002,4(2):45-61.
[42]Cao Y,Prescott SM.Many actions of cyclooxygenase-2 in cellular dynamics and in cancer[J].J Cell Physiol,2002,190(3):279-286.
[43]Guo Y,Zhang X,Tan W,et al.Platelet 12-lipoxygenase Arg261Gln polymorphism: functional characterization and association with risk of esophageal squamous cell carcinoma in combination with COX-2 polymorphisms[J].Pharmacogenet Genomics,2007,17(3):197-205.
[44]Zhang ZF,Kurtz RC,Marshall JR.Cigarette smoking and esophageal and gastric cardia adenocarcinoma[J].J Natl Cancer Inst,1997,89(17):1247-1249.
[45]Roth MJ,Guo-Qing W,Lewin KJ,et al.Histopathologic changes seen in esophagectomy specimens from the high-risk region of Linxian, China: potential clues to an etiologic exposure[J].Hum Pathol,1998,29(11):1294-1298.
[46]DerSimonian R,Laird N.Meta-analysis in clinical trials[J].Control Clin Trials,1986,7(3):177-188.
[47]Buskens CJ,Van Rees BP,Sivula A,et al.Prognostic significance of elevated cyclooxygenase 2 expression in patients with adenocarcinoma of the esophagus[J].Gastroenterology,2002,122(7):1800-1807.
[48]Giardiello FM,Offerhaus GJ,DuBois RN.The role of nonsteroidal anti-inflammatory drugs in colorectal cancer prevention[J].Eur J Cancer,1995,31A(7-8):1071-1076.
[49]Thun MJ.Aspirin,NSAIDs,and digestive tract cancers[J].Cancer Metastasis Rev,1994,13(3-4):269-277.
