不同检测方法检测免疫球蛋白轻链比值的比较
2012-09-20王召晓
王召晓
江苏省赣榆人民医院,江苏 赣榆 222100
0 前言
免疫球蛋白(immunoglobulin)主要存在于血浆中,也见于其他体液、组织和一些分泌液中。人体血浆内的免疫球蛋白大多数存在于丙种球蛋白(γ-球蛋白)中。免疫球蛋白可以分为IgG、IgA、IgM、IgD、IgE等5类。Ig分子的基本结构由4条肽链组成,即由2条相同的分子量较小的轻链(light chain,L链)和2条相同的分子量较大的重链(heavy chain,H链)组成[1]。L链与H链是由二硫键连接形成1个四肽链分子,称为Ig分子的单体,是构成免疫球蛋白分子的基本结构。
L链大约由214个氨基酸残基组成,通常不含碳水化合物,分子量约为24kD。每条L链含有2个由链内二硫键内二硫所组成的环肽。L链共有两型:kappa(κ)与lambda(λ)[2],同一个天然免疫球蛋白分子上L链的型总是相同的。正常人血清中的κ:λ约为2:1。过多游离的L链片段在血清或尿液中大量出现称为L链病(Light Chain Disease,LCD);一旦免疫球蛋白L链在全身组织中沉积,引起相应的临床表现为L链沉积病(Light Chain Deposition Disease,LCDD)。约2/3的LCDD患者合并多发性骨髓瘤等慢性淋巴细胞白血病。而在尿中的L链增多时,多表明肾脏受损严重。慢性肾病患者的血、尿中L链含量常表现出异常,但κ:λ的比值常保持在正常范围内。临床常通过速率散射比浊法监测血尿中L链含量的变化来对L链病进行诊断[3]。
流式细胞术(Flow Cytometry,FCM)是一种用荧光剂对细胞特定成分染色,利用流式细胞仪对处在快速、直线、流动状态中的单细胞或生物颗粒进行多参数、快速定量分析,并能对特定群体加以分选的现代细胞分析技术[4]。FCM能够通过特异性表面标志物对B细胞表面表达的L链进行测定[3,5-11],该方法可与速率散射比浊法一起用于临床相关疾病的诊断,本次研究通过比较FCM法和速率散射比浊法,检测免疫球蛋白L链κ/λ比值是否有一致性,进一步探讨二者的临床应用价值。
1 实验材料
1.1 研究对象
32例患者为2009~2011年间我院已确诊病人,其中12例为慢性淋巴细胞性白血病患者,男性2例,女性10例,年龄45~77岁,平均58.4岁;20例原发性肾病综合征患者,男性12例,女性8例,年龄34~71岁,平均47.3岁。
1.2 试剂与仪器
1.2.1 试剂
① 美国Beckman Coulter 公司 Immage特种蛋白仪原装试剂:κL链检测试剂盒(Lot:446440),λL链检测试剂盒(Lot:446470),稀释液、缓冲液、标准品及质控品等均为该公司提供的进口配套试剂;② 美国B-D公司FACSCalibur 流式细胞仪其原装试剂:B-D Oncomark Anti-Kappa/Anti-Lambda/CD19 Reagents(Lot:44045)、IgG1b-FITC、IgG2a-PE、CD19-PerCP,鞘液、溶血素及质控品等均为该公司提供的进口配套试剂。
1.2.2 主要仪器
美国Beckman Coulter公司Immage特种蛋白仪和美国B-D公司FACSCalibur流式细胞仪。
2 实验方法
2.1 实验原理
2.1.1 FCM原理
将待测细胞染色后制成单细胞悬液。用一定压力将待测样品压入流动室,不含细胞的细胞缓冲液在高压下从鞘液管喷出,鞘液管入口方向与待测样品流成一定角度,这样,鞘液就能够包绕着样品高速流动,组成一个圆形的流束,待测细胞在鞘液的包被下单行排列,依次通过检测区域,流式细胞仪通常以激光作为发光源。经过聚焦整形后的光束,垂直照射在样品流上,被荧光染色的细胞在激光束的照射下,产生散射光和激发荧光。这2种信号同时被前向光电二极管和90°方向的光电倍增管接收。光散射信号在前向小角度进行检测,这种信号基本上反映了细胞体积的大小;荧光信号的接受方向与激光束垂直,经过一系列双色性反射镜和带通滤光片的分离,形成多个不同波长的荧光信号。这些荧光信号的强度代表了所测细胞膜表面抗原的强度或其核内物质的浓度,经光电倍增管接收后可转换为电信号,再通过模/数转换器,将连续的电信号转换为可被计算机识别的数字信号。计算机把所测量到的各种信号进行计算机处理,从而获得所需信息。
2.1.2 速率散射比浊法原理
将可溶性抗原与相应抗体相结合,在二者比例合适时,在特殊缓冲液中,它们快速形成一定大小的抗原抗体复合物,使反应液出现浊度,利用激光照射液相中颗粒、检测光折射和衍射而形成的散射光强度来定量待测物的浓度。
2.2 实验方法
2.2.1 速率散射比浊法
血清及尿液中的κ、λL链的测定按美国Beckman Coulter 公司 Immage特种蛋白仪的说明书进行操作,采用速率散射比浊法来检测L链κ、λ的含量,并计算κ/λ比值。
2.2.2 FCM法
用淋巴细胞分离液分离外周血单个核细胞(PBMCs),以无菌生理盐水洗涤3次,备用。取10μL Anti-Kappa/Anti-Lambda/CD19试剂加入流式专用试管底部,对照管为 10μL CD19-PerCP、10μL IgG2a-PE和 10μL IgG1b-FITC,每管中加入洗涤后的PBMCs 50μL,混匀后,置室温避光反应15 min;加入1 mL溶血素,混匀,室温避光溶血10 min,以裂解残留的红细胞。以1500转/min离心5 min,弃上清液,加入生理盐水1 mL洗涤1次,再以1500转/min离心5min,弃去上清液。加入250μL 1%多聚甲醛,混匀后用流式细胞仪检测。以Cell Quest软件收集和分析数据,以CD19阳性细胞为所分析的目标细胞群,分析其中κ与λ表达状况。κ和λ的表达率为其阳性细胞占总B淋巴细胞的百分比。并计算κ/λ比值。
2.3 统计学分析
采用SPSS17.0软件进行统计分析,结果用 ±S表示,两组之间比较采用双侧T检验,检验水平以P<0.05为差异有统计学意义。
3 实验结果
通过对32例患者外周血B淋巴细胞膜上κ和λ表达率的测定、血清和尿液中免疫球蛋白游离L链Kappa和Lambda含量的测定,将所得数据进行处理。根据文献,B淋巴细胞膜上κ/λ的参考范围为1.03~1.59[12],血清中L链κ/λ的参考范围为1.53~3.29[13],尿液中L链κ/λ的参考范围为1.40~2.76[14]。将κ/λ值为正常的结果设为正常,低于参考范围的结果设为异常Ⅰ,高于参考范围的结果设为异常Ⅱ。对分组数据进行Kappa一致性检验,结果见表1~3。
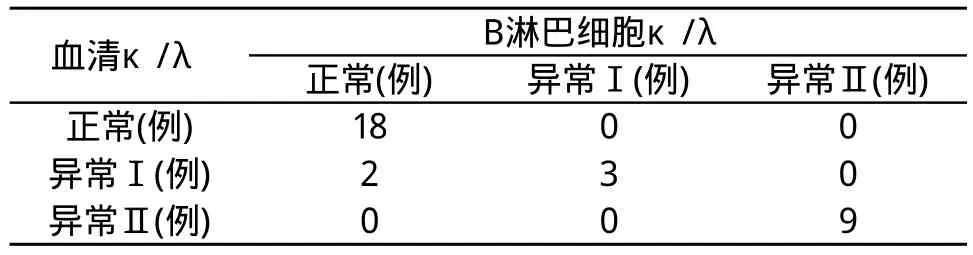
表1 B细胞组和血清组κ/λ比值一致性的比较
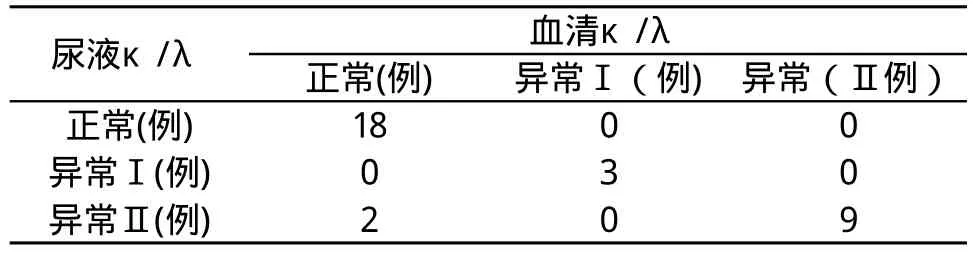
表2 血清组和尿液组κ/λ比值一致性的比较
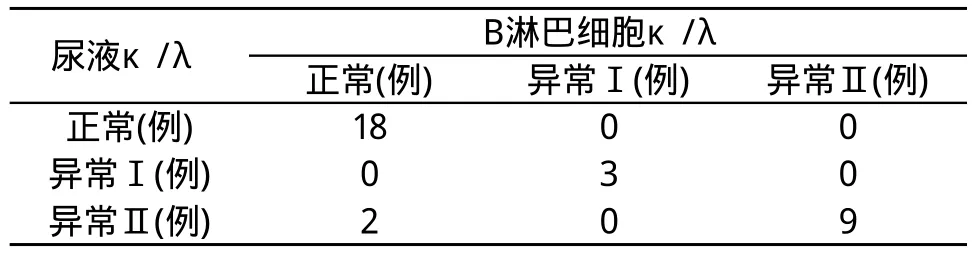
表3 B细胞组和尿液组κ/λ比值一致性的比较
3个不同组别的标本两两分组,分别进行检测方法的一致性比较。结果显示,速率散射比浊法与FCM检测技术对于κ/λ比值,在检测结果上一致性极强。
4 讨论
免疫球蛋白由1对L链及1对H链组成,其中L链有κ、λ2种,每种免疫球蛋白含κL链或含λL链。骨髓B淋巴细胞在发育至前B细胞阶段时出现IgL链基因重排,待细胞成熟后,IgL链可表达于细胞表面。健康人B淋巴细胞膜表面,有一部份表达κL链,另一部份表达λL链, κ/λ的参考范围为1.31±0.28。肿瘤性B细胞来源于1个共同的B细胞株,其主要特征为IgL链限制性,即全部肿瘤性B细胞仅表达κL链或者λL链,也称为克隆性表达。κ/λ比例的异常,成为反应性B淋巴细胞增生和肿瘤性慢性B淋巴细胞增生的鉴别诊断的有效指标[15-16]。
正常血清中存在一定量的多克隆L链,即κ、λ两种L链。血清中的L链转入到肾脏, 约10%在肾小管内分解代谢, 80%回收, 由体内巨噬细胞降解, 10%随尿排出。当机体受到遗传、环境、病毒感染、内分泌调节等多种因素刺激, 影响机体免疫应答, 致使机体免疫应答调节的关键基因过度表达, 可使T、B 淋巴细胞功能紊乱, 浆细胞克隆分泌增加。由于浆细胞合成的Ig的L链速度比H链速度快,组装Ig 增多, κ、λL链分泌相对异常增多, 因此血清中κ、λL链水平也同步增加。
L链在肾脏从肾小球滤过,约95%滤过的L链在近肾小管又被重吸收,并被肾小管上皮细胞分解。当肾脏功能受损时,若尿中L链水平升高,在排除免疫增殖性疾病情况下,其表示肾小管受损、重吸收功能下降, 因此尿L链水平的测定能够反映肾小管损伤程度。
在我们的研究中,B细胞组和血清组的比较,30例(93.75%)κ/λ的结果相同,2例(6.25%)κ/λ的结果不同,表现为比值下降。B细胞组和尿液组的比较、血清组和尿液组的比较中,均出现30例(93.75%)κ/λ的结果相同,2例(6.25%)κ/λ的结果不同,表现为比值上升。其原因可能与κL链分子量小,易通过肾小球虑过膜,从尿中排出的速度比λL链快, 所以血清中λL链含量相对增高、κ/λ比值下降。此结果与国内学者报告基本一致[17]。
FCM检测采用的试剂是单克隆荧光抗体,特异性强,因此多用于鉴别B淋巴细胞是否有克隆性表达。血清和尿液中游离κ、λL链的测定,是浆细胞性疾病、肾脏疾病等的诊断指标之一[18]。在本实验研究中,结果显示2种检测方法的结果在κ/λ比值上有极强的一致性。
在L链检测中,FCM检测技术与速率散射比浊法相比,因其更多的为手工操作,因此在实际工作中的应用不如速率散射比浊法普及。但随着FCM的不断发展和完善,更多高灵敏度、高特异性的标记物的发现,对于血清和尿液中κ/λ比值异常的标本,我们建议同时检测B淋巴细胞膜上的κ/λ比值,以确定该标本是否有B淋巴细胞克隆性表达的存在。
[1]Pier GB,Lyczak JB,Wetzler LM.Immunology,infection,and immunity[M].USA:ASM Press,2004.
[2]Fukushima PI,Nguyen PK,O'Grady P,et al.Flow cytometric analysis of kappa and lambda light chain expression in evaluation of specimens for B-cell neoplasia[J].Cytometry,1996,26(4):243-252.
[3]Batata A,Shen B.Diagnostic value of clonality of surface immunoglobulin light and heavy chains in malignant lymphoproliferative disorders[J].Am J Hematol,1993,43(4):265-270.
[4]Loken MR.Immunofluorescence techniques in flow cytometry and sorting (2nd ed.)[M].USA:Wiley,1990:341-353.
[5]Almasri NM,Zaer FS,Iturraspe JA,et al.Contribution of flow cytometry to the diagnosis of gastric lymphomas in endoscopic biopsy specimens[J].Mod Pathol,1997,10(7):650-656.
[6]Ibrahim RE,Teich D,Smith BR,et al.Flow cytometric surface light chain analysis of lymphocyte-rich effusions. A useful adjunct to cytologic diagnosis[J].Cancer,1989,63(10):2024-2029.
[7]Liendo C,Danieu L,Al-Katib A,et al.Phenotypic analysis by flow cytometry of surface immunoglobulin light chains and B and T cell antigens in lymph nodes involved with non-Hodgkin's lymphoma[J].Am J Med,1985,79(4):445-454.
[8]Picker LJ,Weiss LM,Medeiros LJ,et al.Immunophenotypic criteria for the diagnosis of non-Hodgkin's lymphoma[J].Am J Pathol,1987,128(1):181-201.
[9]Geary WA,Frierson HF,Innes DJ,et al.Quantitative criteria for clonality in the diagnosis of B-cell non-Hodgkin's lymphoma by flow cytometry[J].Mod Pathol,1993,6(2):155-161.
[10]Harris NL,Poppema S,Data RE.Demonstration of immunoglobulin in malignant lymphomas.Use of an immunoperoxidase technic on frozen sections[J].Am J Clin Pathol,1982,78(1):14-21.
[11]叶树俊,张葵,陈军浩,等.流式细胞术检测B淋巴细胞表面免疫球蛋白L链及临床意义[J].临床检验杂志,2007,25(6):432-434.
[12]夏永泉,王贤,张葵.不同检测方法检测免疫球蛋白轻链比值的比较[J].国际检验医学杂志,2012,(8):971.
[13]程艳杰,郝赪妍,朱鸿,等.尿蛋白谱及尿L链水平的检测在慢性肾脏损伤中的诊断意义[J].大连医科大学学报,2010,32(5):580-585.
[14]Costa E S,ArroyoM E,Pedreira C E,et al.A new automated flow cytometry data analysis approach for the diagnostic screening of neoplastic B-cell disorders in peripheral blood samples with absolute lymphocytosis[J].Leukemia,2006,20(7):1221-1230.
[15]Chizuka A,Kanda Y,Nannya Y,et al.The diagnostic value of kappa /lambda ratios determined by flow cytometric analysis of biopsy specimens in B-cell lymphoma[J].ClinLab Haematol,2002,24(1):33-36.
[16]曹先伟,鞠北华,宋丙杭.血清中游离κ、λL链水平测定[J].实用临床医学,2004,5(1):13-15.
[17]扶云碧,卢汉波.血(尿)游离L链升高的临床意义[J].国外医学临床生物化学与检验学分册,2002,23(3):151-152.
