离心—冷冻法制备梯度孔结构的真皮支架
2012-09-18王明波谭荣伟佘振定
王明波,王 俊,谭荣伟,佘振定
(1.深圳清华大学研究院生物医用材料及植入器械重点实验室,广东深圳 518057;2.深圳兰度生物材料有限公司,广东深圳 518057)
离心—冷冻法制备梯度孔结构的真皮支架
王明波1,王 俊1,谭荣伟2,佘振定1
(1.深圳清华大学研究院生物医用材料及植入器械重点实验室,广东深圳 518057;2.深圳兰度生物材料有限公司,广东深圳 518057)
胶原基真皮支架的结构和性能受多方面因素影响,比如除胶原外的其他主要材料、支架的孔径和孔隙率以及交联度等.采用离心—冷冻法结合冷冻干燥法制备梯度孔结构的真皮支架,表征支架的孔径和孔隙率,并以细胞培养检验其生物相容性,其中采用扫描电镜对上中下3部分支架结构及孔径进行表征,并通过细胞培养生长实验检测该支架材料的细胞粘附性能,以达到表征离心力的影响.结果显示,离心力对支架的微观结构产生了影响,支架的致密程度从下到上有明显的不同,具体表现在孔径上:上层孔径52±27.8μ m,中层孔径57±8.7μ m,下层孔径49±40.4μ m.同时,细胞粘附实验表明,致密的下层更适合细胞的粘附生长.
真皮支架;离心力;生物相容性
0 引 言
皮肤缺损是一类常见但未得到根本性解决的古老医学问题,而由烧伤、机械损伤和各类疾病等造成的皮肤缺损患者每年达上千万,因此,探索治疗皮肤缺损的方法寻找合适的材料成为一个倍受研究人员关注的课题,而研制出具有生物活性的皮肤代替物,即皮肤再生支架,来永久性地代替受损皮肤在科研和临床上都具有十分重要的意义[1-2].皮肤组织主要分为表皮层、真皮层和皮下组织3大部分.真皮层未缺损时,表皮层可以自动修复,但一旦真皮层缺损,表皮层则无法再生.可见,真皮层的再生是皮肤组织再生的前提和核心.组织工程技术的发展[3],为皮肤缺损修复研究开辟了一条新的路径,近年来,研究人员采用各类可降解材料作为支架材料,已制备出具有永久替代性并引导创伤面组织再生的人工真皮[4-6].
目前,各种各样的高分子材料被用作组织工程材料[7].皮肤真皮组织中,胶原是主要的细胞外基质,以胶原为基体材料构建人工真皮是较理想的研究方案[8-10].由于胶原作为一种具有良好的生物相容性的可降解材料,而被广泛应用于组织工程及医药领域中[11-13].胶原基真皮支架的构建方法有很多种,其中,基于热致相分离原理的冷冻干燥法是最常见也是用于本实验的方案.然而,真皮支架制备过程中,支架的第二组分、支架孔径和孔隙率、支架厚度以及交联度等因素对支架的各种性能都起着至关重要的影响,其中孔径和形貌对其生物活性有比较大的影响[14].Doillon等[15]通过调节冷冻干燥温度及制备过程中pH值获取理想的孔径和形貌结构;Garg等[16]讨论了第二组分对胶原基真皮支架结构的影响.在此基础上,本研究旨在讨论离心力在制备过程中对支架结构形貌以及性能产生的影响,同时,通过对上中下3层结构进行相应形貌和生物性能表征得出相关结论.
1 实 验
1.1 试剂与仪器
实验所用的试剂包括:胶原(质量浓度为0.37%),透明质酸(HA),胶原酶(SigmaC0130),冰乙酸(分析纯),其他所用试剂均为分析纯.
实验所用的仪器包括:高速离心机(SIGMA 3-18K),冷冻干燥机(Scientz-10N),-80℃冰箱(SANYO/MDF-32V),扫描电子显微镜(Mira3 Xmh,TESCAN),恒温摇床(FLY-100B).
1.2 真皮支架的制备
胶原/透明质酸真皮支架采用采用离心—冷冻法结合冷冻干燥法制备,其制备过程为:称量胶原蛋白0.46 g于100 mL烧杯中,加入0.05 mol/L醋酸溶液49.54 g,搅拌溶解24 h(搅拌速度控制在400~500 rpm);配制1.5%的透明质酸水溶液,并在搅拌的过程中,将透明质酸水溶液慢速加入上述胶原溶液中;复合溶液置于10 Pa、室温下真空箱中脱泡10 min,装入50 mL离心管中,5 000 rpm、-20℃条件下离心15 min,取出,放入-80℃冰箱进行冷冻3 h,开启冷冻干燥机进行制冷至-45℃;取出样品放入冷冻干燥机,抽真空至10 Pa,冷冻干燥72 h得到胶原基真皮结构.
1.3 真皮支架材料孔隙率测定
用手术刀从所制备的真皮支架上切取上中下三部分,制成3个0.5 cm3平行样的样品,称量其重量G1.然后,分别浸泡在装有异丙醇的培养皿中,异丙醇没过样品,使样品充分吸收异丙醇,浸泡12、24、48 h 3个时间段.将饱和试样放进铜丝网篮,悬挂在注满异丙醇的烧杯中,称量饱和试样在异丙醇中的重量G3.从烧杯中取出试样,用饱含异丙醇的多层纱布将试样表面过剩的异丙醇擦掉(注意不压到试样,从而吸出空隙中的异丙醇溶液),迅速称量饱和试样在空气中的重量G2.

根据下列公式(1)和公式(2)分别计算试样的显孔隙率和容重.式中,q为试样的显孔隙率,DV为试样的容重,G1为干燥支架试样重量,G2为饱和支架试样在空气中质量,G3为含饱和异丙醇的支架试样重量.
1.4 真皮支架孔结构表征
分别取干燥的真皮支架试样上中下3组分直接粘在制样模具导电胶上,真空条件下喷金,用SEM(Mira3 Xmh,TESCAN)在5.0 kV电压下观察其形貌.
1.5 真皮支架材料的细胞黏附实验
细胞黏附实验的具体过程是:
1)分别取真皮支架试样上中下3组分4份铺于培养皿中,75%酒精浸泡过夜,用PBS洗涤3次,将材料放于铺有1%琼脂糖的24孔板中.
2)将35 μ L ROS1728大鼠成骨细胞悬液滴加至试样表面,含5×104个细胞,细胞代数为第21代,培养3 h后每孔加入1 mL培养液,培养3 d后将试样移至新孔 ,用PBS 洗 3次.取 10 μ L Calcein-AM 储备液和15 μ L PI储备液至5 mL PBS中配成荧光染液,利用Calcein-AM和PI分别对活细胞和死细胞染色.每份材料加入1mL染色液,37℃孵育15min.吸去染色液,用PBS洗3次.进行荧光观察.绿色荧光为活细胞,红色荧光为死细胞.
2 结 果
2.1 真皮支架形貌结构
真皮支架上中下3组分的SEM形貌图如图1所示.

图1 真皮支架上中下3组分的SEM形貌图
从图1可以明显看出,真皮支架的中层结构孔径比上下层都大一些,结构比较疏松,成孔成丝的结构占大部分,而上下层支架结构比较成片状.同时,从上中下3层结构的100倍SEM图可以看出,从上到下层支架结构越发交织错乱,说明离心力使得支架结构交联,进而得到致密的结构.
2.2 真皮支架孔径分析
真皮支架孔径分布如图2所示.
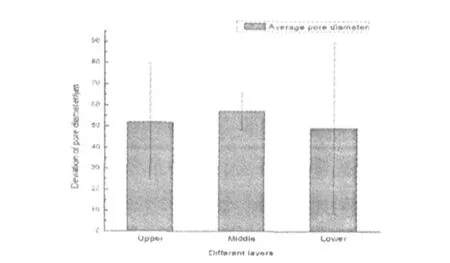
图2 真皮支架结构上中下3层孔径分布
从图2可看出,在离心力作用下所得到的真皮支架的中层结构孔径最大,而底层结构相对比较致密,同时中间层的孔径分布较为狭窄.
2.3 真皮支架结构孔隙率分析
真皮支架结构孔隙率和容重如图3与图4所示.

图3 浸泡不同时间段后的真皮支架3层的孔隙率

图4 浸泡不同时间段后的真皮支架3层的容重
由图3可看出,在胶原质量分数不变的情况下,离心力使胶原真皮支架产生孔径梯度,使得支架材料中部显孔隙率相对较小,而底部的显孔隙率相对较大.而从图4可看出,真皮支架容重从上层至下层呈增加趋势,说明从上到下支架层壁的厚度呈增加趋势.同时,支架材料浸泡在不同时间段后所呈现的规律基本不变,说明在实验过程中,浸泡时间对支架材料结构的孔隙率和容重没有直接影响.
2.4 细胞粘附实验
成纤维细胞在真皮支架上中下3层结构上培养72 h后的荧光染色图如图5所示.
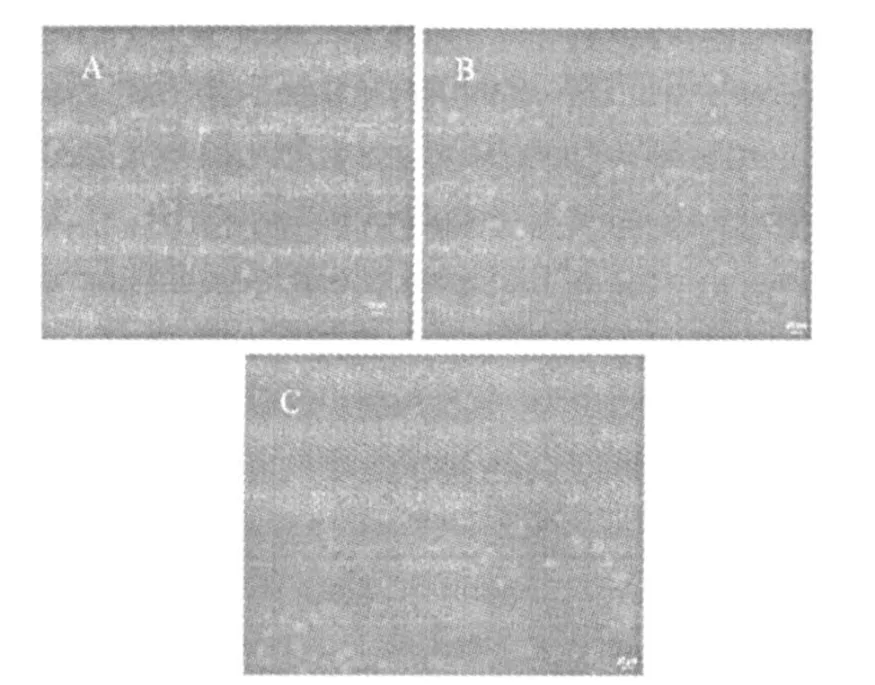
图5 真皮支架结构上中下3层上成纤维细胞黏附生长情况荧光图
从图5可看出,A、B、C图中都可以看到材料表面有绿色的荧光,这些是存活的细胞,表明材料能促进细胞黏附生长,细胞相容性良好,上中下3层的细胞密度没有明显差异,说明该梯度结构支架各层均适宜细胞的黏附生长.
3 结 语
采用离心—冷冻法结合冷冻干燥法所制得的真皮支架,由于制备过程中离心力的影响,支架上中下3层呈现出不同的三维结构,具体表现在孔径上:上层孔径 ,52 ±27.8 μ m ,中层孔径 ,57 ±8.7 μ m ,下层孔径 ,49±40.4 μ m ,其中 ,下层结构相对致密,同时孔径较小,但孔径分布较为分散;而中层最为用孔壁的分析结果,孔径大,但孔径大小较为集中.支架细胞黏附实验表明,支架各层结构均利于细胞的粘附生长.本研究证实了真皮支架在制备过程中离心力产生了梯度孔结构,但支架各层的生物相容性未产生显著差异,均有良好的生物相容性.研究也证实,离心—冷冻法结合冷冻干燥法是一种制备梯度孔径结构材料的一种有效方法.
:
[1]Griffith L G,Naughton G.Tissue Engineering—Current Challenges and Expanding Opportunities[J].Science,2002,295(5557):1009-1014.
[2]Hutmacher D,Goh J,Teoh S.An Introduction to Biodegradable
Materials for Tissue Engineering Applications[J].Annals of the Academy of Medicine,Singapore,2001,30(2):183.
[3]Freed L E.Biodegradable PolymerScaffolds for Tissue Engineering[J].Nature Biotechnology ,1994,12(7):689-693.
[4]Mcinlf B,Sheep W.Design Principles for Composition and Performance of Cultured Skin Substitutes[J].Burns,2001.15(27):523-533.
[5]Ma L.Collagen/Chitosan PorousScaffolds with ImprovedBiostability for Skin Tissue Engineering[J].Biomaterials,2003,24(26):4833-4841.
[6]Widmer M S,Mikos A.Fabrication of Biodegradable Polymer Scaffolds for Tissue Engineering[M].New York:Elsevier Sciences,1998.
[7]Eisenbarth E.Biomaterials for Tissue Engineering[J].Advanced Engineering Materials,2007,9(12):1051-1060.
[8]Chevallay B,Herbage D.Collagen-based Biomaterials as3D Scaffold for Cell Cultures:Applications for Tissue Engineering and Gene Therapy[J].Medical and Biological Engineering and Computing ,2000,38(2):211-218.
[9]Ma J.APreliminary in VitroStudy on theFabrication and TissueEngineering Applications of a Novel Chitosan Bilayer Material as a Scaffold of Human NeofetalDermal Fibroblasts[J].Biomaterials,2001,22(4):331-336.
[10]Gao C.Materials and Structure Design of Artificial Dermis Equivalent Based on Collagen[J].Journal of Biomedical Engineering,2002,19(1):127.
[11]Park J S.Characterization and Structure Analysis of PLGA/Collagen Nanofibrous Membranes by Electrospinning[J].Journal of Applied Polymer Science,2012,125(S2):E595-E603.
[12]Schofer M D.Functionalisation of PLLANanofiber ScaffoldsUsing a Possible Cooperative Effect Between Collagen Type I and BMP-2:Impact on Colonization and Bone Formation in Vivo[J].Journal of MaterialsScience:Materials inMedicine,2012 ,22(7):1753-1762.
[13]Ferreira A M.Collagen for Bone Tissue Regeneration[J].Acta Biomaterialia,2012,8(9):3191-3200.
[14]Dagalakis N.Design of an Artificial Skin.Part III.Control of Pore Structure[J].Journal of Biomedical Materials Research,1980,14(4):511-528.
[15]Doillon C.Collagen Based Wound Dressings:Control of the Pore Structure and Morphology[J].Journal of Biomedical Materials Research,1986,20(8):1219-1228.
[16]Garg A K.Effect of Proteoglycans on Type I Collagen Fibre Formation[J].Biomaterials,1989,10(6):413-419.
Dermis Scaffold of Gradient Pore Structure Fabricated by Centrifugal-freeze Method
WANGMingbo1,WANGJun1,TAN Rongwei2,SHE Zhending1
(1.Key Laboratory for Biological Medical Material and Implantable Device,Research Institute of Tsinghua University in Shenzhen,Shenzhen 518057,China;2.Shenzhen Lando Biological Material Limited Company,Shenzhen 518057,China)
There are many factors controlling the microstructure and properties of collagen-based dermis scaffold,such as other main materials,the pore diameter and porosity aswell as the cross-linking density.Dermis scaffold of gradient pore structure was fabricated by combination of centrifugal-freeze method and freeze-drying method.The pore diameter and porosity of the scaffoldwere investigated by scanning electron microscope.Biocompatibility and cell adhesion properties of the scaffold were tested by experiment of cell culture growth to characterize the influence of centrifugal force.The results show that the centrifugal force has important influence on the microstructure of dermis scaffold with different degree of densification from the bottom up on the three layers and the pore diameters are different from each other,like the upper is 52±27.8 μ m ,the middle is 57 ±8.7 μ m and the lower is 49 ±40.4 μ m.Moreover,the results of cell adhesion experiment show that the lower layer is more suitable for the adhesion and growth of cell among the three different structures.
dermis scaffold;centrifugal force;biocompatibility
R318.08
A
1004-5422(2012)04-0305-04
2012-09-28.
广东省教育部产学研结合项目(2010B090400324),深圳市生物、互联网、新能源产业发展专项基金(CSB2010C5260047A)资助项目.
王明波(1976—),男,博士,副主任研究员,从事生物活性因子及药物缓释与相关材料研究.
