施氮对海滨锦葵盐胁迫下生物量分配特征及其关联的影响1)
2012-09-18任燕燕连俊方闫道良
任燕燕 连俊方 闫道良
(浙江农林大学,临安,311300)
盐胁迫所引起的水分胁迫和离子毒害等,对植物的生长、植被分布和农业生产均造成了较大的影响。为开发利用我国后备土地资源—盐碱地,引种耐盐经济植物是最有效的途径。海滨锦葵是一种多年生宿根植物,具较强的耐盐性,且其宿根的更新周期长,适合在沿海滩涂大面积种植,改造盐碱地。引种试验表明,海滨锦葵具有较高的综合开发利用前景[1-2]。
氮营养缺乏可能是盐碱地区植物生长的主要限制因素之一。研究表明,施氮在一定程度上提高了逆境下(干旱)导致的水分胁迫对植物生长的影响[3]。对于盐生植物而言,施氮对其在逆境下的生长的影响研究较少。如盐生植物囊果碱蓬(Suaeda physophora Pall),硝态氮增加其高盐胁迫下地上部有机氮,改善了植株的营养状况和渗透调节,提高了囊果碱蓬的耐盐能力。本文以盐生植物海滨锦葵为材料,研究了施氮对盐胁迫下海滨锦葵的生物量特征及其施氮前后生物量关联的影响,为在盐碱地科学栽培经济海滨锦葵,提高其产量提供参考。
1 材料与方法
选取完好饱满的海滨锦葵种子经表面消毒后于温开水中浸泡2 h,播种于口径为12 cm,高为11 cm的塑料钵内,苗钵放在规格一致的塑料碗内,钵内基质为河沙和珍珠岩按体积比3∶1配比。出苗后每盆保留健壮一致小苗6棵,待小苗有3~4片真叶完全展开后,分别用 50、150、250 mmol/L NaCl(分别记为 SC1,SC2,SC3)和 50、150、250 mmol/L NaCl+15 mmol/L NH4NO3(分别记为 SC-A1,SC-A2,SC-A3)处理,每塑料碗中加入处理液100 mL,并同时添加不含NH4NO3的改良Hoagland营养液10 mL,此时苗钵底部大约1.5 cm高度处于处理液中,每隔3~4 d更换1次处理液及添加相应营养液。每处理5个重复,共30钵。待小苗处理35 d后收获测量。
把收获的海滨锦葵植株于水中小心洗净根部基质,测定株高、主根直径(根颈下1 cm长度内)、主根长度之后110℃烘箱中杀青20 min,转至80℃烘干至恒质量,测定全株干质量以及叶、茎、主根和须根干质量。计算叶重比为叶干质量/全株干质量(Leaf weight ratio,RLW)、茎重比为茎干质量/全株干质量(Stem weight ratio,RSW)、根重比为根干质量/全株干质量(Root weight ratio,RRW)和根冠比为根干质量/地上部分干质量(R/S)。
利用SPSS13.0对数据进行统计分析,处理间差异显著性采用Duncan氏多重比较。图表绘制借助Sigmaplot 10.0软件。
2 结果与分析
2.1 施氮对盐胁迫下海滨锦葵株高和根系的影响
当NaCl盐浓度小于250 mmol/L时,施氮明显增加了植物的高度,差异显著(P<0.05)。随着NaCl盐浓度的提高,达250 mmol/L时,即使施以氮肥,植株的高度与不施氮的相比差异不明显,说明氮肥施加并不能消除高盐下对植株生长的抑制作用。无论施氮与否,随着盐梯度的增加,植株的高度变化不显著,这也说明海滨锦葵对盐变化不敏感,海滨锦葵具有较强的抗盐特性,见表1所示。

表1 盐胁迫下施氮处理对海滨锦葵株高和根系的影响
在3个NaCl处理水平条件下,主根长变化不明显,不同的盐浓度对主根长影响不大。施氮后,主根长也没有发生明显的变化。而主根直径随着盐浓度的提升,逐渐减小。施氮后,主根直径与不施氮相比有所增大。在低盐(50 mmol/L)胁迫下时,施氮效果较为明显。在盐浓度小于150 mmol/L处理下,施氮可以缓解盐胁迫对海滨锦葵主根增粗的抑制。在250 mmol/L NaCl处理条件下,施氮后的主根直径(6.79 mm)比不施氮主根直径(5.56 mm)虽有所增粗,但两者差异并不显著。说明高浓度的NaCl对主根增粗生长的抑制作用并不为施以氮肥而有所缓解。
2.2 施氮对盐胁迫下海滨锦葵生物量及分配的影响
在NaCl盐浓度小于150 mmol/L处理下,施氮显著提高了全株的生物量。在150 mmol/L处理下施氮,植株生物量是不施氮的1.68倍,而在低盐50 mmol/L处理下施氮则是不施氮的2倍,差异显著(p<0.05)。当盐浓度为250 mmol/L时施氮,同样增加了植株的生物量,是不施氮的1.53倍,差异显著(p<0.05)。在高盐(250 mmol/L)胁迫下施氮植株生物量与小于150 mmol/L NaCl盐处理下不施氮植株生物量差异不明显(表2)。说明施氮大大减缓了由于盐害造成的生物量积累的胁迫效应,有利于植物光合碳物质合成。
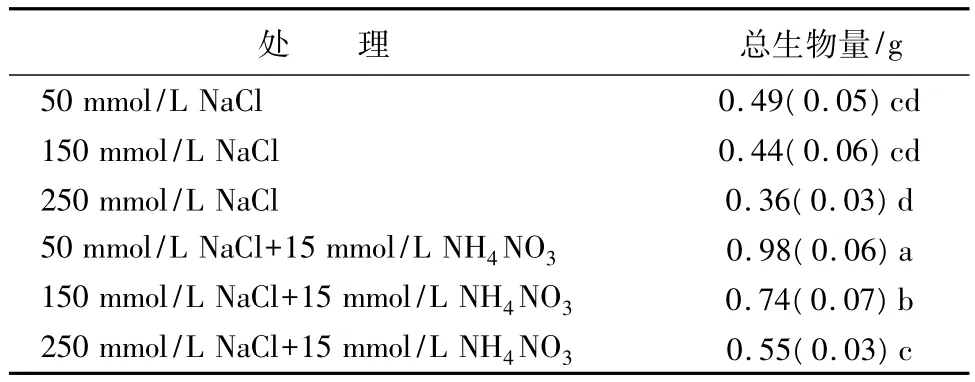
表2 盐胁迫下施氮对海滨锦葵植株总生物量的影响
叶重比、茎重比和根重比反映了生物量在叶、茎和根3种器官之间分配的比例。从表3可以看出,施氮显著提高了叶重比,在250 mmol/L NaCl处理下,施氮下的叶重比是不施氮的1.79倍,而在50 mmol/L NaCl处理下,施氮下的叶重比是不施氮的2.15倍,表明盐胁迫下施氮有利于海滨锦葵叶片碳物质的积累。施氮对茎重比没有明显影响。根重比不论在低盐和高盐处理下,施氮比不施氮显著降低海滨锦葵的根重比,在250 mmol/L NaCl处理下施氮的根重比约是不施氮的80%,表明盐胁迫下施氮并没有促进海滨锦葵在根系上的碳投资,反而对根系的生长有抑制作用。但施氮后主须根比有显著的增加,尤其在盐浓度小于150 mmol/L NaCl处理下,施氮效果更为明显,如在150 mmol/L NaCl处理下,施氮下的主须根比是不施氮的2.18倍,这表明施氮有利于海滨锦葵主根的生长。
根冠比反映了生物量在地上和地下部分之间分配的关系(表4)。盐胁迫下海滨锦葵根冠比在施氮条件下显著下降。其中250 mmol/L NaCl处理下施氮的根冠比是非施氮的60%。结合根重比,可以看出施氮肥对海滨锦葵根的生长不利,分配到根部的生物量下降。
2.3 施氮处理下海滨锦葵叶、根和地上干质量与相关性状的关联性
植物的叶片和根作为植物体地上和地下部分的重要的营养器官,很多功能性状在二者之间存在着一定的关联性。本研究结果显示(表4),施氮后盐胁迫下的海滨锦葵叶干质量与其他性状相关性得以加强,而未施氮肥盐胁迫下的叶干质量仅与地上干质量表现相关。作为吸收养分的根和制造养料的叶在施氮后生物量显著相关,线性回归分析其两者关系为 y(根干质量)=1.74x(叶干质量)+0.083(R2=0.703,F=16.592,p=0.005),而在施氮前并没明显的关联。这说明施氮后更密切了叶和根功能器官的协调关系,有利于提高植株对逆境的抵抗。
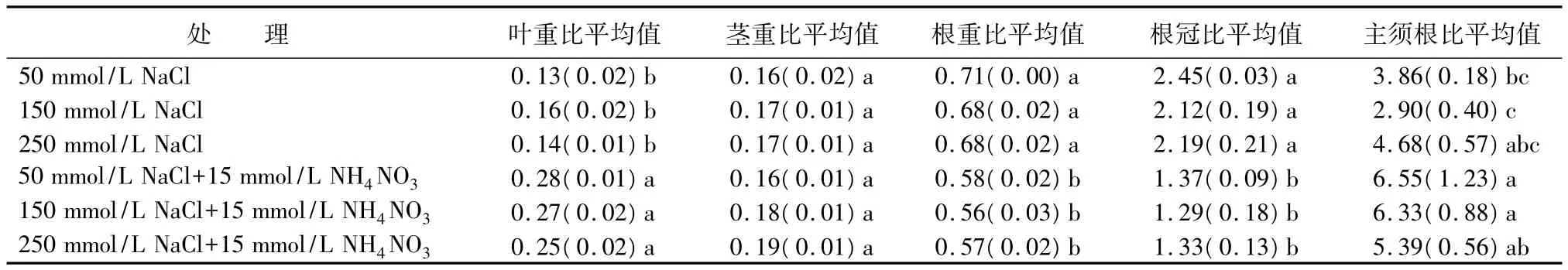
表3 盐胁迫下施氮处理对海滨锦葵生物量分配的影响

表4 盐胁迫下施氮处理对海滨锦葵叶、根和地上干质量相关性的影响
3 结论与讨论
植物生长环境中盐分过多危害植物的正常生长和发育,生长抑制是植物对高盐渍响应最敏感的生理现象。本实验观察到当盐浓度处理小于150 mmol/L NaCl时,施氮增加了植株的高度。结合施氮后的叶重比来看,植株高度的增加更有利于在盐逆境下通过承载茎上扩张的叶面积或增加叶数量来制造更多的碳水化合物。这与逆境(干旱)条件下,较大的冠层叶面积对作物产量的贡献要大于较大根系的贡献研究结果类似[3]。在本研究中,施氮显著提高了海滨锦葵植株的总生物量,增加了盐胁迫下海滨锦葵叶比重,而这种施氮的影响效果无论在低盐(50 mmol/L NaCl)还是高盐(250 mmol/L NaCl)环境下,没有显著差异。
植物最先感受逆境胁迫的器官是根系,逆境胁迫下根系形态上的变化是最为直观的[4]。海滨锦葵在盐胁迫下施氮并没有显著增加主根的长度,在小于150 mmol/L NaCl处理下施氮,主根直径却有显著增加,主根的增粗相应增加海滨锦葵主根的干重,但是并没有增加植株的根比重,相反,却降低了根比重。这与施氮后降低海滨锦葵的根冠比有一致之处。根作为异养器官,适宜的根系似乎更有利于植株把逆境下“来之不易”的氮转向于叶以此来合成积累更多的有机物质。这对于盐生环境植物来说,是对变化的环境作出的适宜碳投资权衡。
目前,由于环境污染而导致的氮沉降有全球增加的趋势[5],氮沉降在一定程度上对地上部分的生长有促进作用,对根系生长则不利,表现在氮沉降增加会使根部生物量生产减少[6]。这些结论在本研究中得以进一步证实。施氮后海滨锦葵根比重显著下降,而叶比重显著增加。从主须根比可以看出,施氮后增加了主根的生长,对须根的生长则有抑制作用,这与氮沉降抑制细根的生长有一致之处[6]。
我们的研究还发现,氮处理盐胁迫下的海滨锦葵根与叶生物量关联性显著提高。这种更为密切的关系,或许是植物功能器官在更有利于生长的环境下,更好地协调生长过程中对资源的利用和分配[7]。
盐影响盐生植物的生长(促进或抑制),必然直接或间接影响植物的光合作用。施氮后,关于海滨锦葵的光合指标的变化需要进一步研究。另有研究表明,施氮增加了盐生植物叶片脯氨酸的含量[8-9],降低耐盐作物地上部Na+、Cl-的含量,增加K+的向上运输和叶氮的含量[10-13]。对于海滨锦葵而言,植株的Cl-、Na+和K+在施氮前后的变化特征和施氮后对生殖生长的影响需要继续研究。
[1]徐国万,钦佩,谢民,等.海滨锦葵的引种生态学研究[J].南京大学学报,1996,32(2):268-274.
[2]赵可夫,冯立田.中国盐生植物资源[M].北京:科学出版社,2001.
[3]张岁岐,徐炳成.根系与植物高效用水[M].北京:科学出版社,2010.
[4]原俊凤,田长彦,冯固,等.硝态氮对盐胁迫下囊果碱蓬幼苗根系生长和耐盐性的影响[J].植物营养与肥料学报,2009,15(4):953-959.
[5]Matson P A,Mcdowell W H,Townsen A R,et al.The globalization of N deposition:ecosystem consequences in tropical environments[J].Biogeochemistry,1999,46(2):67-83.
[6]Persson H,Ahlström K,Clemensson Lindell A.Nitrogen addition and removal at Gårdsjön-effects on fine-root growth and fine-root chemistry[J].Forest Ecology and Management,1998,101(1/3):199-205.
[7]徐冰,程雨曦,甘慧洁,等.内蒙古锡林河流域典型草原植物叶片与细根性状在种间及种内水平上的关联[J].植物生态学报,2010,34(1):29-38.
[8]段德玉,刘小京,李存桢,乔海龙.N素营养对NaCl胁迫下盐地碱蓬幼苗生长及渗透调节物质变化的影响[J].草业学报,2005,14(1):63-681.
[9]Naidoo G,Naidoo Y.Effects of salinity and nitrogen on growth,ion relations and proline accumulation in Triglochin bulbosa[J].Wetlands Ecol.Manage,2001,9(6):491-497.
[10]Gimeno V,Syvertsen J P,Nieves M.et al.Additional nitrogenfertilization affects salt tolerance of lemon trees on different rootstocks[J].Scientia Agricola,2011,68(3):298-305.
[11]Levy Y,Syvertsen J P.Irrigation water quality and salinity effects in citrus trees[J].Hort Agricola Rev,2004,30(4):37-82.
[12]Garcia-Sanchez F,Perez-Perez J G,Botia P,et al.The response of young mandarin trees grown under saline conditions depends on the rootstock[J].Eur J Agron,2006,24(1/3):129-139.
[13]沈振国,沈其荣,管红英,等.NaCl胁迫下氮素营养与大麦幼苗生长和离子平衡的关系[J].南京农业大学学报,1994,17(1):22-26.
