紫丁香叶中丁香苦苷和橄榄苦苷的质量分数1)
2012-09-18赵明韩晶单喜臣王金兰张树军
赵明 韩晶 单喜臣 王 丹 王金兰 张树军
(齐齐哈尔大学,齐齐哈尔,161006)
木樨科丁香属植物紫丁香(Syringa oblata Lindl)收载于吉林省药材标准,具有清热解毒、利湿退黄等功效,用于治疗急性痢疾、黄疸性肝炎、乙型肝炎、结膜炎等疾病。同时该植物有着繁茂的花序、独特的芳香,并具有耐阴、耐寒、耐旱、适应性强等特点,已成为国内外园林中不可缺少的花木,植物资源十分丰富。研究表明,紫丁香含有大量的丁香苦苷和橄榄苦苷等环烯醚萜类成分[1-3],其中丁香苦苷对急性黄疸性肝炎具有较好的疗效[4],橄榄苦苷具有抗真菌、抗炎、抗病毒、抗氧化以及抗癌等活性[5],因此,紫丁香是一种极具开发前景的优良树种。由于不同成分在植物体内的含量与生长时间密切相关,为给适时采收并合理利用紫丁香植物资源提供科学依据,笔者对1 a中不同生长时间的紫丁香树叶中丁香苦苷和橄榄苦苷的质量分数进行系统研究,探讨了丁香苦苷和橄榄苦苷在紫丁香树叶中的质量分数随时间的变化规律。
1 材料与方法
实验用紫丁香树叶自2011年5月—2011年10月,每月5日和20日各采集1次,共采集12组样品。对照品丁香苦苷从紫丁香树叶中分离得到,橄榄苦苷从紫丁香树皮中分离得到,分别经半制备HPLC纯化,并经1H NMR,13C NMR谱鉴定结构,HPLC归一化法分析丁香苦苷对照品纯度为99.7%,橄榄苦苷对照品纯度为99.5%。
分析仪器为:Sarturius BT 124S/BT 25S电子天平(北京赛多利斯仪器系统有限公司),CN61M/SP-752紫外分光光度计(北京中西远大科技股份有限公司)。HPLC用甲醇和乙腈为色谱纯,水为娃哈哈纯净水,其余均为分析纯。
色谱条件:Agilent 1200高效液相色谱仪(手动进样器,四元泵,柱温箱,VWD检测器,美国Agilent公司),Agilent Eclipse XDB-C18 色谱柱(4.6 mm×50 mm,5 μm);流动相 v(乙腈) ∶v(水)=20 ∶80,柱温25 ℃,流速1.0 mL/min,进样量 5 μL,丁香苦苷和橄榄苦苷检测波长0→3 min(356nm)、3→15 min(223nm)。
对照品溶液的制备:分别精密称取对照品丁香苦苷8.0 mg,橄榄苦苷对照品10.0 mg,用甲醇制成0.2 g/L的对照品储备液,低温避光保存待用。
供试品溶液的制备:采用醇提和水提两种方法。醇提法取适量干燥的树叶,粉碎、研磨后精密称定,混匀。然后称取1.7 g,用150 mL甲醇在索氏提取器上回流提取4 h,回流液用等体积正己烷萃取3次,收集甲醇层浓缩至衡质量,精密称取适量,配制合适质量浓度的甲醇溶液,过滤,低温避光保存。水提法取适量干燥的紫丁香树叶,粉碎、研磨后精密称定,混匀。称取12.0 g,用125 mL水煮沸保温1 h,重复提取3次,过滤合并提取液,浓缩至约150 mL。用等量的正丁醇萃取3次,合并正丁醇萃取液液浓缩至衡质量,精密称取适量,配制合适质量浓度的甲醇溶液,过滤,低温避光保存。
线性关系考查:分别取丁香苦苷和橄榄苦苷对照品适量,精密称定,分别用甲醇配制一系列质量浓度的溶液,用上述色谱条件对系列样品分别进样5 μL进行分析,并对各分析峰面积(Area)与其质量浓度(Amt)进行线性回归,得到以下回归方程,丁香苦苷:峰面积=1105.8991×丁香苦苷质量浓度+17.73806(r=0.99911),线性范围 0.16 ~0.80 g·L-1;橄榄苦苷:峰面积=4096.74229×橄榄苦质量浓度-4.56273(r=0.99908),线性范围0.20 ~0.80 g·L-1。
精密度实验:选取质量浓度为 0.20、0.40、0.80 g·L-1的丁香苦苷和橄榄苦苷对照品溶液分别重复进样6次,用上述的色谱条件测定丁香苦苷和橄榄苦苷的峰面积,计算日内精密度,所得峰面积的相对标准偏差分别为1.64%和1.52%;再选取同样质量浓度的丁香苦苷和橄榄苦苷对照品溶液,1 d进样1次,连续进样3 d,测定各对照品峰面积,计算日间精密度,所得峰面积的相对标准偏差分别为1.36%和1.26%。
重复性实验:取紫丁香树叶供试品,分别配制成10.0 g/L的甲醇溶液,用上述的色谱条件,进样分析,测定丁香苦苷和橄榄苦苷的峰面积,考查其稳定性。其峰面积的相对标准偏差分别为1.17%和1.10%,表明该方法重现性良好。
稳定性实验:取同一供试品溶液,用上述的色谱条件,分别于 0、2、4、8、12、24 h 测定丁香苦苷和橄榄苦苷的峰面积,考查其稳定性。其峰面积的相对标准偏差分别为1.35%和1.44%,表明供试品溶液在24 h内稳定性良好。
加样回收率试验:取已知质量浓度的同一批次的紫丁香树叶样品溶液(10.0 g/L,1.0 mL)9 份,分别按120%、100%、80%,3个目标质量分数,精密加入丁香苦苷对照品 16.1、13.4、10.7 μg;橄榄苦苷对照品 169.9、141.6、113.3 μg;每个质量分数平行 3份,分别用上述的色谱条件进样分析,计算3个组分的加样回收率,结果平均回收率分别为100.2%和102.2%;相对标准偏差分别为1.8%和1.3%。
样品测定:精密称取各样品,分别配制成10.0 g/L的溶液,用上述的色谱条件进行测试,每组实验平行进行3次,用外标法测试计算各测试样品中丁香苦苷和橄榄苦苷的质量分数。
2 结果与分析
2.1 提取溶剂的的选择
由于每种植物中都含有复杂的化学成分,提取溶剂不同,所得提取率以及被提取成分存在较大差别,对分析结果产生较大影响。丁香苦苷和橄榄苦苷都是糖苷类成分,具有较大的极性,易溶于甲醇、乙醇、丙酮等强极性有机溶剂,也可以溶于水,因此选择甲醇和水两种强极性溶剂作为提取剂。但使用甲醇提取,会含有大量的油脂以及叶绿素等小极性成分,因此,通过正己烷萃取予以除去;水煮提取虽然不含有叶绿素等小极性成分,但会含有大量的可溶性无机盐及糖类等成分,所以通过正丁醇萃取富集丁香苦苷和橄榄苦苷。使用不同溶剂对2011年5—10月份采集的紫丁香树叶进行提取所得提取物的质量占干燥紫丁香树叶的质量分数(提取率)如表1。可以看出,甲醇提取所得提取物的总量明显高于水提。但由于不同溶剂提取物化学成分组成和质量分数存在很大差别,因此所得提取物的量多并不一定代表丁香苦苷和橄榄苦苷的提取率高,需通过分析其中两种物质的质量分数才能确定。

表1 不同提取溶剂的提取率
2.2 色谱流动相的选择
关于丁香苦苷的色谱分析流动相的选择,王艳宏等[6]以v(甲醇)∶v(水)=30∶70为流动相获得很好的分析效果,但在该条件下,丁香苦苷和橄榄苦苷的分离效果不佳,并且在甲醇—水体系流动相中增加水的比例,延长保留时间也难以实现好的分离效果(如图1A)。因此,甲醇—水体系不适合作为同时分析丁香苦苷和橄榄苦苷的色谱流动相。参照文献[7],用乙腈替代甲醇,选择v(乙腈)∶v(水)=20∶80作为同时分析丁香苦苷和橄榄苦苷的色谱流动相,虽然保留时间略有延长,但丁香苦苷和橄榄苦苷不仅得到很好分离,而且峰形窄且尖(如图1B)。

图1 丁香苦苷和橄榄苦苷在不同流动相时的HPLC分析结果
2.3 样品分析结果
在上述确定的色谱条件下,分别对不同时间采集的紫丁香树叶的甲醇提取物和水提物中丁香苦苷和橄榄苦苷的质量分数进行分析,结果如表2。可知,紫丁香树叶中含有较多的丁香苦苷和橄榄苦苷,但丁香苦苷更多,多数季节质量分数超过橄榄苦苷的2倍;对于不同溶剂提取物,甲醇提取物中,无论是丁香苦苷还是橄榄苦苷的质量分数均比水提物高,并且由前面的结果可知提取率也是甲醇高于水。因此,分析紫丁香树叶丁香苦苷和橄榄苦苷的质量分数,或者从中提取分离丁香苦苷和橄榄苦苷应优先选择醇提法。
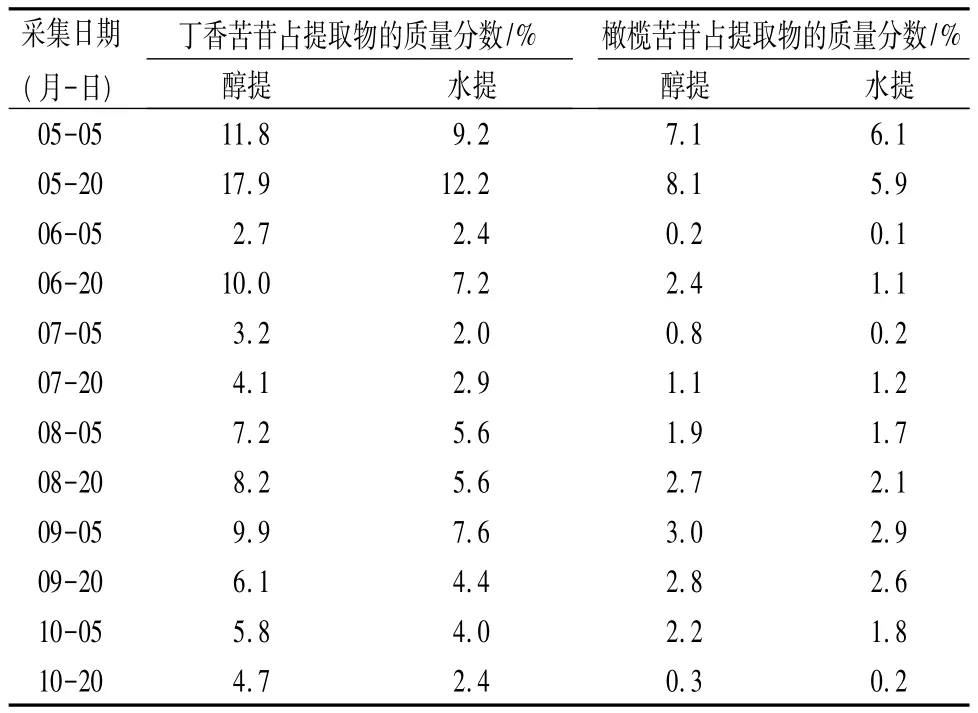
表2 不同时间采集的紫丁香树叶醇提物和水提物的HPLC分析结果
3 讨论
3.1 丁香苦苷的质量分数随生长时间的变化
在齐齐哈尔的气候条件下,5月份正值树叶开始萌发的芽期(或嫩叶期),6月为快速生长期,7、8月为稳定生长期,9月中下旬逐渐进入枯萎期。综合表1和表2的结果可以看出,丁香苦苷的质量分数随采集时间变化,在5月20日、6月20日和9月5日采集的树叶中,丁香苦苷占干燥树叶质量的百分比分别达到:8.28%、3.77%和3.82%,而在6月5日和7月5日出现2个最低值,分别为:1.04%和1.15%。该结果证明丁香苦苷的质量分数与紫丁香的生长存在密切关系。由于丁香苦苷味苦,并具有很强的抗菌、抗病毒等生物活性,所以推测在紫丁香植物体内大量合成丁香苦苷,对植物生长的不同时期抵抗病虫害的侵蚀起到重要作用。在树叶的芽期,由于树叶娇嫩,容易遭受病虫害的侵蚀,所以此时丁香苦苷的质量分数最高;6月初期正值树叶的快速生长期,由于树叶生长过快,受丁香苦苷的生物合成速度的限制,难以满足树叶中存在高浓度的丁香苦苷,所以造成在6月5日前后产生的第一个最低值;7月初正值种子快速生长期,植物体内的大量营养物质用于种子的生长可能是造成7月5日前后丁香苦苷的质量分数出现第二个最低值的原因。正是由于紫丁香树叶中常年维持较高浓度的丁香苦苷的存在,使得紫丁香植物很少有病虫害发生。
3.2 橄榄苦苷的质量分数随生长时间的变化
综合表1和表2的结果还可以看出,在紫丁香树叶中除丁香苦苷外,橄榄苦苷的质量分数也很高,并且随着紫丁香树叶生长时间不同,其质量分数变化规律与丁香苦苷相同,分别在在5月、6月中下旬和8—9月出现3个高峰期(在5月20日、6月20日和9月5日采集的树叶中橄榄苦苷占干燥树叶质量的百分比分别为:3.75%、0.90%和 1.16%),而在 6月5日和7月5日出现2个最低值(分别为:0.08%和0.29%)。这表明橄榄苦苷同丁香苦苷一样对在不同生长时期抵御病虫害的侵蚀发挥一定的作用。但是,在苦味上,丁香苦苷比橄榄苦苷更苦;在生物活性方面,橄榄苦苷表现很强的抗菌、抗病毒等活性[5],由此推测在紫丁香的生长过程中,可能是橄榄苦苷在抵御病害,而丁香苦苷则在抵御虫害方面发挥重要作用(有待进一步研究)。也正是由于有这两种物质大量存在,确保了紫丁香在生长过程中少受病虫害的侵蚀。
此外,由于在结构上丁香苦苷为环状环烯醚萜苷,而橄榄苦苷则是裂环环烯醚萜苷,二者同属环烯醚萜苷类,骨架结构存在近缘关系,在生物合成途径上存在一定的相关性,在植物体内可能随着生长环境的变化,发生结构的转化。
4 结论
紫丁香树叶中同时存在大量的丁香苦苷和橄榄苦苷,其质量分数随生长时间不同产生较大波动,但二者变化规律相近。在树叶芽期(或嫩叶期),丁香苦苷和橄榄苦苷的质量分数最高,分别占干燥树叶质量的8.28%和3.75%;使用甲醇、乙醇等强极性有机溶剂提取紫丁香树叶中的丁香苦苷和橄榄苦苷的方法优于水提法;使用乙腈—水体系做流动相,在v(乙腈)∶v(水)=20∶80时,使用 Agilent Eclipse XDB-C18 色谱柱(4.6 mm×50 mm,5 μm)进行HPLC分析,丁香苦苷和橄榄苦苷可以实现很好的分离。
[1]王丹丹,刘盛泉,陈英杰,等.紫丁香有效成分的研究[J].药学学报,1982,17(12):951-954.
[2]张树军,张军锋,王金兰.紫丁香树皮化学成分研究[J].中草药,2006,37(11):1624-1626.
[3]张树军,郭华强,韩晶,等.紫丁香籽化学成分研究[J].中草药,2011,42(10):1894-1899
[4]刘磊,李桂英,杨海玲,等.丁香苦苷不同给药途径的药物动力学研究[J].中医药学报,2010,38(1):96-99.
[5]Aziz N H,Farag S E,Mousa L A,et al.Comparative antibacterialand antifimgal effects of some phenolic compounds[J].Microbios,1998,93:43-54.
[6]王艳宏,李永吉,王艳芝,等.紫丁香叶中丁香苦苷的 RPHPLC 法测定[J].中草药,2003,34(3):268-269.
[7]尉小慧,翟卫峰,沈敏捷,等,HPLC法测定紫丁香树叶中丁香苦苷的含量[J].上海中医药杂志,2008,41(12):80-82.
