叶酸联合成体神经干细胞治疗创伤性脑损伤大鼠的实验
2012-09-17王丽萍
刁 波,刘 琴,王丽萍,张 宜
(中国人民解放军广州军区武汉总医院医学实验科,武汉 430070)
叶酸联合成体神经干细胞治疗创伤性脑损伤大鼠的实验
刁 波,刘 琴,王丽萍,张 宜
(中国人民解放军广州军区武汉总医院医学实验科,武汉 430070)
目的 观察叶酸联合成体神经干细胞对创伤性脑损伤大鼠的治疗作用,探讨其可能作用机制。方法 120只Wistar大鼠随机分为6组,正常组,模型组,假手术组,叶酸注射组,成体神经干细胞移植组,成体神经干细胞移植+叶酸注射组。倒置显微镜下观察神经干细胞形态学变化;流式细胞仪检测神经干细胞表面标记物CD105、CD45、CD44、CD29的表达;免疫荧光法检测神经元特异性烯醇酶(NSE成熟神经元的特异性标志)、胶质纤维酸性蛋白(GFAP胶质细胞的标记物)的表达;平衡木实验检测大鼠运动协调与整和能力;Morris水迷宫实验测试各组大鼠的学习记忆能力;HE染色及Brdu免疫组化实验观察脑组织形态学变化;酶联免疫吸附试验检测大鼠脑组中脑源性神经生长因子(BDNF)、神经生长因子(NGF)的表达;蛋白质印迹法检测脑组织中凋亡相关蛋白BCL-2、Bax、Caspase-3的表达。结果 分离所得细胞能在体外传代培养,流式细胞仪检测发现细胞阳性表达 CD44、CD29,阴性表达CD105、CD45,细胞经胎牛血清诱导分化后能形成NSE或GFAP阳性细胞。实验表明,叶酸与成体神经干细胞干预创伤性脑损伤大鼠模型后能显著改善其行为学变化,减轻脑组织的炎症反应,恢复受损神经细胞,增加脑组织内BDNF、NGF的含量,上调BCL-2的表达,下调 Bax、Caspase-3的表达。结论 叶酸联合成体神经干细胞干预创伤性脑损伤大鼠能显著改善中枢神经功能,对维持神经元微环境稳态具有重要的作用。
叶酸;成体神经干细胞;创伤性脑损伤
创伤性脑损伤(traumatic brain injury,TBI)是由创伤引起的脑组织损害,它是45岁以下人群死亡的主要原因。文献报道[1],在美国每年有200~800万人遭受TBI,约400~500万人因严重TBI而需住院治疗,TBI的前3位原因是交通事故、枪伤和坠落,英国也是以交通事故为最常见病因[2]。成体神经干细胞(neural stem cells,NSCs)是一类具有多向分化潜能的细胞,能分化成神经系统的细胞即神经元、星形胶质细胞和少突胶质细胞,而且具有自我更新和维持的能力[3-4]。主要存在海马齿状回的颗粒下层(sub-granular zone,SGZ)、侧脑室的室管膜下区(subvent ricular zone,SVZ)等部位[5-6]。叶酸(folate,p teroylglutamate或维生素B9)是保持身体健康、生长及发育所必需的水溶性B族维生素,是一组由数目不同的谷氨酸残体(glutamic-acid residues)的喋啶环结合而成的相关化学结构物的总称。叶酸不但与造血系统有密切的关系,也参与了神经系统生长发育。有学者研究表明,叶酸对NSCs的增殖、分化亦具有重要的影响[7-8],但作用机制尚不明确。课题组通过前期工作发现叶酸能显著降低缺氧条件下神经细胞炎性蛋白的表达及 Ca2+超载的发生,明显上调Notch1mRNA及Notch1蛋白的表达,对神经细胞具有显著的保护作用。因此,本实验通过叶酸联合成体神经干细胞干预创伤性脑损伤大鼠具有理论和技术上的可行性,为临床采用叶酸合并成体NSC治疗中枢神经系统疾病提供实验依据。
1 材料和方法
1.1 材料Wistar大鼠由湖北省医学实验动物中心提供,动物生产合格证号[SCXK(鄂)2008-0004],动物使用合格证号[SYXK(鄂)2008-0007]。注射用亚叶酸钙注射液购置广东岭南制药有限公司;DMEM/F12培养基、表皮生长因子(EGF)、碱性成纤维细胞生长因子 (bFGF)、青链双抗均购自美国Sigma公司;N2、B27、胎牛血清(FCS)购自美国Gibco公司;NSE、GFAP抗体购置美国 Santa公司,山羊抗兔Cy3荧光二抗购置美国KPL公司;CD105、CD45、CD44、CD29荧光抗体购置 BD公司;BDNF、NGF ELASA 试剂盒购置R&D公司;Bcl-2、Bax、Caspase-3抗体购置BioLegend公司。
1.2 成体NSC的分离、原代培养及传代 取6周龄Wistar大鼠,戊巴比妥钠过量麻醉致死,断头,无菌条件下取出脑组织,在Hanks平衡液内分离SGZ和SVZ脑组织,收集于含 2mL神经干细胞培养液(DMEM/F12 培养液添加 1%N2、2%B27、20μg/L EGF和20μg/L bFGF)的离心管。用1mL移液器反复吹打30次将大部分组织分离成细胞悬液,用75 μm滤网过滤除去未分离组织及细胞碎片。加培养液至细胞悬液达10mL并混匀,吸取10 μL细胞悬液与等量锥虫蓝液混匀后用血细胞计数板计数细胞总量。根据细胞计数,将细胞悬液调节为 1×105个/mL后,置于 CO2培养箱内培养。每3天半量换液,第2周吹打分离传代。待第2代细胞形成神经球后,用于后续实验。
1.3 成体 NSC的鉴定[9]取扩增一代的 NSC,去掉培养液,PBS洗2遍,用1∶1的0.25%的胰蛋白酶和0.2%EDTA混合液消化,用含20%BSA的PBS洗涤后制成浓度为1.0×106/mL的单细胞悬液,每个Eppendof管加500 μL细胞悬液,共3个检测管。1号阴性对照(不加抗体),2号管为同型对照(分别加入 5 μL 抗鼠的 IgG1-FITC、APC、PE、PerCP/Cy5.5),3号管为检测管(分别加入 5 μL抗人的CD105-PerCP/Cy5.5、CD45-APC、CD44-FITC、CD29-PE)。室温避光孵育30 min,流式细胞仪检测。
1.4 成体NSC的诱导分化[10]待第2代细胞形成神经球后,培养基中加入10%的FCS诱导成体NSC分化,在诱导的第7天,用4%多聚甲醛室温固定15 min,PBS漂洗3次,用 5%BSA的封闭液(含0.2%Trition X-100)室温封闭l h后,加入鼠来源的 GFAP及NSE抗体(1:100),37℃作用2 h,PBS漂洗3次,每次5 min,加入 TRITC标记的抗小鼠二抗1200),避光37℃反应1 h,PBS漂洗3次,每次5 min,接着用 DAPI染色,室温5 min,PBS漂洗,荧光显微镜观察拍照。
1.5 实验动物分组及处理120只SPF级8周龄雄性SD大鼠(200±10 g),随机分为6组,正常组、模型组、假手术组、干细胞移植组、注射叶酸组(0.5mg/d·kg)、干细胞移植+注射叶酸组。分别于神经干细胞移植后第1天、14天、28天用于后续实验。
1.6 脑外伤动物模型的制作用Feeney法按自由落体致伤原理,自制撞击装置。撞杆头端直径 4.5mm,高2.5mm,保持90°垂直,于冠状缝后1.5mm,中线右旁2.5mm处钻一直径为5mm的圆形骨窗,保持硬脑膜完整 ,将撞杆头端置骨窗处,击锤 (重40 g)沿外周导管从20cm高处自由落下冲击撞杆导致脑部损伤,术后连续肌肉注射青霉素10万U 1周。假手术组大鼠仅切开颅部皮肤,缝合。
1.7 成体NSC脑内移植 动物模型制备72 h后,将大鼠麻醉后固定于脑立体定向仪上,经过无菌操作,用灭菌的玻璃微量进样器吸取 10ul成体 NSC细胞悬液(1×105个NSC),在前囟后3mm和侧1.1mm处分别在大脑皮层下2mm和4mm移植细胞,每点移植 5 uL细胞悬液,注射速度 1μL/min,注毕留针20 min并以0.5mm/min速度缓慢退针。退针后常规缝合,术后连续肌肉注射青霉素10万μL周。
1.8 平衡木实验 于神经干细胞移植后1 d,14 d,28 d进行。170cm长,2cm宽的方木棒,平放在距地面70cm处,让大鼠在平衡木上走。评分标准:0分:稳健地保持平衡;1分:完全抓住平衡木的一端;2分:抱住平衡木,一个肢体滑落;3分:抱住平衡木,两个肢体滑落,或绕木旋转≥60 s;4分:试图保持平衡,但在40~60 s之间滑落;5分:试图保持平衡,但在20~40 s之间滑落;6分:试图保持平衡,但在20 s之内滑落。平衡木试验是直接反映大鼠运动协调与整和能力的指标。
1.9 Morris水迷宫实验于神经干细胞移植后14 d,28 d进行。用 Morris水迷宫测试其学习与记忆成绩。前4 d为训练时间,第5天为测试时间。训练每天上午进行,训练5次,每次间隔15 min,每次将大鼠面向池壁分别从4个象限的4个入水点入水,记录其在60 s内寻找平台的时间,即逃避潜伏期(escape latency)。如果达60 s仍未找到平台,则引导其到达平台,停留 30 s,本次成绩计为 60 s,然后进行下次训练。测试时取消平台,同法观察各组大鼠寻找隐蔽平台所需的时间(潜伏期)。
1.10 HE染色及Brdu免疫组化 于神经干细胞移植后1 d、14 d、28 d取脑组织行 HE染色及免疫组化染色。经10% 水合氯醛腹腔注射麻醉,经升主动脉快速灌注肝素化0.9% 氯化钠注射液150mL,继之快速灌注冰冷的4%多聚甲醛液200mL,再用300mL在2 h内慢速灌注,取脑组织浸入4%多聚甲醛内4℃固定48 h,修成厚4mm块,常规酒精脱水,石蜡包埋,作5μm冠状切片,行 HE及 BrdU免疫组织化学染色。
1.11 免疫印迹法检测脑组织中凋亡相关基因BCL-2、Bax、Caspase-3 的表达 将动物快速断头取脑,分离全脑组织置于4℃预冷的全细胞裂解液0.6 ml冰水浴中匀浆,12 000 r/min 4℃离心5 min,取上清液。以考马斯亮蓝G250结合法蛋白定量,-80℃保存备用。取15 μg蛋白样本加入2×SDS凝胶加样缓冲液,煮沸 5 min,6 000 r/min离心 3 min,取上清液上样,电泳后将凝胶上的蛋白转移至PVDF膜,转膜后室温下封闭2 h,将PVDF膜放入杂交袋,分别加入一抗(BCL-2、Bax、Caspase-3,1:800稀释)4℃过夜,加辣根过氧化物酶标记的羊抗兔IgG(1:1500稀释)和预染蛋白Marker,室温下振荡孵育1 h,滤膜漂洗后加入显影液显色,放入X-光片夹中曝光。结果经计算机扫描后,自动图像分析系统进行半定量分析,在同一条件下测定目标条带整合光密度值,计算出各组样品目标条带与内参(βactin)的整合光密度比值。
1.12 ELISA法检测脑内BDNF和 NGF的含量 制备10%脑组织匀浆液,10000 rpm离心10 min,取上清测蛋白浓度,取50 uL待测样品,采用 R&D公司提供的BDNF和 NGF试剂盒,操作步骤严格遵循试剂盒所提供说明书的要求。酶标仪405 nm处测出各组A值,计算脑组中BDNF和 NGF的含量。
1.13 统计学处理与分析 通过SPSS13.0统计软件用单因素方差分析及t检验,实验数据以均数±标准差(±s)表示
2 结果(封底图1、2、4)
2.1 成体NSC的形态学变化 倒置显微镜下,可见刚培养的细胞散在且胞体较小,呈圆形,折光性较好(图1a)。3 d后逐渐形成由数个细胞组成的细胞球(图1b)。培养至5 d存活的细胞已形成由数十个到数百个细胞组成的较大的细胞球(图1c)。传代后,在培养基中既可见到单细胞,也可见到呈不规则形状的小细胞团。传代后部分单个细胞则出现分裂相,逐渐形成由较多细胞组成的细胞球。NSC经10%FCS诱导分化后,1 d胞体出现突起,折光性较好(图2a)。3 d镜下观察出现典型的神经细胞(图2b)。5 d神经细胞胞体饱满,周围有光晕,轴、树突细长明显,交织成网络(图2c)。
2.2 成体NSC的鉴定流式细胞仪检测体外传代培养第 1代的 NSCs表面标记 CD105、CD45、CD44、CD29的表达,结果显示,NSCs表面分子 CD44、CD29呈阳性表达,不表达 CD105,CD45,提示分离培养的细胞可能具有间充质干细胞的性质(图3)。

图3 流式细胞仪鉴定成体NSCs实验结果表明原代培养所获取的成体NSCs呈CD44、CD29双阳性表达,表达率为99.38%,但不表达CD105、CD45。实验结果提示:所获取的细胞具有明显间充质干细胞特征,符合实验要求Fig.3 The result ofFlow detection for adult NSCs The experimental results show that the primary culture of adult NSCs was acquired by CD44,CD29 positive expression,the rate was 99.38%,but did not express CD105,CD45.The experimental resultsindicate:the acquired cells with a distinct mesenchymal stem cell characteristics,in line with the experimental requirements
2.3 成体NSC的诱导分化 添加10%FCS培养基后,NSC很快贴壁分化,部分轴突相互交错连接。24 h后细胞表面发生突起,并随着时间推移突起逐渐增多变长,不同细胞的突起彼此相互交联成网。7 d后进行免疫荧光染色显示,培养的细胞呈 GFAP或NSE免疫反应阳性,提示培养的细胞分化为星形胶质细胞或神经元(图4)。
2.4 平衡木实验结果 由表1可见,模型组大鼠平衡木评分在实验的各时间段均显著高于正常组大鼠(P<0.01),实验提示,模型组大鼠经创伤性损伤后其运动协调与整和能力明显下降。治疗第1d,3组平衡木评分比较差异无显著性意义(P >0.05);治疗第14天,28天,NSCs移植组、注射叶酸组、联合治疗组平衡木评分较模型组均有显著改善(P <0.05),与NSCs移植组及叶酸注射组比较,联合治疗组能明显改善平衡木评分。

表1 各组大鼠平衡木评分(n=4)Tab.1 Balance beam score of rats in different groups(n=4)
2.5 Morris水迷宫实验结果 水迷宫实验结果提示,与正常组比较,模型组在寻找隐蔽平台所需时间均有延长(P<0.01),实验提示,模型组大鼠经创伤性损伤后其学习记忆能力显著下降。治疗14 d,28 d,各治疗组大鼠的学习记忆功能均显著改善,与NSCs移植组及叶酸注射组比较,联合治疗组能明显改善大鼠的学习记忆功能(表2)。
2.6 HE染色及Brdu免疫组化实验结果 治疗后第1天,模型组及注射叶酸组创伤灶及周围水肿区可见较多细胞核固缩、深染、细胞膜完整的神经细胞,即凋亡的神经细胞,也可见许多呈空泡状的细胞,为液化坏死的神经细胞。NSCs移植组和联合治疗组均可见大量移植的细胞聚集、此时细胞形态结构正常,未见肿胀的细胞和炎性细胞。14 d时,联合治疗组大量细胞增生,主要为神经元,细胞结构正常,但病灶周边也可见周围水肿区,其范围较其他损伤组明显缩小;NSCs移植组和注射叶酸组病灶区周围水肿减轻,凋亡细胞减少,神经元周围可见有空隙,还可见胞核浓缩、深染,也有细胞增生,主要为胶质细胞。28 d时,联合治疗组神经元及胶质细胞形态结构正常,几乎未见明显肿胀的细胞和炎性细胞,基本接近正常组织。免疫组化实验结果显示,移植局部室管膜周围聚集大量Brdu阳性细胞,提示移植的 NSCs能够存活。随时间延长,移植的NSCs能沿一定路径迁徙,最终大量分布在病灶部位。联合治疗组病灶部位亦聚集大量Brdu阳性细胞,并且具有向神经细胞及神经胶质细胞分化的趋势,实验提示,叶酸可能会促进 NSCs的增殖,同时增强其神经功能重建的作用,促进受损脑组织修复,改善TBI大鼠的运动功能。
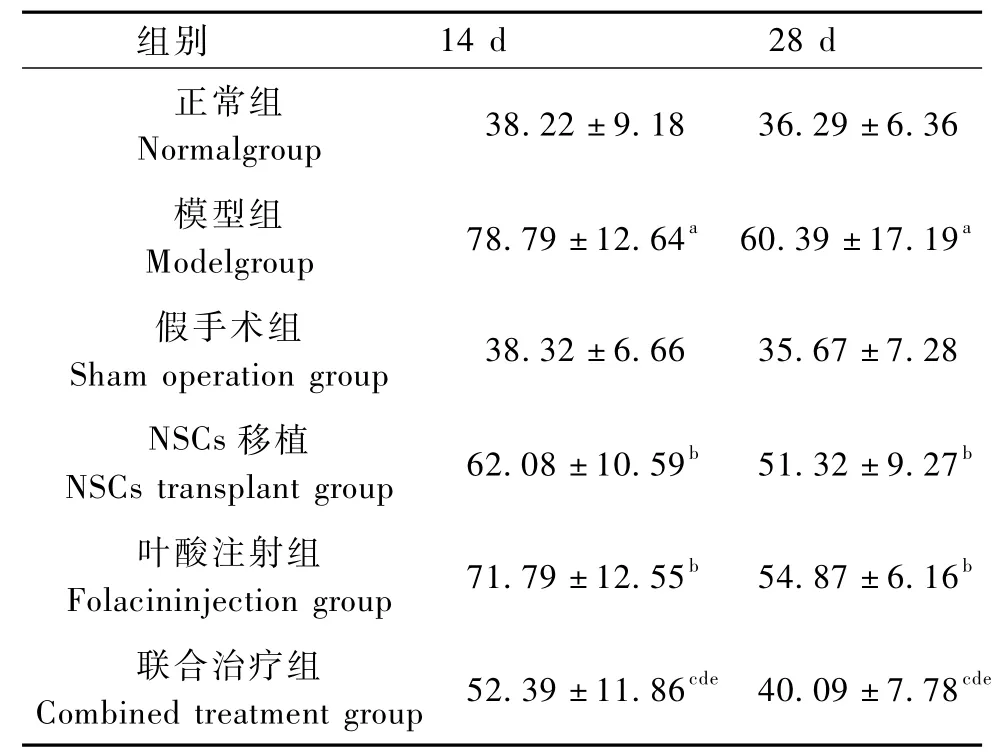
表2 各组大鼠寻找隐蔽平台所需的时间变化(s)(n=4)Tab.2 The change of time for finding hidden platform in different groups(n=4)

图8 治疗后第28天各组大鼠 BCL-2、Bax、Caspase-3及 Actin的免疫印迹实验电泳图Fig.8 The result of Immunoblotting experiments for BCL-2、Bax、Caspase-3 and Actin protein after treatment of 28 days
2.7 凋亡相关蛋白 BCL-2、Bax、Caspase-3 的表达免疫印迹实验检测了治疗第28天时,各组大鼠脑组织中凋亡相关蛋白 BCL-2、Bax、Caspase-3 的表达。实验结果显示,各组均强表达内参 Actin蛋白,表明实验结果可信。28 d 时,BCL-2、Bax、Caspase-3在正常组均有表达。与模型组比较,NSCs移植组及注射叶酸组 BCL-2表达具有上升趋势,Bax及 Caspase-3表达具有下降趋势,但无统计学差异(P >0.05)。联合治疗组 BCL-2表达明显上升,Bax及 Caspase-3表达显著下降(P<0.05)(图8-9)。
2.8 BDNF和 NGF在脑组织中的含量 ELASA实验表明,模型组大鼠脑组中的BDNF和 NGF的含量明显下降,营养神经能力下降。补充一定量的NSCs和腹腔注射叶酸后,BDNF和 NGF的含量明显上升,对恢复神经生理功能具有显著作用,联合治疗组二者含量上升明显,显著高于单一治疗组(表3、表4)。

图9 各组大鼠 BCL-2、Bax、Caspase-3的灰度比值 实验结果显示,正常组、模型组、假手术组、叶酸组、干细胞组及联合治疗组的 BCL-2灰度比值分别为 1.138、0.0892、0.665、0.525、0.685、0.883;Bax灰 度比值分别为 0.644、1.417、0.711、1.003、0.945、0.887;Caspase-3 灰 度 比 值 分 别 为0.232、0.735、0.445、0.559、0.401、0.322Fig.9 The intensity ratio of BCL-2,Bax,Caspase-3 in each group The experimental results show that,the normal group,model group,sham operation group,folic acid group,stem cell group and combined treatment group BCL-2intensity ratios were 1.138,0.0892,0.665,0.525,0.685,0.883;Bax grayness ratio were 0.644,1.417,0.711,1.003,0.945,0.887;Caspase-3 intensity ratios were 0.232,0.735,0.445,0.559,0.401,0.322

表3 各组大鼠脑组织中BDNF的含量变化(ng/gpr)(n=4)Tab.3 The change of BDNF content in brain tissue in different groups(ng/gpr)(n=4)

表4 各组大鼠脑组织中NGF的含量变化(ng/gpr)(n=4)Tab.4 The change of NGF content in brain tissue in different groups(ng/gpr)(n=4)
3 讨论
脑外伤后由于血脑屏障破坏、神经递质代谢异常、炎性介质积聚和脑微循环障碍导致脑功能缺失[11-12]。既往治疗多侧重于从一个或多个方面阻断病变进展。胚胎发生学的研究提示任何神经细胞群的建立和功能维持均依赖于细胞内外多种特异性信号的相互作用,这些信号包括多种生长因子、营养因子和神经细胞之间的突触联系[13-14]。因此,改变脑局部微环境,增加神经细胞保护和修复因子成为治疗研究方向。长期以来,人们一直认为中枢神经系统的神经细胞没有再生能力,损伤后死亡的细胞不能像上皮组织那样由再生的细胞替补。但是,近年来的研究发现,在中枢神经系统中也存在有干细胞,即成体 NSC。随着研究的深入发现[15-16],NSC 不光存在于胚胎期的脑组织中,在发育成熟的脑部(包括人脑)也有NSC存在,其主要在前脑的室管膜下区(subvent ricular zone,SVZ)和海马齿状回的颗粒细胞下层(subgranular zone,SGZ)。我们从成年大鼠脑组织中分离NSCs并在体外进行增殖培养,流式细胞仪鉴定发现其细胞表面分子CD29、CD44表达阳性,CD45、CD105表达阴性,提示原代培养的NSCs的具有间充质干细胞性质。用第2代成体 NSCs经10%FCS诱导,随共培养时间延长,免疫荧光染色实验证实所培养的细胞能分化为表达GFAP和 NSE的细胞,提示所培养细胞为NSCs。但在正常情况下,这些成体 NSC大部分处于休眠状态,基本没有分裂和分化现象。在损伤和局部环境变化时,成体NSC的生理活性则会上升。实验结果提示,脑内单纯移植成体 NSCs,行为学测试及神经营养因子检测均表明移植14d后,大鼠的学习记忆能力明显改进,神经细胞凋亡趋势下降,神经营养因子分泌量显著上升,促进神经环路重建,促进TBI大鼠神经生理功能的恢复。
叶酸在体内经叶酸还原酶的作用,还原为具有活性的四氢叶酸,它主要是作为一碳单位的传递体,参与嘌呤和嘧啶的合成及氨基酸之间的相互转化[17-18],体内叶酸缺乏则一碳单位传递受阻,核酸合成及氨基酸代谢受影响,而核酸及蛋白质合成正是细胞增殖、组织生长和机体发育的物质基础,因此叶酸对调节神经发生、神经干细胞的增殖分化起到重要作用[19-20]。实验结果表明治疗 14 d后,叶酸能明显改善TBI大鼠的平衡木评分和学习记忆能力,上调 BCL-2基因的表达,下调 Bax及 Caspase-3的表达,抑制神经细胞的凋亡,增强脑内 BDNF和NGF的表达,营养病灶周围的神经细胞。统计学分析发现,单纯移植成体NSCs的生物学作用有好于单纯注射叶酸作用的趋势,但无统计学差异(P >0.05)。实验结果提示,叶酸可能是通过动员自身的成体NSCs增殖分化而达到改善其病情的作用。当移植成体 NSCs和注射叶酸联合治疗 TBI大鼠时。14 d后,各检测指标均显著好于模型组大鼠指标(P<0.01),大鼠行为学表现恢复明显;与单纯成体NSCs移植组和叶酸注射组比较,联合治疗组亦明显优势,实验提示,成体NSCs与叶酸联合使用具有良好的协同作用,体外补充的叶酸不仅能动员自身成体NSCs的增殖分化、同样对移植的异源性成体NSCs增殖具有促进作用。因此,叶酸联合成体NSCs移植对TBI大鼠有明显的治疗作用,对TBI患者的临床康复具有重要的指导价值。
[1]Von Elm E,Schoettker P,Henzi I,et al.Pre-hospital tracheal intubation in patients with traumatic brain injury:systematic review of current evidence[J].Br J Anaesth.2009 ,103:371-386.
[2]Moore DF,Jaffee MS.Military traumatic brain injury and blast[J].NeuroRehabilitation.2010 ,26:179-181.
[3]Qu Q,Shi Y.Neural stem cells in the developing and adult brains[J].J Cell Physiol.2009,221:5-9.
[4]Acosta S,Jernberg J,Sanberg CD,et al.NT-020,a natural therapeutic approach to optimize spatial memory performance and increase neural progenitor cell proliferation and decrease in flammation in the aged rat[J].Rejuvenation Res,2010,13(5):581-588.
[5]Jiménez AJ,García-Verdugo JM,González CA,et al.Disruption of the neurogenic niche in the subventricular zone of postnatal hydrocephalic hyh mice[J].J Neuropathol Exp Neurol,2009,68:1006-1020.
[6]Shioda N,Han F,Fukunaga K.Role of Akt and ERK signaling in the neurogenesis following brain ischemia[J].Int Rev Neurobiol.2009,85:375-387.
[7]Liu H, Huang GW, Zhang XM,et al.Folic Acid supplementation stimulates notch signaling and cell proliferation in embryonic neural stem cells[J].J Clin Biochem Nutr,2010,47(2):174-180.
[8]Zhang X,Liu H,Cong G,et al.Effects of folate on notch signaling and cell proliferation in neural stem cells of neonatal rats in vitro[J].J Nutr Sci Vitaminol(Tokyo),2008,54(5):353-356.
[9]Ni WF,Yin LH,Lu J,et al.In vitro neural differentiation ofbone marrow stromalcellsinduced by cocultured olfactory ensheathing cells[J].Neurosci Lett,2010,475:99-103.
[10]Wexler E.Markers of adult neural stem cells[J].Methods Mol Biol,2008,438:243-268.
[11]Potts MB, AdwanikarH, Noble-HaeussleinLJ.Modelsof traumatic cerebellar injury[J].Cerebellum.2009 ,8:211-221.
[12]Pedersen M? ,Larsen A,Stoltenberg M,et al.Cell death in the injured brain:roles of met allothioneins[J].Prog Histochem Cytochem,2009,44:1-27.
[13]Chaldakov GN,Tonchev AB,Aloe L.NGF and BDNF:from nerves to adipose tissue,from neurokines to metabokines[J].Riv Psichiatr,2009,44:79-87.
[14]Ernsberger U.Role of neurotrophin signalling in the differentiation of neurons from dorsal root ganglia and sympathetic ganglia[J].Cell Tissue Res.2009,336:349-384.
[15]Ahmed S,Gan HT,Lam CS,et al.Transcription factors and neural stem cell self-renewal,growth and differentiation[J].Cell Adh Migr,2009,3:412-424.
[16]Carletti B,Piemonte F,Rossi F.Neuroprotection:the emerging concept of restorative neural stem cell biology for the treatment of neurodegenerative diseases[J].Curr Neuropharmacol,2011,9(2):313-317.
[17]Ohrvik VE,Witthoft CM.Human folate bioavailability[J].Nutrients,2011,3(4):475-490.
[18]Heseker H.Folic acid and other potential measures in the prevention of neural tube defects[J].Ann Nutr Metab,2011,59(1):41-45.
[19]Dhaulakhandi DB,Rohilla S,Rattan KN.Neural tube defects:review of experimental evidence on stem cell therapy and newer treatment options[J].Fet al Diagn Ther,2010,28(2):72-78.
[20]Amarin ZO,Obeidat AZ.Effect of folic acid fortification on the incidence of neural tube defects[J].Paediatr Perinat Epidemiol,2010,24(4):349-351.
Study on Folic Acid Combined with Adult Neural Stem Cells in the Treatment of Traumatic Brain Injury in Rats
DIAO Bo,LIU Qin,WANG Li-ping,ZHANG Yi
(Department of Medical Experiment,Wuhan General Hospital of Guangzhou Military Command of Chinese PLA,Wuhan 430070,China)
Objective To explore the folic acid and adult neural stem cells’joint influencing mechanism on the rat with Traumatic Brain Injury,and to find out its possible mechanism.Methods Divide 120 rats to 6 groups randomly—normal group,mode group,sham operation group,folacin injection group,adult stem cells transplant group,and folacin injection plus adult stem cells transplant group.Observe the morphological change under the microscope,then,do flow cytometry test and detect the expression of the neural stem cells’facial notation—CD105、CD45、CD44、CD29.Examine the expression of neuron special enolase(NSE)and the expression of gelatinous fibre acidic protein(GFAP)withimmunofluorescence.Examine the rats’ability to motor-coordinate and conform with balance beam.Test each group’s learning and memorizing ability by conducting the Morris water maze experiment.Then,conduct the HE chromosome and Brdu immunohistochemistry experiment to detect morphological change of the brain tissue.After this,do the enzyme-linked immunosorbent assay(ELISA)to detect the expression of brain-derived neurotrophic factor(BDNF)and the expression of nerve growth factor.The last but not least,use western blotting to examine the expression of related dead protein in the brain tissue:BCL-2、Bax、Caspase-3.Results The separated cells can be vitro subcultured,by doing flow cytometry test,we find that positive cells express CD44 and CD29 while negative express CD105,CD45.Cells induced by fet al bovine serum can produce NSE or GFAP positive cells.Experiments suggest that traumatic brain injured rats can significantly improve their behavior after jointly influenced by the folic acid and adult neural stem cells.Besides,they can also reduce brain tissue inflammation,restore damaged nerve cells,increase brain tissue of BDNF and NGF's content,increase BCL 2 expression,and lower the expression of Bax,caspase-3.Conclusion The folic acid combined with adult neural stem cell intervention in traumatic brain injury in rats can significantly improve the central nervous system dysfunction,plays an important role to maintain the steady microenvironment in the neuron.
Folic acid;Adult neural stem cells;Traumatic brain injury
R322.8
A
1671-7856(2012)07-0048-08
10.3969.j.issn.1671.7856.2012.007.013
2012-07-06
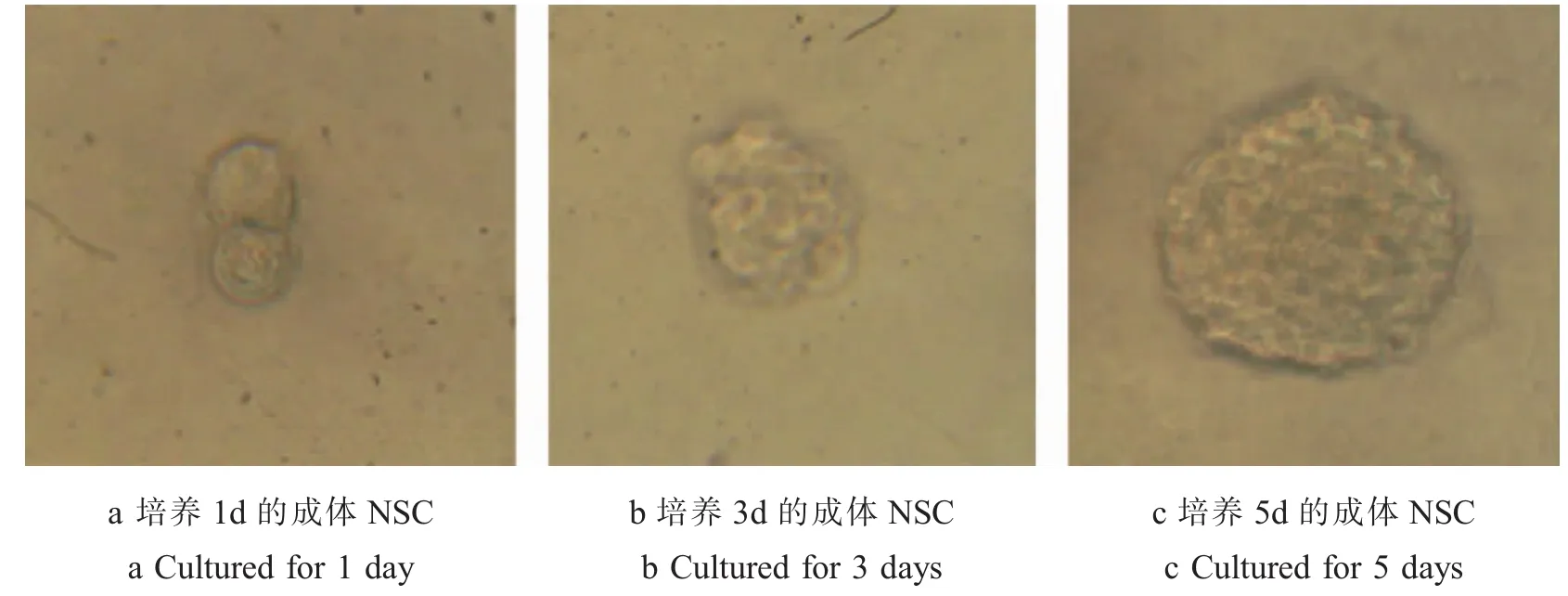
图1 成体NSC的形态学变化
Fig.1 Morphological changes of adult NSC
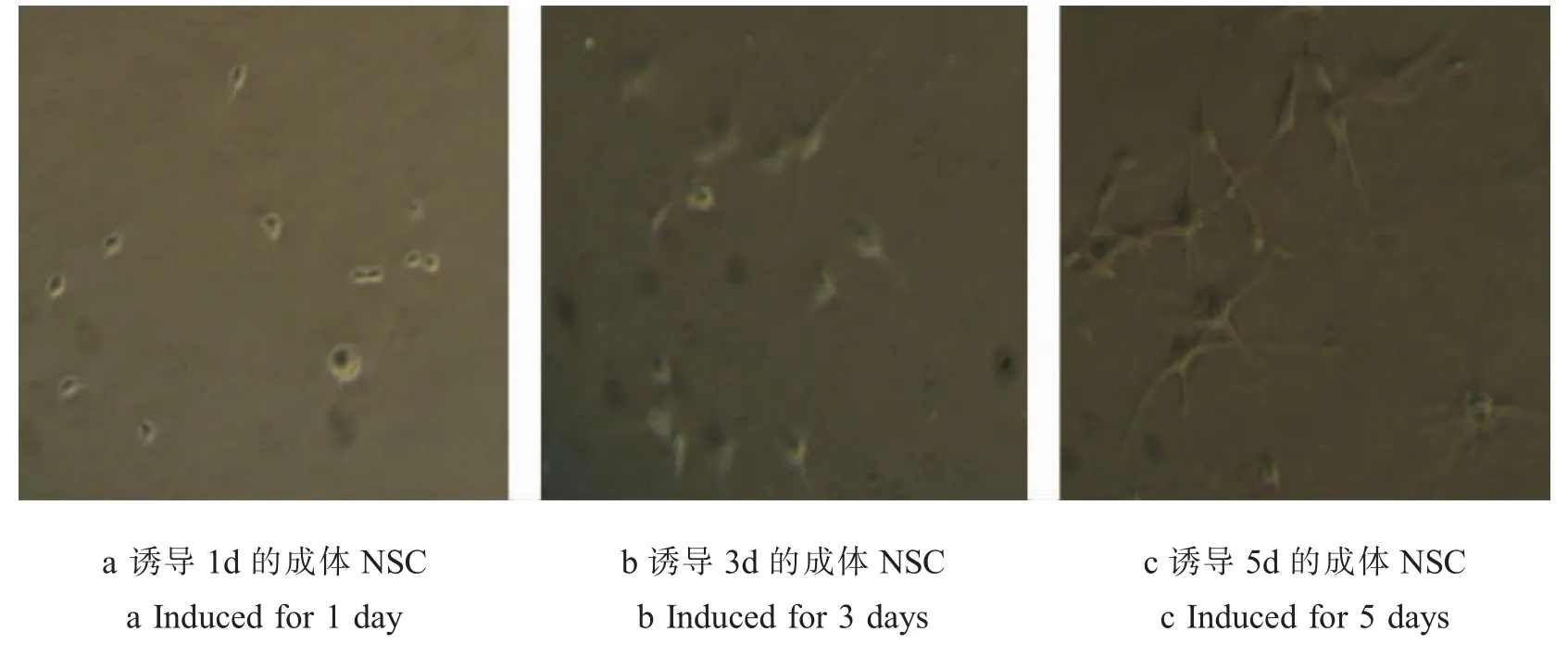
图2 成体NSC诱导后形态学变化
Fig.2 Morphological changes of adult NSC after induced
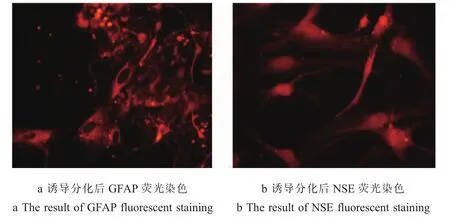
图4 免疫荧光实验表明,成体NSCs经10%胎牛血清诱导7d后,能分化为表达GFAP或NSE分子的神经胶质细胞或神经细胞,实验提示所获取的细胞为成体NSCs
Fig.4 Immunofluorescence experiments shoW that, as of NSCs With 10% fet al bovine serum7d after induction, can differentiate for the expression of the GFAP or NSE molecules in glial cells and nerve cells, the experiment suggested the acquired cells into NSCs
湖北省自然科学基金(2010CDZ030)。
刁波,男(1984-),硕士,主管技师,研究方向:神经生物学。E-mail:dpitao@163.com。
张宜,E-mail:hbpizy@tom.com。
