永久性局灶性中动脉阻断脑缺血(pMCAO)模型大鼠脑内突触相关蛋白表达的免疫组织化学观察
2012-09-17孙建宁董世芬张硕峰
刘 洋,孙建宁,董世芬,刘 明,张 易,张硕峰
(1.北京中医药大学中药学院中药药理系,北京 100102;2.贵阳中医学院,贵阳 550002)
永久性局灶性中动脉阻断脑缺血(pMCAO)模型大鼠脑内突触相关蛋白表达的免疫组织化学观察
刘 洋1,孙建宁1,董世芬1,刘 明2,张 易1,张硕峰1
(1.北京中医药大学中药学院中药药理系,北京 100102;2.贵阳中医学院,贵阳 550002)
目的 观察永久性局灶性中动脉阻断脑缺血(pMCAO)模型大鼠脑缺血发作后2 d、7 d脑内突触相关蛋白表达的变化。方法 制作大鼠永久性局灶性中动脉阻断脑缺血(pMCAO)模型。缺血动物术后随机分为缺血2 d组、缺血7 d组,另设假手术组。在术后2 d、7 d 2个时间点采用HE染色观察动物神经病理学改变,同时采用免疫组织化学法观察动物的缺血侧脑组织突触素-I(synapsin-I)、突触后致密蛋白95(PSD-95)、α-突触核蛋白(αsynuclein)表达情况。结果 与假手术组相比,缺血后,模型动物神经元大量变性坏死,数目减少,排列散乱。缺血后 2 d,synapsin-I在 CA1区、CA3区、皮层表达显著减少(P<0.05或 P<0.01),PSD-95在 CA1区、皮层表达显著减少(P<0.05或 P<0.01),α-synuclein在 CA1区神经元产生显著积聚(P<0.01);缺血后 7 d,synapsin-I在 CA1区、皮层表达仍显著降低(P<0.01),PSD-95在CA1区、皮层表达显著减少(P<0.05或P<0.01),α-synuclein在CA1、CA3、皮层表达显著增加(P<0.05或P<0.01)。结论 pMCAO模型大鼠在脑缺血发生后,神经突触有关蛋白的表达显著改变,并随缺血后不同时间点表达情况不同,这可能与神经元突触重塑有关。突触相关蛋白的表达与缺血损伤程度密切相关。
永久性局灶性中动脉阻断脑缺血模型;突触素-Ⅰ;突触后致密蛋白95;α-突触核蛋白
1 引言
脑缺血是一种具有高致死率和致残率的疾病,随着目前人类社会进入老龄化社会,其发病率呈现逐年升高的趋势,已经成为威胁人类生命健康的疾病之一[1]。脑缺血发病机制复杂,其病理过程涉及钙超载、氧化应激、炎症级联反应、兴奋性氨基酸毒性等,最终导致神经元细胞凋亡。突触是神经元进行信息传递的特殊结构,其数目、结构、功能与神经系统生理、病理状态密切相关[2]。近年来相关研究表明,神经元突触对缺血性损伤极为敏感[3]。神经元的凋亡、再生和突触重塑等形态学改变与神经系统功能密切相关,可导致神经网络功能的重建。缺血性损伤会导致神经系统突触数目、功能、结构的变化,而这种变化直接影响到神经信息的传递[4]。
本研究拟采用永久性局灶性中动脉阻断脑缺血(pMCAO)大鼠模型,观察缺血后2 d、7 d模型动物大脑海马、皮层与突触功能突触素-I(synapsin-I)、突触后致密物蛋白质 95(PSD-95)、α-突触核蛋白(α-synuclein)表达变化情况,以期研究脑缺血后神经元突触病理改变,为改善突触功能、促进神经系统功能重建及相关药物开发提供实验依据。
2 材料和方法
2.1 药品与试剂
试剂:兔抗大鼠 synapsin-I多克隆抗体(批号,20110629)、兔抗大鼠 PSD-95多克隆抗体(批号,20110528)、兔抗大鼠 α-syn多克隆抗体(批号,20110610)、由北京博奥森公司提供;多聚甲醛,由sigma公司(美国)提供。
2.2 主要仪器
Olympus BX51显微镜;Olympus E330数码照相机;Image-pro 5.0图像分析系统。
2.3 实验动物分组及处理
SPF级SD大鼠,雄性,体质量250~270 g,由北京维通利华实验动物技术有限公司提供,合格证号:[SCXK(京)2006-0009],按照实验动物 3R 原则给予人道关怀。大鼠于室温(22~25)℃,相对湿度65%,12 h明暗交替环境中适应2周进入实验。参照Koizumi和 Nagasawa方法及改良 MCAO制作方法稍加改进制作pMCAO模型[5-7]。大鼠采用10%水合氯醛(0.35mL/100 g体重)麻醉后,仰卧固定。剪开皮肤,钝性分离肌肉,暴露并分离右侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA)。结扎ECA与CCA近心端,用动脉夹夹闭ICA远心端,于ECA与ICA分叉处作一小切口,插入头端加热成光滑球形的钓鱼尼龙线(直径为0.261mm),插入深度为18-19mm左右,实现右侧大脑中动脉阻塞导致脑缺血。结扎切口处,剪掉血管外的尼龙线,缝合皮肤。假手术组动物不栓塞大脑中动脉,其余处理同模型组。
术后6 h,待动物清醒后,按照 Longa 5级评分法[8],对动物进行神经功能行为评分,评分标准:无明显神经症状,0分;不能完全伸展左侧前爪,1分;向左侧旋转,2分;行走时向左侧倾倒,3分;不能自行行走,4分。选取评分为1~3分的动物入选后续实验,并随机分成2组:缺血2 d组、缺血7 d组。另设假手术组。
2.4 苏木素-伊红染色(H&E staining)
分别于造模后2 d、7 d,麻醉大鼠,开胸,用预冷的0.9%生理盐水200mL经左心室快速冲洗,继用4%多聚甲醛磷酸缓冲液(pH 7.4)400mL灌流固定。脑组织以4%多聚甲醛固定液(pH 7.4)固定24 h,梯度乙醇脱水,二甲苯透明,石蜡包埋,每组取3例,取视交叉前后2mm组织块(包含缺血周围区),冠状位连续切片,片厚5 μm,进行 HE染色,观察造模后动物脑组织病理学改变。采用Olympus BX51型正置显微镜观察HE切片,在20×10倍数下于缺血侧CA1、CA3、皮层缺血区域周围选取3个视野,采用Olympus E330数码相机采集图像,Image-Pro Plus 5.0软件对图像进行分析。观察缺血侧神经元损伤情况。
2.5 免疫组织化学染色观察脑组织 PSD-95、synapsin-I、α-synuclein 蛋白表达
常规石蜡切片,免疫组织化学法观察脑组织synapsin-I、PSD-95、α-synuclein 蛋白表达,基本方法如下:切片常规脱蜡,PBS漂洗5 min×3次,微波抗原修复20 min,PBS漂洗5 min×3次,过氧化氢处理 30 min,PBS 漂洗 5 min× 3 次,滴加 synapsin-I、PSD-95 或 α-synuclein 抗体 50 μL(1:50),在暗湿盒中(37℃)孵育2 h,PBS漂洗5 min×3次,滴加山羊抗兔 IgG 50 μL,在暗湿盒中(37℃)孵育 2 h,PBS漂洗5 min×3次,DAB(1:50)控制显色,蒸馏水洗涤终止显色,苏木素复染,常规脱水,二甲苯透明,中性树胶封片。采用Olympus BX51型正置显微境观察染色切片,在20×10倍数下于缺血侧 CA1、CA3、皮层缺血区域周围选取 3个视野,采用Olympus E330数码相机采集图像,Image-pro Plus 5.0软件对免疫组化结果进行分析。
2.6 统计学方法
采用SPSS 13.0 for Windows统计软件对实验数据进行t检验统计分析,所有实验数据以±s表示,P <0.05认为具有统计学意义。
3 结果
3.1 病理图像分析
假手术组动物皮层神经元细胞圆整神经元胞质丰富,色淡,细胞核居中,核仁清晰;海马神经元排列密集整齐,形态圆整,体积较大,偶见坏死神经元。与假手术组动物相比,术后2 d,模型组光镜下脑组织出现明显液化现象,皮层神经元大量变性坏死,表现为神经元数目减少、排列紊乱,胞膜轮廓不清,细胞核固缩深染;海马神经元排列散乱,神经元变形,核不规则,变性神经元核固缩深染、且神经元数目减少。(图1见彩插2)。术后7 d,与假手术组相比,模型组皮层部位神经元损伤严重,神经元数目减少,完整神经元大量缺失,可见大量空泡和液化灶;海马区域神经元排列紊乱,可见大量变性神经元细胞,核深染固缩。(图2见封三)。
3.2 免疫组化结果
3.2.1 pMCAO模型大鼠脑内 synapsin-I表达的变化:缺血2 d后,与假手术组相比,模型组动物脑内海马 CA1区没有显著差别,但在 CA3区、皮层 Syn-I明显下降(P<0.05)。缺血7 d后,与假手术组相比,模型组海马CA1区、皮层Syn-I表达仍显著降低(P<0.01),CA3区表达略有上升。结果见表1。
表1 pMCAO模型大鼠脑内synapsin-I表达的变化(±s)Tab.1Expression of synapsin-I in the brain of pMCAO model rats(±s)

表1 pMCAO模型大鼠脑内synapsin-I表达的变化(±s)Tab.1Expression of synapsin-I in the brain of pMCAO model rats(±s)
注:与假手术组相比,*P <0.05,**P <0.01Note:*P <0.05,**P <0.01 vs.the sham group.
组别2d Cortex假手术组 Sham 1072.35±119.11 1192.75±304.82 1162.73±293.43 1181.16±207.62 1267.39±337.04 1177 Groups 7 d CA1区CA1 Region CA3区CA3 Region 皮层Cortex CA1区CA1 Region CA3区CA3 Region 皮层.56±305.75模型组Model 818.31±87.97** 834.55±146.85* 528.94±239.02* 841.87±230.82** 1109.92±447.03 362.17±248.12**
3.2.2 pMCAO模型大鼠脑内PSD-95表达的变化:术后2 d,与假手术组相比,模型组海马 CA1区、皮层PSD-95的表达显著下降(P<0.01)。缺血后 7 d,与假手术相比,模型组在在CA1区表达降低(P<0.05)、CA3区表达略有上升,但与假手术组相比差异无显著性,皮层区PSD-95表达仍显著低于假手术组(P<0.01)。结果见表2。
表2 pMCAO模型大鼠海马、皮层PSD-95表达的影响(±s)Tab.2Expression of PSD-95 in the brain of pMCAO model rats(±s)

表2 pMCAO模型大鼠海马、皮层PSD-95表达的影响(±s)Tab.2Expression of PSD-95 in the brain of pMCAO model rats(±s)
注:与假手术组相比,*P <0.05,**P <0.01Note:*P <0.05,**P <0.01 vs.the sham group
组别2d Cortex假手术组 Sham 1632.42±203.00 956.79±489.84 1474.49±345.62 1231.34±239.69 1080.11±178.72 1304.Groups 7 d CA1区CA1 Region CA3区CA3 Region 皮层Cortex CA1区CA1 Region CA3区CA3 Region 皮层90±333.33模型组 Model 880.19±340.30** 776.82±300.16 296.12±132.31**909.80±365.53* 1168.16±510.91 374.92±129.52**
3.2.3 pMCAO模型大鼠脑内 α-synuclein表达的变化:术后48 h,与假手术组相比,模型组脑内 αsynuclein在海马CA1区表达显著增加(P<0.01),CA3区、皮层表达有所上升,但尚无显著性差异。缺血后7 d,与假手术相比,α-synuclein在 CA1区、皮层表达显著增加(P<0.01),CA3区表达也有明显增加(P<0.05)。结果见表3。
表3 pMCAO模型大鼠海马、皮层α-synuclein表达的影响(±s)Tab.3Expression of α-synuclein in the brain of pMCAO model rats(±s)

表3 pMCAO模型大鼠海马、皮层α-synuclein表达的影响(±s)Tab.3Expression of α-synuclein in the brain of pMCAO model rats(±s)
注:与假手术组相比,*P <0.05,**P <0.01Note:*P <0.05,**P <0.01 vs.the sham group
组别2d Cortex假手术组 Sham 1013.20±240.11 849.87±163.71 887.17±385.45 799.14±223.72 702.78±130.73 714.97±2 Groups 7 d CA1区CA1 Region CA3区CA3 Region 皮层Cortex CA1区CA1 Region CA3区CA3 Region 皮层20.45模型组Model 1406.57±232.05** 985.00±232.38 1111.31±261.45 1121.49±215.71** 905.99±166.61* 1268.48±344.38**
4 讨论
pMCAO模型是常用的脑缺血动物实验模型,其制作方法经过不断改良与优化[9],目前已经较为成熟,具有方法简单、成功率高、重复性好的特点。目前应用较为广泛,适用于观察缺血后病理改变及评价相关治疗药物的疗效[10,11]。
突触结构是大脑神经元间进行神经信息传递的物质结构基础。作为神经系统的重要结构单位,突触的数量及其结构完整性对维持大脑功能的正常发挥起到了至关重要的作用。近些年来,脑缺血发生后突触结构和功能改变日益受到重视。有研究显示,皮层突触重塑与运动功能恢复在时间上具有一致性。这说明突触重塑能够为神经系统功能恢复提供重要信息[12]。
目前,已有大量研究表明突触相关蛋白与脑缺血密切相关。其中,关于PSD-95的研究较为丰富。PSD-95 是突触后致密物质(post-synaptic density,PSD)中的一个主要蛋白,在脑组织内广泛分布,其在介导和整合突触信号传递过程起到了重要作用[13]。研究表明其直接参与了缺血信号的转导,对突触功能和神经元的存活具有明显影响,PSD的改变直接影响突触的传递功效[14-16]。缺血引起的PSD95及其相关蛋白特性改变的机制是复杂和多方面的,包括突触后细胞 Ca2+浓度改变、去磷酸化反应、蛋白酶激活、氧化反应和其他改变等,有助于神经细胞兴奋性增强而导致细胞死亡[17]。这表明PSD95的调控作用对突触功能和神经元的存活有明显的作用。本研究中,脑缺血后2 d,不同脑区PSD-95表达明显下降,其中CA1区、皮层最为明显。缺血后7 d,与假手术组相比,模型组 CA1区、皮层表达仍较低,在CA3表达略有升高,这可能与突触重建有关。
Synapsin-I属于囊泡膜蛋白,其参与到囊泡转运、神经递质释放的调节等重要生理过程,其表达状态也能够反应突触功能[18,19]。研究表明,其与突触重建密切相关。有研究表明,短暂脑缺血后Synapsin-I会有短暂降低,与神经元凋亡在时间上具有同步性,提示脑缺血后存在的失神经和神经再获现象可能与 DNA的损伤和修复有关[20]。本研究中,在缺血 2 d后,与假手术组相比,Synapsin-I在CA3区、皮层的表达都明显下降,这提示脑缺血急性期,突触功能受到损伤,囊泡转运能力下降。
α-synuclein近些年来受到广泛的关注,其在神经退行性疾病中的作用逐渐受到重视[21]。因其是组成Lewy体的主要蛋白之一,其在帕金森和阿尔兹海默症中的作用尤其受到广泛关注,但在脑缺血病理改变中的作用研究尚不深入[21,22]。但相关研究表明,α-synuclein 对神经细胞具有毒性[23]。其聚集和过度表达损伤神经元,引起神经元变性,从而影响突触功能。缺血再灌注损伤发生后,α-synuclein脑内积聚,不利于神经元存活[24]。本研究观察了α-synuclein在脑缺血发生后不同时间点的表达情况。结果表明缺血后2 d,α-synuclein即在 CA1区、皮层显著增加,这种差异一直持续到第7 d。缺血至第7 d时,除CA1区、皮层以外,其在CA3区的表达也显著增加。这表明在观察期内,随着缺血时间的延长,α-synuclein在神经元的积聚增加,截至观察期(7 d)结束,其在CA1区、CA3区和皮层的表达均显著增加。
综上所述,缺血后2 d,与假手术组相比,模型组不同脑区神经元突触均受到缺血性损伤,表现为PSD-95、synapsin-I表达水平下降以及 α-synuclein 的积聚;缺血后 7 d,尽管 PSD-95 和 synapsin-I表达水平较2 d略有升高,但仍旧显著低于假手术组表达水平,且α-synuclein表达水平高于假手术,这表明,截至到缺血后7 d,突触功能尚没有完全恢复。值得注意的是,缺血损伤发生后,脑内突触功能存在重建过程[25,26],许多因素可以增加突触相关功能蛋白的表达,促进突触功能的恢复。
近年来突触功能与神经系统疾病的关系日益受到关注,改善突触功能、增强突触传递将为疾病的治疗提供新的思路和方法。了解疾病发生后突触功能的改变,对关键蛋白、基因表达进行干预,或可以保护神经元,减轻缺血性损伤。在今后的研究中,应考虑延长观察时间,从而更为全面地观察脑缺血发生后突触相关蛋白的表达动态,以评价突触重建与缺血时间的关系,为药物干预时间窗的确定提供数据支持。
[1]van Walraven C,Hart RG,Connolly S,et al.Effect of age on stroke prevention therapy in patients with atrial fibrillation-the atrial fibrillation investigators[J].Stroke,2009,40:1410-1416.
[2]Janz R,Sudhof TC,Hammer RE,et al.Essential roles in synaptic plasticity for synaptogyrin I and synaptophysin I[J].Neuron,1999,24(3):687-700.
[3]Bolay H,Gursoy Ozdemir Y,Sara Y.Persistent defect in transmitter releaseand synapsin phos phorylation in cerebral cortex after transient moderate ischemic injury[J].Stroke,2002,33(5):1369-1375.
[4]王慧娟,苏丽英,李陈莉,等.大鼠脑缺血后突触体素与突触密度的关系[J].解剖学杂志,2004,27(6):642-645.
[5]Koizumi J,Yoshida Y,Nakazawa T,et al.Experimental studies of ischemic brain edema:a new experimental model of cerebral embolism in rats in which recirculation can be introduced[J].Stroke,1986,8:1-8.
[6]Nagasawa H,Kogure K.Correlation between cerebral blood flow and histologic changes in a new rat model of middle cerebral artery occlusion[J].Stroke,1989,20(8):1037-1043.
[7]许金秀,杨牧,周红.大鼠永久性大脑中动脉阻塞模型的建立[J].四川动物,2010,29(3):461-466.
[8]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion[J].Stroke,1989,20:84-91.
[9]辛世萌,刘远洪,聂志余,等.栓线长度、直径、及大鼠体重与栓线法大鼠局灶性脑缺血模型关系的研究[J].大连医科大学学报,2000,22(2):105-107.
[10]Roof RL,Schielke GP,Ren XD,et al.A comparison of longterm functional outcome after 2 middle cerebral artery occlusion models in rats[J].Stroke,2001,32:2648-2657.
[11]刘明,孙建宁,董世芬,等.梓醇对永久性脑缺血损伤大鼠恢复早期运动感觉功能和能量代谢的影响[J].北京中医药大学学报,2011,34(4):245-249.
[12]张翠玲,刘立,任宇虹,等.脑缺血性损伤后的皮层突触再生与运动功能恢复[J].第四军医大学学报,2001,22(12):1122-1147.
[13]Craven SE,Bredt DS.PDZ proteins organize synaptic signaling pathways[J].Cell,1998,93:495-498.
[14]Gardoni F,Schrama LH,Kamal A,et al.Hippocampal synaptic plasticity involves competition between Ca2+/calmodulindependent protein kinase II and postsynaptic density 95 for binding to the NR2A subunit of the NMDA receptor[J].J Neuro Sci,2001,21:1501-1509.
[15]Martone ME,Jones YZ,Young SJ,et al.Modification of postsynaptic densities after transient cerebral ischemia: a quantitative and three dimensional ultrastructural study[J].J Neurosci,1999,19(6):1988-1997.
[16]Hu BR,Park M,Martone ME,et al.Assembly of proteins to postsynaptic densities after transient cerebral ischemia[J].J Neurosci,1998,18(2):625-633.
[17]Takagi N,Logan R,Teves L,et al.Altered interaction between PSD 95 and the NMDA receptorfollowingtransientglobal ischemia[J].J Neurochem,2000,74(1):169-178.
[18]Stroemer RP,Kent TA,Hulsebosch CE.Enhanced neocortical neural sprouting,synaptogenesis,and behavioral recovery with D-amphetamine therapy after neocortical infarction in rats[J].Stroke,1998,29:2381-2393.
[19]梁燕玲,张苏明,许康.短暂脑缺血再灌注后突触蛋白Ⅰ表达与细胞凋亡[J].中国临床康复,2005,9(37):54-56.
[20]Al-Wandi A,NInkina N,Millership S,et al.Absence of α-synuclein affects dopamine metabolism and synaptic markers in the striatum of aging mice[J].Neurobiol Aging,2010,31:796-804.
[21]Baba M,Nakajo S,Tu PH,et al.Aggregation of alphasynuclein in Lewy bodies of sporadic Parkinson’s disease and dementia with Lewy bodies[J].Am J Pathol,1998,152:879-884.
[22]Hashimoto M,Rockenstein E,Crews L,et al.Role of protein aggregation in mitochondrial dysfunction and neurodegeneration in Alzheimer‘s and Parkinson ’s disease[J].Neuromolec Med,2003,4:21-35.
[23]Forloni G, BertaniI, CalellaAM, et al.Alpha-syn and Parkinson’s disease:selective neurodegenerative effect of alphasyn fragment on dopaminergic neurons in vitro and in vivo[J].Ann Neurol,2000,47(5):632-640.
[24]Isin Unal-Cevik,Yasemin Gursoy-Ozdemir,Muge Yemisci,et al.Alpha-synuclein aggregation induced by brie fischemia negatively impacts neuronal survival in vivo:a study in[A30P]alpha-synuclein transgenic mouse[J].J Cerebr Blood Met,2011,31:913-923.
[25]刘罡,吴毅,胡永善,等.跑台训练对脑缺血大鼠脑组织超微结构及突触素表达的影响[J].中国康复医学杂志,2008,23(10):872-874.
[26]叶灵静,徐晓虹,王亚民,等.丰富环境对脑缺血大鼠突触界面结构修饰和PSD-95基因表达的影响[J].心理学报,2008,40(6):709-716.
Immunohistochemical Observation of Brain Synaptic Proteins in the Rat Models of Permanent Middle Cerebral Artery Occlusion(pMCAO)
LIU Yang1,SUN Jian-ning1,DONG Shi-fen1,LIU Ming2,ZHANG Yi1,ZHANG Shuo-feng1
(1.School of Materia Medica,Beijing University of Chinese Medicine,Beijing 100102,China;2.Guiyang College of Traditional Chinese Medicine,Guiyang 100102)
Objective To observe synaptic protein expressions in the brain of permanent middle cerebral artery occlusion(pMCAO)model rats on 2 and 7 after ischemic attack.Methods To establish a rat model of pMCAO.The rats with ischemia were randomly divided into 2-day group and 7-day group,taking rats with no occlusion as the sham group.On d 2 and d 7 post-operation,pathological changes in ischemic brain tissue were observed with H&E staining,and expression of synapsin-I,postsynaptic density protein 95(PSD-95),α-synuclein were examined with immunohistochemical staining.Results Compared with the sham group,there were a large amount of neurons lost,and degeneration and necrosis of scattered neurons in the brain tissue in the model group.On the 2ndday post-ischemia,in the model group,expressions of synapsin-I in the CA1 and CA3 regions and cortex were significantly reduced(P <0.05 or P <0.01),PSD-95 in CA1 region and cortex was significantly reduced(P < 0.05 or P < 0.01),while α-synuclein in CA1 region significantly accumulated(P <0.01).On the 7thday after ischemia,in the model group expression of synapsin-I in CA1 region and cortex were still significantly reduced(P <0.01),PSD-95 in CA1 region and cortex also significantly reduced(P <0.05 or P <0.01),and α-synuclein in CA1,CA3 regions and cortex was significantly increased(P <0.05 or P <0.01).Conclusions In the brain tissue of pMCAO model rats,expression of synaptic proteins is significantly changed and varies along with the time-course of ischemia,probably,it might be related to synapse remodeling.The expression of synapse-associated proteins is closely related to the degree of ischemic injury.
Permanent middle cerebral artery occlusion,pMCAO;rat model;Synapsin-I;PSD-95; α-synuclein
R743.3;R33
A
1671-7856(2012)08-0043-05
10.3969.j.issn.1671.7856.2012.008.010
2012-05-09

A:假手术组-CA1区 B:假手术组-CA3区 C:假手术组-皮层D:模型组-CA1区 E:模型组-CA3 F:模型组-皮层
图1 大鼠HE染色病理学观察(缺血后2 d)
Note: A: Sham group - CA1; B: Sham group - CA3; C: Sham group - cortex;D: pMCAO group - CA1; E: pMCAO group - CA3; F: pMCAO group - cortex.
Fig.1 Histopathological changes of the brain tissue at 2 days post-occlusion (HE staining).
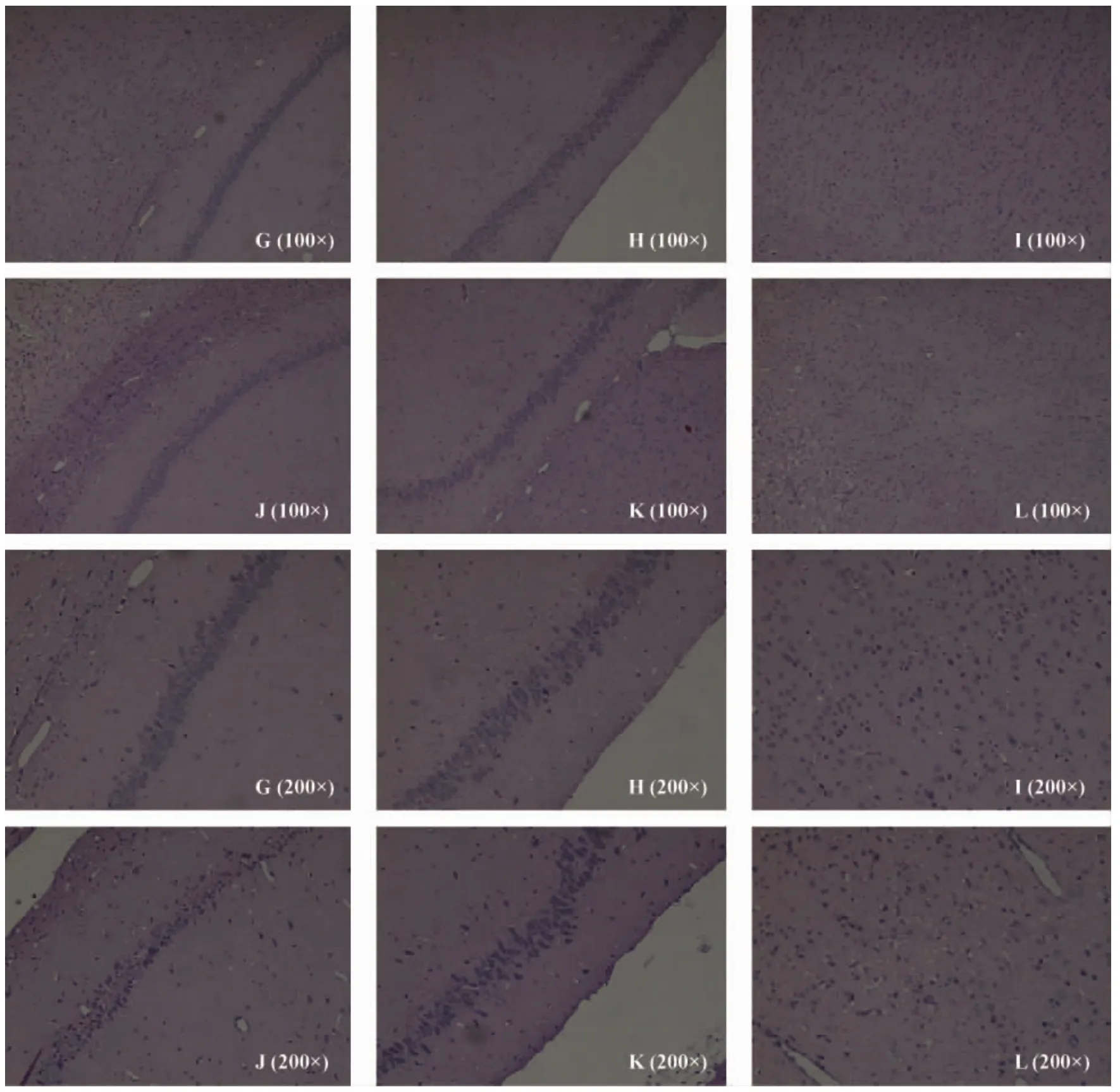
G:假手术组-CA1区 H:假手术组-CA3区 I:假手术组-皮层J:模型组-CA1区 K:模型组-CA3 L:模型组-皮层
图2 大鼠HE染色病理学观察(缺血后7 d)
Note: G: Sham group - CA1; H: Sham group - CA3; I: Sham group - cortex;J: pMCAO group - CA1; K: pMCAO group - CA3; L: pMCAO group - cortex.
Fig.2 Histopathological changes of the brain tissue in the rats at 7 days post-occlusion. HE staining
刘洋(1984-),女,博士研究生,研究方向为中药防治心脑血管疾病研究。E-mail:echoinapril@163.com。
孙建宁(1952-),女,教授,博士生导师,从事中药防治重大疾病创新药物研究,E-mail:jn_sun@sina.com。
