亚健康状态大鼠的神经-免疫-内分泌机制的研究
2012-09-17徐孝平潘永明刘瑞敏寿旗扬贾临超周卫民朱科燕陈民利
徐孝平,潘永明,刘瑞敏,寿旗扬,贾临超,周卫民,朱科燕,陈民利
(浙江中医药大学动物实验研究中心/比较医学研究中心,杭州 310053)
亚健康状态大鼠的神经-免疫-内分泌机制的研究
徐孝平,潘永明,刘瑞敏,寿旗扬,贾临超,周卫民,朱科燕,陈民利
(浙江中医药大学动物实验研究中心/比较医学研究中心,杭州 310053)
目的 探讨亚健康状态大鼠的神经-免疫-内分泌的机制。方法 取雄性SPF级Wistar大鼠36只,按体重随机分成6组,即多因素组(MF)、多因素干预组(MFT)、热水游泳组(WS)、睡眠不足组(SD)、单纯束缚组(PC)和正常对照组(C),每组6只。分别采用热水游泳、饮食限制、睡眠剥夺、束缚等方式建立亚健康大鼠模型,多因素干预组每日经口给予300 mg/kg的抗衰老片,在造模5 d后处理动物,并取大鼠血,分别测定血清5-羟色胺(5-HT)、多巴胺(DA)、甲状腺激素 T3和 T4、睾酮(T)、皮质酮(CORT)、促肾上腺皮质激素(ACTH)、白介素 IL-1β、IL-2、IL-6、IL-8和IFN-γ含量以及T淋巴细胞亚群的变化,并取脾脏测定 T、B淋巴细胞增殖能力和 NK细胞活性变化。结果(1)与正常对照组比,①造模结束后多因素组大鼠血清5-HT明显降低(P<0.05),而热水游泳组和单纯束缚组5-HT含量却升高显著(P<0.01),且睡眠不足组和单纯束缚组血清DA含量降低显著(P<0.05);同时各亚健康模型大鼠的血清T3、T4、CORT和ACTH含量均显著升高(P<0.01),T/C比值降低显著(P<0.01),且睡眠不足组血清T降低明显(P<0.05);②造模结束后多因素组的大鼠IL-8含量降低显著(P<0.01),而热水游泳组和单纯束缚组 IL-1β、IL-2、IL-6、IL-8 和 IFN-γ 含量以及睡眠不足组 IL-1β、IL-2、IL-6 含量均显著升高(P < 0.05,P <0.01),同时显著降低各亚健康模型大鼠淋巴细胞增殖转化能力和 T淋巴细胞亚群CD3+、CD4+和CD4+/CD8+比值和NK细胞活性(P<0.05,P<0.01)。(2)与多因素组比,抗衰老片干预后多因素干预组大鼠血清 DA含量明显升高(P<0.05),并能显著提高机体 T淋巴细胞亚群 CD3+、CD4+数目和 CD4+/CD8+比值(P<0.01),降低血清CORT含量。结论 亚健康状态能引起大鼠HPA轴反应性失衡,皮质醇释放过度,引起内分泌的紊乱,并能引起淋巴细胞功能降低,出现明显机体免疫抑制现象;而抗衰老片具有抗应激,提高T细胞免疫功能,改善情绪和内分泌紊乱的作用,从而达到改善亚健康体质的目的。
神经递质;免疫;内分泌;亚健康;淋巴细胞亚群;抗衰老片
随着社会科技不断发展,人们的生活节奏的日益加快和社会竞争日趋激烈,人们遭受的情绪应激逐渐增多,严重影响了人们的生活质量和工作效率。世界卫生组织(WHO)提出,亚健康状态是健康与疾病之间的临界状态[1],全球调查结果显示,全世界真正健康的仅占5%,确诊有疾病的占20%,而75%则处于亚健康状态。在美国医学界已将亚健康与艾滋病一起列为21世纪人类健康的最大敌人[2]。
目前认为亚健康状态是由于心理、生理、社会三方面因素导致机体的神经系统、内分泌系统、免疫系统整体协调失衡、功能紊乱而致,而亚健康发生发展的主要因素包括不良的生活方式和习惯、精神过度紧张和不良的心理因素刺激、环境污染的不良影响以及机体的生物学因素(个性特征和遗传因素)有关[3]。我们前期已根据亚健康形成的主要原因,采用单纯束缚、热水游泳、部分睡眠剥夺和饮食不节等造模因素复制亚健康状态大鼠模型,研究发现亚健康状态大鼠出现明显的心理因素的改变和疲劳等症状,胸腺系数的明显降低则表明亚健康状态具有免疫抑制的现象,且氧化应激亦参与亚健康的形成过程。可见,机体的神经系统、内分泌系统、免疫系统整体协调失衡、功能紊乱可能是亚健康形成的主要机制。为证实亚健康状态神经-免疫-内分泌的作用机制,本研究对亚健康状态大鼠的神经递质、内分泌激素和免疫指标进行了观察,探讨亚健康状态大鼠的神经-免疫-内分泌轴变化情况,为亚健康状态的生理病理机制的深入研究奠定基础。
1 材料和方法
1.1 实验动物
健康雄性SPF级Wistar大鼠,体质量为150 g~170 g,36只,购于中科院上海实验动物中心/上海斯莱克实验动物公司[SCXK(沪)2007-0005],饲养于浙江中医药大学动物实验研究中心屏障系统内[SYXK(浙)2008-0115],环境温度为(23 ±1)℃,相对湿度为50%~65%,饲喂全价营养颗粒饲料,自由饮水。
1.2 主要仪器与试剂
BIO-Rad 酶标仪(美国 BIO-Rad 公司),蔡司ZEISS荧光倒置显微镜(蔡司公司),Thermo CO2细胞培养箱(Thermo公司);Epics Altra流式细胞仪(美国贝克曼库尔特公司);5-羟色胺(5-HT)、多巴胺(DA)、甲状腺激素 T3、T4、睾酮(T)、皮质酮(CORT)、促肾上腺皮质激素(ACTH)、白介素 IL-1β、IL-2、IL-6、IL-8 和 IFN-γ 试剂盒由 Bio-rad 公司提供,RPMI-1640培养基购自 Gibco,胎牛血清购自杭州四季青生物工程材料有限公司,四甲基偶氮哩蓝(MTT)、刀豆蛋白 A(ConA)均为进口分装,PMS购自SIGMA,淋巴细胞分离液购自上海恒信化学试剂有限公司,NAD、INT 均购自 Amresco,YAC-1 细胞购自中国科学院上海细胞生物学研究所。抗衰老片由正大青春宝药业有限公司提供(批号:080320)。CD3+,CD4+,CD8+试剂盒:CD3+:FITC标记,CD4+:PE标记,CD8+:PE标记,均由美国eBioscience公司生产;红细胞裂解液,杭州联科生物技术有限公司生产。
1.3 动物分组及处理方法
所有大鼠适应性饲养一段时间后,按体重随机分成6组,即多因素(热水游泳、睡眠剥夺、饮食限制等因素)组、多因素药物干预组、热水游泳组、睡眠不足组、单纯束缚组和正常对照组,每组6只。各组分别作以下造模处理:(1)多因素组(multifactor group,MF):大鼠每天上午 8∶00在水温 43℃ ±0.5℃的水槽中游泳3 min,之后迅速捞起并擦干身体,放回饲养笼,在上午9∶00~19∶00将大鼠放置睡眠剥夺装置中剥夺睡眠10 h,随后放回饲养笼中,并在晚上19∶00加入足量的普通饲料,暴食1 h,20∶00取出剩余饲料,连续 5 d;(2)多因素干预组(multifactor treatment group,MFT):造型方法与多因素组相同,并于每天上午7∶50给予300 mg/kg抗衰老片浸膏粉,连续5 d;(3)热水游泳组(warm swimming group,WS):每天上午8∶00在水温(43±0.5)℃的水槽中游泳3 min,之后迅速捞起并擦干身体,放回饲养笼;上午8∶30,下午15∶30加足饲料并更换饮水瓶,连续5 d;(4)睡眠不足组 (sleep deficiency group,SD):每天 9∶00~19∶00 睡眠剥夺10 h;上午8∶30,下午15∶30加足饲料并更换饮水瓶,连续 5 d;(5)单纯束缚组(purely constraint group,PC):每天下午 14∶00~17∶00放于自制束缚桶里限制大鼠活动3 h,连续5 d;(6)正常对照组(control group,C)即不处理:每天上午 8∶30,下午15∶30加足饲料并更换饮水瓶,正常饲养。所有动物造模处理5 d后麻醉处死。亚健康大鼠模型的确定:经血生化、组织病理等检查,均未发现亚健康状态大鼠出现明显的病理变化,但大鼠已表现出精神萎靡、疲劳、反应迟钝、活力减退等。
1.4 指标观察
1.4.1 大鼠神经递质、内分泌和免疫指标的测定:大鼠麻醉后,腹主静脉取血,离心,分离血清,采用ELISA 法 测 定 血 清 5-HT、DA、T3、T4、T、CORT、ACTH、IL-1β、IL-2、IL-6、IL-8 和 IFN-γ 含量。
1.4.2 T、B淋巴细胞增殖能力测定:无菌条件下取大鼠的脾脏,加适量 Hank's液研磨,以200目不锈钢网滤过,1 500 r/m离心 5 min,弃上清液,加Hank's液重复洗涤2次。收集脾细胞,加适量RPMI 1640培养液混悬,以0.4%台盼兰拒染法计数,活细胞数不小于95%,加RPMI 1640完全培养液稀释,并调整细胞浓度至1×107个/mL。于96孔微量板中,每孔加100 μL脾细胞悬液(1×107cell/mL)和等体积的 ConA溶液(终浓度为 5 μg/mL)、LPS溶液(终浓度为10 μg/mL)或 RPMI1640培养液,重复3孔。另设空白对照组。37℃、5%CO2培养44 h后,各孔加入50 μL MTT溶液(2 mg/mL),继续培养4 h。1 000 r/min离心5 min,弃去各孔上清液,分别加150 μL酸性DMSO溶液,振荡,于室温暗处放置15 min,以酶标仪于波长578 nm处测定A值,并按下式计算刺激指数(SI):SI(刺激指数)=加有丝分裂原培养物的A值/不加有丝分裂原培养物的A值。
1.4.3 NK细胞活性测定:实验前24 h将靶细胞YAC-1传代培养,应用前以 Hank's液洗 3 次,用RPMI 1640完全培养液调整细胞浓度为2×105个/mL。无菌取脾,制备脾细胞悬液,用 Hank's液洗2次,每次离心10 min(1 000 r/min)。弃上清液将细胞浆弹起,加入0.5mL灭菌水裂解红细胞,20 s后再加入0.5mL 2倍Hanks液及8mL Hanks液,离心10 min(1 000 r/min),用 1mL含10%小牛血清的RPMI 1640完全培养液重悬,用1%冰醋酸稀释后计数,调整细胞浓度为1×107个/mL。将靶细胞加入 96 孔培养板,每孔 100 μL,试验孔加入 100 μL脾细胞(效靶比50∶1),自然释放孔加入100 μL培养液,最大释放孔加入 100 μL 2%NP40,37℃培养4 h,离心,取上清液100 μL置96孔酶标板中,加入LDH 基质液 100 μL,反应 8 min,以 30 μL 1mol/L 的HCl终止反应,在酶标仪492 nm处测定A值。
NK细胞活性(%)=(反应孔A-自然释放孔A)/(最大释放孔A-自然释放孔A)×100%
1.4.4 T淋巴细胞亚群测定:取血加抗体,大鼠眼眶取血1mL,用EDTAk3血常规管抗凝全血,试管标号;取50 μL抗凝全血,分别加入试管①、试管②,直接加至底部,且不可触壁;试管①统一加5 μL抗体CD3+和 5 μL 抗体 CD4+,试管②统一加 5 μL 抗体CD3+和5 μL抗体 CD8+,用振荡器混匀后暗室放置20~30 min,使抗体与血样充分结合;避光常温30 min后,加裂解液:试管在振荡中加入500 μL裂解液,在30℃水浴中放置15 min,使细胞充分裂解,达到透亮;裂解后,1 500 r/min离心5 min,倒去上清液,用PBS液洗两遍,加1mL PBS液,1 500 r/min离心5 min,后倒去上清液;再加1mL PBS液,1 500 r/min离心5 min;离心后倒去上液;加500 μL PBS液,再用Epics Altra流式细胞仪检测。
1.5 数据统计学处理
2 结果
2.1 亚健康模型大鼠血清5-HT和多巴胺含量的变化
与正常对照组比,造模5 d后多因素组的大鼠血清5-HT和 DA含量均出现降低,其中血清5-HT降低显著(P<0.05),而热水游泳组、睡眠不足组和单纯束缚组的大鼠血清5-HT含量均出现升高和DA含量的降低,且以热水游泳组和单纯束缚组升高5-HT含量显著(P<0.01),同时,睡眠不足组和单纯束缚组的大鼠血清DA含量均显著降低(P<0.05);与多因素组比,抗衰老片干预后多因素干预组大鼠具有升高5-HT含量和DA含量的作用,其中DA升高显著(P<0.05),见表1。
另外,与正常对照组比,造模5d后多因素组、热水游泳组、睡眠不足组、单纯束缚组大鼠的血清T3、T4均明显升高(P<0.01);与多因素组比,抗衰老片干预后多因素干预组的大鼠T3、T4含量均有降低趋势,但差异不显著(P>0.05),见表1。
2.2 亚健康模型大鼠血清睾酮(T)、皮质酮(CORT)和促肾上腺皮质激素(ACTH)含量的变化
与正常对照组比,造模5 d后,各亚健康模型大鼠的睾酮T含量出现降低,其中睡眠不足组降低显著(P<0.05),同时各亚健康模型大鼠伴有皮质酮CORT和促肾上腺皮质激素ACTH含量的显著升高(P<0.01),且引起T/C比值降低显著(P<0.01);与多因素组比,抗衰老片干预后多因素干预组能升高T、T/C和降低CORT含量的趋势(P>0.05),见表2。
2.3 亚健康模型大鼠血清 IL-1β、IL-2、IL-6、IL-8和IFN-γ含量的变化
与正常对照组比,造模5d后多因素组的大鼠IL-1β、IL-2、IL-6 有上升趋势,但 IL-8 和 IFN-γ 含量均有所降低,其中IL-8含量降低显著(P<0.01),而热水游泳组和单纯束缚组的大鼠 IL-1β、IL-2、IL-6、IL-8 和 IFN-γ 含 量均显著升高(P <0.05,P <0.01),睡眠不足组的大鼠 IL-1β、IL-2、IL-6 含量均显著升高(P <0.05,P <0.01),而 IL-8 和 IFN-γ 含量虽有升高,但差异不显著(P>0.05);抗衰老片干预后多因素干预组与多因素组和正常对照组比差异均不显著(P>0.05),见表3。
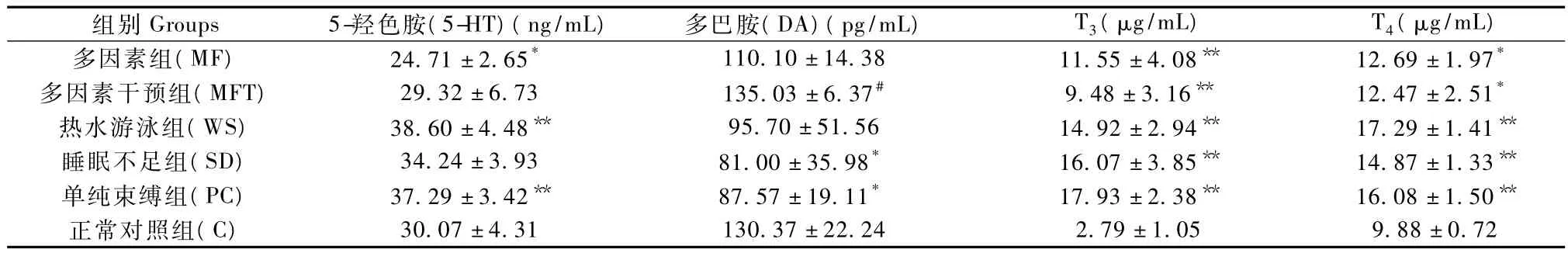
表1 各组亚健康模型大鼠血清5-羟色胺(5-HT)、多巴胺(DA)、甲状腺激素 T3、T4含量的变化(x±s,n=6)Tab.1 The changes of 5-HT,DA,T3and T4contents in the sub-health rats(x±s,n=6)
表2 各组亚健康模型大鼠血清T、CORT、T/C和ACTH含量的变化(±s,n=6)Tab.2 The changes of T,CORT,T/C and ACTH contents in the sub-health rats
注:与正常对照组比,*P <0.05,**P <0.01;多因素组与多因素干预组比,#P <0.05,##P <0.01.Note:Compared with the control group,*P <0.05,**P <0.01;Compared between the MF and MFT groups,#P <0.05,##P <0.01.
组别Groups 睾酮(T)(ng/mL)皮质酮(CORT)(ng/mL)睾酮/皮质酮T/C 促肾上腺皮质激素(ACTH)(pg/mL)多因素组(MF)10.48±2.66 273.05±53.37** 0.04±0.02** 198.14±25.17**09多因素干预组(MFT)11.98±5.49 243.34±44.67** 0.05±0.02** 205.08±51.38**热水游泳组(WS)8.51±1.62 168.38±17.72** 0.05±0.02** 174.82±65.28**睡眠不足组(SD)6.90±1.18* 225.15±77.78** 0.03±0.01** 167.63±30.15**单纯束缚组(PC)9.35±2.50 301.29±80.05** 0.03±0.01** 206.22±94.00**正常对照组(C)13.18±4.24 31.91±13.81 0.42±0.27 56.68±28.
表3 各组亚健康模型大鼠血清 IL-1β、IL-2、IL-6、IL-8 和 IFN-γ 含量的变化(±s,n=6)Tab.3 The changes of IL-1β,IL-2,IL-6,IL-8 and IFN-γ contents in the sub-health rats
注:与正常对照组比,*P <0.05,**P <0.01;多因素组与多因素干预组比,#P <0.05,##P <0.01.Note:Compared with the control group,*P <0.05,**P <0.01;Compared between the MF and MFT groups,#P <0.05,##P <0.01.
组别 Groups IL-1β(pg/ml)IL-2(pg/ml)IL-6(pg/ml)IL-8(pg/ml)IFN-γ(pg/ml)多因素组(MF)183.03±6.76 336.79±16.72 329.96±36.19 601.14±58.37**.97±94.87 605.09±92.44 528.46±57.12多因素干预组(MFT)200.17±26.80 341.36±44.17 300.45±47.67 685.49±128.02 575.58±89.98热水游泳组(WS)220.80±22.54** 390.48±31.74** 390.06±43.40** 884.55±34.97* 722.29±65.04*睡眠不足组(SD)210.47±17.11** 386.30±40.98* 379.35±36.16** 836.94±75.75 636.27±66.62单纯束缚组(PC)218.42±18.64** 434.01±50.35** 439.05±26.25** 940.79±68.82** 751.44±100.10*正常对照组(C)173.24±10.90 320.27±34.45 289.74±32.64 759
2.4 亚健康模型大鼠NK细胞、淋巴细胞增殖转化能力的变化
与正常对照组比,造模5 d后各亚健康模型大鼠NK细胞均有所下降,其中多因素组、多因素干预组、睡眠不足组、单纯束缚组降低显著(P<0.05,P<0.01);而各亚健康模型大鼠淋巴细胞增殖转化能力均显著降低(P<0.05,P<0.01);与多因素组比,抗衰老片干预后多因素干预组的大鼠NK细胞、淋巴细胞增殖转化能力均有所上升,但差异不显著(P >0.05),见表4。
表4 各组亚健康模型大鼠NK细胞、淋巴细胞增殖转化能力的影响(± s,n=6)Tab.4 The changes of NK cells and lymphocyte proliferation ability in the sub-health rats
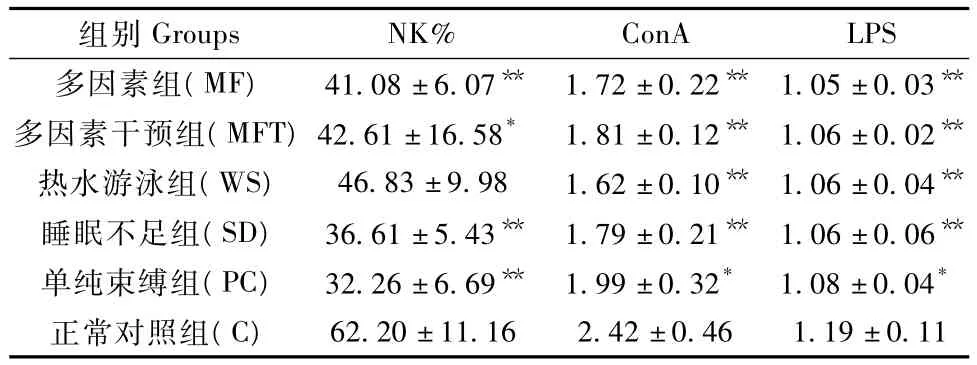
表4 各组亚健康模型大鼠NK细胞、淋巴细胞增殖转化能力的影响(± s,n=6)Tab.4 The changes of NK cells and lymphocyte proliferation ability in the sub-health rats
注:与正常对照组比,*P<0.05,**P<0.01;多因素组与多因素干预组比,#P<0.05,##P<0.01.Note:Compared with the control group,*P < 0.05,**P < 0.01;Compared between the MF and MFT groups,#P <0.05,##P <0.01.
Groups NK% ConA LPS多因素组(MF)41.08±6.07** 1.72±0.22** 1.05±0.03组别**62.20±11.16 2.42±0.46 1.19±0.11多因素干预组(MFT)42.61±16.58* 1.81±0.12** 1.06±0.02**热水游泳组(WS)46.83±9.98 1.62±0.10** 1.06±0.04**睡眠不足组(SD)36.61 ±5.43** 1.79 ±0.21** 1.06 ±0.06**单纯束缚组(PC)32.26±6.69** 1.99±0.32* 1.08±0.04*正常对照组(C)
2.5 各亚健康模型大鼠T淋巴细胞亚群的变化
与正常对照组比,造模5 d后各亚健康模型大鼠T淋巴细胞亚群 CD3+、CD4+和 CD4+/CD8+比值显著降低(P<0.01),而CD8+与正常对照组差异无显著性(P>0.05);与多因素组比,抗衰老片干预后多因素干预组的 CD3+、CD4+和 CD4+/CD8+比值显著升高(P<0.01),见表5。
表5 各组亚健康模型大鼠T淋巴细胞亚群的变化(± s,n=6)Tab.5 Changes of T lymphocyte subpopulations in the sub-health rats
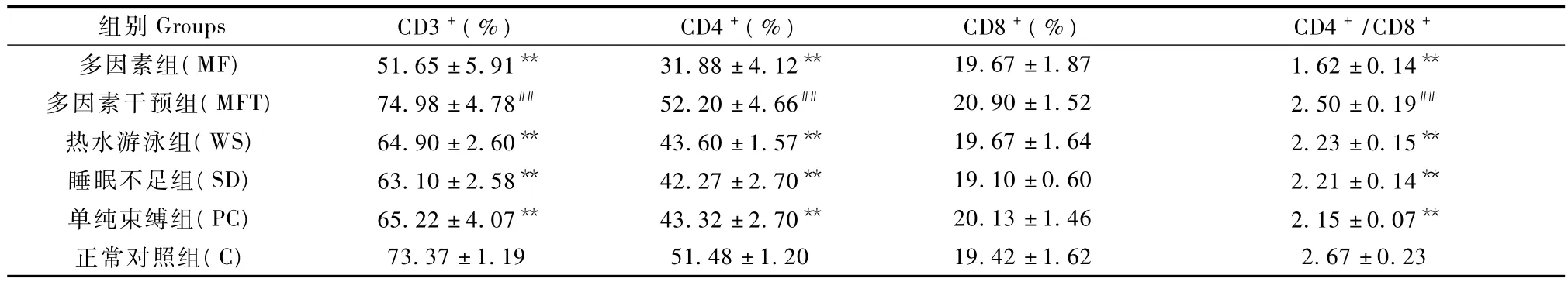
表5 各组亚健康模型大鼠T淋巴细胞亚群的变化(± s,n=6)Tab.5 Changes of T lymphocyte subpopulations in the sub-health rats
注:与正常对照组比,*P <0.05,**P <0.01;多因素组与多因素干预组比,#P <0.05,##P <0.01.Note:Compared to control group,*P <0.05,**P <0.01;Compared between the MF and MFT groups,#P <0.05,##P <0.01.
组别Groups CD3+(%)CD4+(%)CD8+(%)CD4+/CD8+多因素组(MF)51.65±5.91** 31.88±4.12** 19.67±1.87 1.62±0.14**73.37±1.19 51.48±1.20 19.42±1.62 2.67±0.23多因素干预组(MFT)74.98±4.78## 52.20±4.66## 20.90±1.52 2.50±0.19##热水游泳组(WS)64.90±2.60** 43.60±1.57** 19.67±1.64 2.23±0.15**睡眠不足组(SD)63.10±2.58** 42.27±2.70** 19.10±0.60 2.21±0.14**单纯束缚组(PC)65.22±4.07** 43.32±2.70** 20.13±1.46 2.15±0.07**正常对照组(C)
3 讨论
亚健康态是介于健康与疾病两个状态之间,是稳态的相对失衡的状态,此时,神经、内分泌、免疫系统呈现一定紊乱,自主调节能力降低,人体出现疾病症状,但物理生化检查往往难以发现明显体征异常。已有研究发现,5-HT是中枢及外周神经系统的重要神经递质,且在调节机体的情绪方面具有相当重要的作用,但5-HT对HPA轴的调节作用,目前尚存在争议。已有研究表明5-HT的增加对失眠、精神状态、感知能力和肌肉疲劳程度等都可能产生影响,5-HT活性增强可能与慢性疲劳综合征有关[4];相反,亦有研究认为抑郁状态、抑郁症时人体内 5-HT 含量显著降低[5],詹向红等[6]的研究发现愤怒应激能使5-HT水平降低。本实验结果显示,热水游泳组、睡眠不足组和单纯束缚组的大鼠血清5-HT含量明显升高,而多因素组的大鼠血清5-HT含量则显著降低,均可表明各亚健康状态大鼠的情绪出现明显的变化,且5-HT含量变化趋势的不同可能与应激程度和因素有关。另外,本研究结果亦显示,各亚健康状态大鼠的血清DA含量均明显降低,DA作为一种中枢神经递质,也参与调控精神活动,研究表明,在反复长期心理应激情况下,能使大量的DA被耗竭,最终导致 DA含量的降低[5],而DA活性的降低,可使肌肉活动的协调能力降低,导致疲劳加剧,可见,各亚健康状态的大鼠出现明显的情绪波动和疲劳状态,提示亚健康状态能引起单胺类神经递质的异常,可能是亚健康状态的生理病理机制之一。
现代医学研究表明,下丘脑-垂体-肾上腺皮质(HPA)轴能调控促肾上腺皮质激素、肾上腺糖皮质激素(GC)的分泌,进而影响与应激有关的行为、神经内分泌免疫活动,慢性心理应激可使血液中皮质酮持续升高,引起血液中糖皮质激素积累,造成内分泌代谢过分增加[7]。甲状腺激素 T3、T4是反映甲状腺功能的重要指标,本实验结果显示,各亚健康状态的大鼠血清甲状腺激素 T3、T4以及皮质酮(CORT)和促肾上腺皮质激素(ACTH)含量升高,睾酮(T)含量降低,引起T/CORT比值的降低,提示亚健康状态能引起下丘脑-垂体-甲状腺轴、下丘脑-垂体-肾上腺皮质轴和下丘脑-垂体-性腺轴功能紊乱,使甲状腺激素、皮质酮与睾酮分泌异常,导致内分泌代谢出现紊乱。但CORT的分泌又可以反馈抑制ACTH和促肾上腺皮质激素释放激素(CRH)的生成,形成了HPA轴的环行调节通路,但在应激的作用下,上述负反馈抑制效应减弱,从而出现ACTH和CORT的分泌增加,导致 HPA轴功能的亢进[8],从而使亚健康大鼠产生紧张、焦虑、愤怒或抑郁的情绪变化和行为改变,以及免疫力和记忆能力的下降等。
心理神经免疫学的研究表明,心理应激因素可通过影响中枢神经和内分泌系统来改变机体的免疫能力。结果显示,热水游泳组、睡眠不足组和单纯束缚组的大鼠血清 IL-1β、IL-2、IL-6、IL-8 和 IFN-γ活性均显著升高,而多因素组的大鼠血清 IL-1β、IL-2、IL-6 活性有上升趋势,但 IL-8 和 IFN-γ 活性均有所下降,从以上结果显示各亚健康状态大鼠 IL-1β、IL-2、IL-6 活性的升高,可能是由于亚健康状态形成过程中体内发热和骨骼肌的损伤,使得 IL-1β升高,参与刺激肌肉蛋白质的分解代谢。也有研究表明,IL-1β和 IL-6除了参与调节免疫功能外,对机体的代谢功能亦有密切的联系[9,10]。IL-1β 作用于HPA轴引起 CORT分泌增加,促进血糖升高的作用[11],这与我们前面所研究的各亚健康大鼠血糖升高较为一致,表明亚健康状态大鼠的血清 IL-1β浓度增加主要是促进 CORT分泌以升高血糖,Albert Moraska[12]认为机体处于应激状态时,IL-1β 浓度的增加对免疫功能也有抑制作用。IL-2主要由淋巴细胞亚群 TCD4+和 TCD8+产生,NK细胞和 LAK细胞也可产生,IL-1β 亦能促进 T 细胞产生 IL-2[7],而亚健康状态大鼠血清 IL-1β活性升高促进 IL-2升高;另外,由于HPA轴调节激活 T细胞分泌 IL-2,且在亚健康形成过程中皮质酮大量的释放亦会导致IL-2升高。IL-6是一种致炎因子,由Th2细胞分泌,参与介导体液免疫功能,在炎症和感染时生成和释放增加。Nukina等[13]研究表明束缚应激可通过中枢和外周儿茶酚胺升高血浆IL-6的活性水平,亦有报道认为运动时的血浆细胞因子,尤其是IL-6主要来源于收缩的骨骼肌细胞,而不是免疫细胞,并认为运动过程中肌肉产生的 IL-6 有免疫抑制作用[9],IL-6可通过促进肾上腺皮质分泌 CORT,使血糖升高。IL-8是一种由单核细胞、内皮细胞及巨噬细胞等产生的中性粒细胞激活蛋白,具有趋化和激活多形核白细胞作用,可升高细胞内 Ca2+的浓度等,研究发现IL-8在多器官功能障碍至衰竭的发展过程具有重要作用,并在创伤性疾病中机体IL-8活性明显升高[14],但张银娥等[7]研究认为慢性心理应激大鼠血清IL-8活性明显降低,本研究结果显示,热水游泳组、睡眠不足组和单纯束缚组的大鼠血清IL-8活性明显升高,而采用多因素造模的大鼠血清IL-8活性明显降低,可能与应激的程度和时间的不同,导致HPA轴反应性和皮质酮释放程度的差异所致,但IL-8活性的变化可表明亚健康状态形成过程炎症反应参与其中。IFN-γ主要由 Th1细胞分泌,介导细胞免疫反应,能诱导单核细胞、巨噬细胞、树突状细胞等MHCⅡ类抗原的表达,使其参与抗原提呈和特异性免疫的识别过程。因此,IFN-γ在细胞免疫中具有重要激活作用,有研究表明心理应激可引起循环血中 IFN-γ的升高[15],本研究结果显示,热水游泳组、睡眠不足组和单纯束缚组的大鼠血清 IFN-γ活性均有所升高,证实各亚健康状态大鼠出现明显的心理应激变化,而卢莉等[16]研究认为慢性应激组小鼠血清中IFN-γ水平明显下降,表明慢性应激可抑制Th1类细胞因子,使Th1/Th2的平衡向Th2偏移,从而引起机体的细胞免疫功能下降,导致机体的防御能力下降,而本研究的多因素组的大鼠血清IFN-γ活性亦出现下降趋势,提示可能由于应激程度和时间的不同,导致其介导的HPA轴和交感神经系统(SNS)通路在不同的造模过程中起决定性因素有所不同。
另外,本研究采用脾淋巴细胞增殖实验和 NK细胞释放实验进一步评估各亚健康状态大鼠的免疫状态,结果显示,亚健康状态的大鼠可抑制ConA、LPS诱导的脾细胞增殖反应;其中ConA诱导的脾细胞增殖反应可反映T细胞功能,LPS诱导的脾细胞增殖反应可反应B细胞的功能,表明亚健康状态可引起T、B细胞功能的减退,提示细胞免疫和体液免疫功能降低;NK细胞释放实验结果亦显示亚健康状态的大鼠NK细胞活性显著降低,即出现明显的机体细胞免疫功能的降低。T细胞是机体内重要的免疫细胞,根据表面分子可分为 CD3+、CD4+、CD8+等,因此,机体内 CD3+、CD4+、CD8+数目的变化是机体免疫功能变化的重要标志,有研究表明,心理应激会引起机体 T细胞亚群的数目减少[17]。本研究结果显示,各亚健康状态大鼠 CD3+、CD4+数目明显减少,CD8+数目变化不明显,CD4+/CD8+比值显著降低,表明亚健康状态大鼠出现了明显的免疫抑制,这与罗威和傅京丽等[18,19]报道临床慢性疲劳综合症患者 CD3+、CD4+数目明显减少较为一致。
抗衰老片是目前国内有较大知名度的抗衰老中成药,具有抗氧化应激和提高免疫功能的作用[20-23],本研究对多因素造模的大鼠采用抗衰老片干预后,结果显示,多因素干预组的大鼠明显升高血清DA,提高机体T淋巴细胞亚群 CD3+、CD4+数目和CD4+/CD8+比值的作用,降低血清 CORT含量,提示抗衰老片具有抗应激,提高T细胞免疫功能,改善情绪和内分泌紊乱的作用。
[1]王广仪.微量元素与亚健康[J].微量元素与健康研究,2010,27(4):54-57.
[2]董玉整.“亚健康”初探[J].广州医学院报,1988,26(3):77-78.
[3]何宝先.亚健康人群的健康管理及其干预措施[J].河南预防医学杂志,2009,20(3):224-225.
[4]陈易新,王天芳,季绍良,等.慢性疲劳病理机制的实验研究—慢性束缚致大鼠慢性疲劳动物模型单胺类物质的改变及中药调节作用[J].中国中医基础医学杂志,2000,6(4):23-26.
[5]李艳,严灿,史亚飞,等.反复心理应激大鼠血浆和下丘脑单胺神经递质的变化及加味四逆散的影响[J].中药药理与临床,2002,18(1):1-3.
[6]詹向红,李伟,赵君玫,等.慢性愤怒应激对大鼠衰老进程及其神经内分泌免疫机制的影响[J].中华中医药杂志,2010,25(1):111-113.
[7]张银娥,宋辉,杨惠芳,等.运动对慢性心理应激大鼠行为及血清皮质醇、IL-2、IL-8的影响[J].中国工业医学杂志,2007,20(2):79-85.
[8]Holsboer F.Prospects for antidepressant drug discovery[J].Biol Psychol,2001,57(1/3):47-65.
[9]何伟.运动与细胞因子的研究进展[J].体育科学,2005,25(7):63-67.
[10]Febbraio MA., Pedersen BK.Muscle-derived Interleukin-6:mechanisms for activation and possible biological roles[J].FASEB J,2002,16:1335-1347.
[11]Suzuki K,Totsuka M,Nakaji S,et al.Endurance exercise causes interaction among stress hormones,cytokines,neutrophil dynamics,and muscle damage[J].J Appl Physiol,1999,87:1360-1367.
[12]Moraska A,Campisi J,Kien T.et al.Elevated IL-1 contributes to antibody suppression produced by stress[J].J Appl Physiol,2002,93(6):207-215.
[13]Nukina H,Sudo N,Aiba Y,et al.Restraint stress elevates the plasma interleukin-6 levels in germ-free mice [J].J Neuroimmunol,2001,115:46-52.
[14]梁红萍.清热解毒法对肢体创伤患者血清细胞因子 IL-8、IL-1β、TNF-α 的影响[J]. 中华中医药学刊,2010,28(8):1751-1752.
[15]Chida Y,Sudo N,Kubo C.Social isolation stress exacerbates autoimmune disease in MRL/lpr mice[J].J Neruoimmunol.2005,158(1-2):138-144.
[16]卢莉,李敏芳 薛朝霞,等.慢性应激对小鼠心理行为及血清IFN-γ、IL-4水平的影响[J]. 中国健康心理学杂志,2010,18(8):1013-1014.
[17]肖春梅,尹玲.中小负荷运动及慢性情绪应激对免疫机能的影响[J].北京体育大学学报,2007,30(7):919-921.
[18]罗威,肖红茂,冯小武,等.慢性疲劳综合征对人体T淋细胞亚群及健康的影响[J].现代诊断与治疗,2007,18(2):114-115.
[19]傅京丽.慢性疲劳综合征与心身疾病[J].辽宁医学杂志,1999,13(2):68-69.
[20]鲁 珽,潘永明,冷晓霞,等.抗衰老片对实验性肾阳虚小鼠免疫功能的影响[J].甘肃中医学院学报,2011,28(2):8-11.
[21]陶 涛,潘永明,冷晓霞,等.抗衰老片对衰老大鼠学习记忆和自由基代谢的影响[J].浙江中医药大学学报,2009,33(6):751-753.
[22]谢日青,冷晓霞,陈民利,等.束缚应激致亚健康状态大鼠氧自由基变化及中药干预作用[J].实验动物与比较医学,2010,30(2):121-123.
[23]肖 慧,冷晓霞,陈民利,等.束缚应激致亚健康状态大鼠的行为学改变及中药的干预作用[J].实验动物与比较医学,2010,30(2)124-128.
Study on the Mechanism of Neuro-Immuno-Endocrine System of Rats in Sub-Health State
XU Xiao-ping,PAN Yong-ming,LIU Rui-min,SHOU Qi-yang,JIA Lin-chao,ZHOU Wei-min,ZHU Ke-yan,CHEN Min-li
(Zhejiang Chinese Medical University Laboratory Animal Research Center/Comparative Medical Research Center,Hangzhou 310053,China)
Objective To explore the mechanism of neuro-immuno-endocrine system of rats in sub-health state.Methods Thirty-six male SPF Wistar rats were randomly divided into six groups:multi-factor group(MF),multifactor treatment group(MFT),warm water swimming group(WS),sleep deficiency group(SD),purely constraint group(PC)and control group(C),six animals in each group.Respectively,using warm water swimming,dietary restrictions,sleep deprivation and constraint to establish sub-health rat models,and daily orally administered 300 mg/kg anti-aging tablet in the MFT group.At 5 days after modeling,the levels of serum 5-HT,DA,T3,T4,T,CORT,ACTH,IL-1β,IL-2,IL-6,IL-8,IFN-γ and T lymphocyte subsets were detected,and changes of T and B lymphocyte proliferation and NK cell activity in the spleen were also determined.Results(1)Compared with the control group,① Serum 5-HT in the MF group was significantly reduced(P <0.05),while 5-HT in the WS and PC groups was significantly increased(P <0.01),and the serum DA content in the SD and PC groups was significantly decreased(P <0.05).At the same time,the serum T3,T4,CORT and ACTH contents in each sub-health model rats were significantly increased(P < 0.01),T/C ratio was significantly decreased(P<0.01),and the serum T in the SD group was significantly lowered(P<0.05);② Sserum IL-8 content in the MF group was significantly reduced(P < 0.01),while the serum IL-1β,IL-2,IL-6,IL-8 and IFN-γ levels in the WS and PC groups,and IL-1β,IL-2 and IL-6 levels in the SD group were all significantly increased(P <0.05,P<0.01),and the lymphocyte proliferation and T lymphocyte subsets CD3+,CD4+,CD4+/CD8+ratio and NK cell activity were significantly reduced in all sub-health model rats(P <0.05,P <0.01).(2)Compared with the MF group,the administration of anti-aging tablets induced significantly increased serum DA content in the MFT group(P < 0.05),and significantly improved the T lymphocyte subsets CD3+,CD4+,CD4+/CD8+ratio(P <0.01),and lowered serum CORT content.Conclusions Sub-health state can lead to imbalances of the rat HPA axis,excessive cortisol release,endocrine disorders,reduced lymphocyte function and immune inhibition,while anti-aging tablets have anti-stress effects,enhancing T cell immune function and ameliorating emotional and endocrine disorders,so as to achieve the purpose of improving the sub-healthy physique.
Neurotransmitter;Immune;Endocrine;Sub-health;Lymphocyte subsets;Anti-aging tablets;Rats
R33
A
1671-7856(2012)08-0033-07
10.3969.j.issn.1671.7856.2012.008.008
2012-06-05
1.浙江省中医“治未病”研究专项(中医证候亚健康大鼠模型的建立及其比较学研究,2007WB022);2.受“浙江省卫生高层次创新人才培养工程项目”资助。
徐孝平(1978-),男,实验师,研究方向:实验动物与比较医学。E-mail:xxp0001@126.com。
陈民利(1963-),女,教授,硕导,研究方向:比较医学。E-mail:minlichen01@yahoo.com.cn。
