分散液相微萃取−气相色谱法测定水样中的多溴联苯醚
2012-09-17
(江苏大学 环境学院,江苏 镇江,212013)
多溴联苯醚(PBDEs)是溴代阻燃剂的一种,也是一种新型的环境持久性有机污染物(POPs),具有持久性、低水溶性、生物富集性和生物毒性等特点[1],并可在全球范围内长距离迁移。该类物质被广泛地应用于电子产品、纺织品以及建筑设备等产品中,以提高其防火性能。PBDEs可以随废弃的电子产品、工业产品等进入环境中,目前已在土壤[2−3]、沉积物[4−5]、水体[6−7]、大气[8−9]、生物体[10−11]、人体血液[12−13]和母乳[14]等多种介质中检测到该类物质。由于PBDEs水溶性小,水体中 PBDEs以痕量级存在,而水环境又在PBDEs的全球循环中承担十分重要的角色,故精确检测水体中PBDEs的含量对控制其污染具有很大意义。目前,常用于液体样品的前处理方法有液液萃取法(LLE)[15]、搅拌子吸附法(SBSE)[16]、固相萃取法(SPE)[17]和固相微萃取法(SPME)[18]。但是,液液萃取法操作复杂,且有毒有机溶剂用量很大,检出限差;搅拌子吸附的搅拌棒涂层材料种类较少,限制了其应用;固相萃取的操作繁琐,样品用量较大且组分易损失;固相微萃取装置的纤维头价格昂贵且寿命短,多次易产生交叉污染问题。分散液相微萃取法(DLLME)是由Rezaee等[7]于2006年提出的一种新型的样品前处理技术,该法由于操作简单、有机溶剂用量少,耗时短、对环境友好且富集效率高等优点而被广泛应用。高溴代的PBDEs会发生降解(主要是光降解)生成低溴代的PBDEs(如BDE-15等)[19],已有很多学者对BDE-15进行了研究[20−22]。本文作者采用分散液相微萃取法与气相色谱法相结合,着重对水体中的BDE-15进行分析测定,建立水体中痕量低溴代PBDEs的DLLME-GC分析法,并对其回收率、富集倍数、检出限和精密度进行研究。
1 实验部分
1.1 仪器设备
仪器设备有:GC−2010ATF气相色谱仪(日本岛津公司制造);低速离心机(上海分析器械厂制造);氮吹仪(北京康林科技有限责任公司制造);10 mL尖底离心管;10和50 µL微量进样器(上海安亭微量进样器厂制造)。
1.2 试剂及药品
多溴联苯醚(PBDEs)标品:BDE-15 (Chem Service,Inc.生产);PBDEs标样用甲醇稀释后作为标准储备液于冰箱中冷藏,标准系列由标准储备液逐级稀释而成;甲醇、正己烷、丙酮、乙腈、三氯甲烷、二氯甲烷、四氯乙烷、氯苯和四氯化碳(分析纯,国药集团化学试剂有限公司生产,二次蒸馏);实验室用水均为二次蒸馏水;实际水样有取自江苏省镇江市市区窨井的生活污水和上海崇明岛入海口水,水样经过0.45 µm滤膜过滤后再使用。
1.3 分散液相微萃取步骤
精确量取5.0 mL含目标物的水溶液于10 mL尖底离心管中,然后将含有30 μL四氯乙烷(萃取剂)的1.0 mL丙酮(分散剂)快速注入水样中,振荡摇匀,离心管中形成乳浊液体系,于室温放置10.0 min,再以3 000 r/min离心5 min,萃取剂将沉于离心管底部尖端形成沉积相;用50 μL微量注射器移取沉积相于另一离心管中,氮气吹干,残渣用20 μL正己烷溶解,取1.0 μL进GC进行分析。
1.4 气相色谱条件
色谱柱为 RTX−5毛细管柱(长×内径为 30.0 m×0.32 mm,液膜厚度为0.50 μm),电子捕获检测器(ECD)。进样口温度为280 ℃,柱前压为100 kPa,无分流进样,进样量为1 μL,载气为N2。柱升温程序如下:初始温度为180 ℃,停留5 min,再以4 ℃/min的速度升至210 ℃并保持3 min。ECD检测器温度320℃,尾吹气流速为50 mL/min。
1.5 标准曲线的绘制
配制质量浓度为0.1~50 μg/L的5个系列多溴联苯醚水溶液,然后按照参数液相微萃取步骤进行萃取与测定。每种质量浓度平行测定3次,以分析物的峰面积Y对浓度ρ(μg/L)作标准曲线。
2 结果和讨论
富集因子和萃取回收率是评价分散液相微萃取法萃取性能的重要参数,Rezaee等[7]对分散液相微萃取法的富集倍数和回收率进行的定义:富集因子(αCF)是沉积相中目标物的浓度(csed)与分析物的初始浓度(c0)之比,即

萃取回收率(ηER)为沉积相中提取出来的目标物的量(nsed)与目标物的总量(n0)之比,计算公式为:

其中:Vsed和Vaq分别为沉积相和样品溶液体积。
2.1 分散液相微萃取的萃取条件优化
2.1.1 萃取剂和分散剂种类的选择
萃取剂和分散剂是影响分散液相微萃取法的重要因素,能显著影响目标物的回收率及其富集因子。萃取剂需符合以下条件:密度大于水的密度;不溶于水或在水中溶解度低;对目标物的溶解能力大;有良好的色谱行为;与分散剂混合后在水溶液中能形成稳定的两相系统。而分散剂则必须满足不仅能与水互溶,而且要与萃取剂能互溶,使萃取剂在水相中形成细小的液滴,并使溶液形成稳定的乳浊液体系,增大萃取剂与目标物的接触面积,以得到较高的萃取效率。基于以上因素,本实验分别考察了二氯甲烷(密度:1.33 g/mL)、三氯甲烷(1.47 g/mL)、四氯化碳(1.59 g/mL)、四氯乙烷(1.60 g/mL)、氯苯(1.11 g/mL)作为萃取剂(50µL)和甲醇、乙腈、丙酮作为分散剂(1 mL )时对BDE-15的萃取能力。具体方法是将萃取剂和分散剂两两组合,比较每组对BDE-15的回收率,以得到最佳组合。
二氯甲烷与任何一种分散剂都不能形成稳定的两相系统,其他各组组合的结果如图1所示。由图1可以看出:当使用四氯乙烷作为萃取剂、丙酮作为分散剂时,BDE-15的回收率最大,故采用该组合作为后续实验的萃取剂和分散剂。
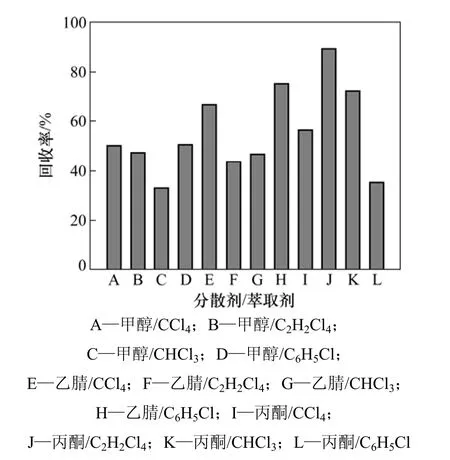
图1 分散剂和萃取剂对BDE-15萃取回收率的影响Fig.1 Effect of disperser and extraction solvent on extraction recovery
2.1.2 萃取剂体积的选择
为了考察萃取剂体积对萃取效率的影响,实验通过用含有不同四氯乙烷体积(20.0,30.0,40.0,50.0和60.0 µL)的丙酮溶液(1.0 mL)作为萃取液进行萃取。图2所示为目标物萃取回收率以及富集因子与萃取剂体积的关系图。由图2可以看出:回收率随萃取剂体积的增加而增大,但当萃取剂体积超过 30 µL后,BDE-15的回收率变化不大,说明在实验条件下,即使四氯乙烷的体积小,形成的细微液滴与水样中目标物也有很大的接触面积,可以达到对BDE-15的萃取要求。
另一方面,随着萃取剂体积增大(20.0~60.0 µL),相应的沉积相体积也会增大(15.0~55.0 µL)。而沉积相体积的增加会导致方法的富集因子下降,如图2所示。从图2可以看出:当萃取剂体积为30 µL时,富集因子最大,可达到166.3。故选用30 µL作为最佳萃取剂体积。
2.1.3 分散剂体积的选择
分散剂影响萃取剂在水中的分散程度,进而影响萃取效率。考察了丙酮体积分别为0.50,0.75,1.00,1.25和1.50 mL时对萃取回收率的影响(四氯乙烷体积30.0 µL),结果如图3所示。由图3可以看出:萃取回收率随丙酮体积的增加而增大,在 1.0 mL时达到最大,随着丙酮体积的进一步增加回收率反而减小。这主要是由于丙酮体积小于1.0 mL时,萃取剂不能很好地分散在水溶液中,传质效果差,萃取效率低;而当丙酮体积大于1.0 mL时,BDE-15在水溶液中的溶解度增大,使其不易被四氯乙烷萃取,故回收率下降。因此,选择分散剂丙酮的最佳体积为1.0 mL。
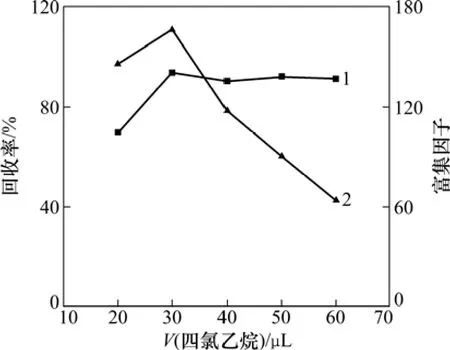
图2 萃取剂体积对BDE-15萃取回收率和富集因子的影响Fig.2 Effect of extraction solvent volume on extraction recovery and concentration factor
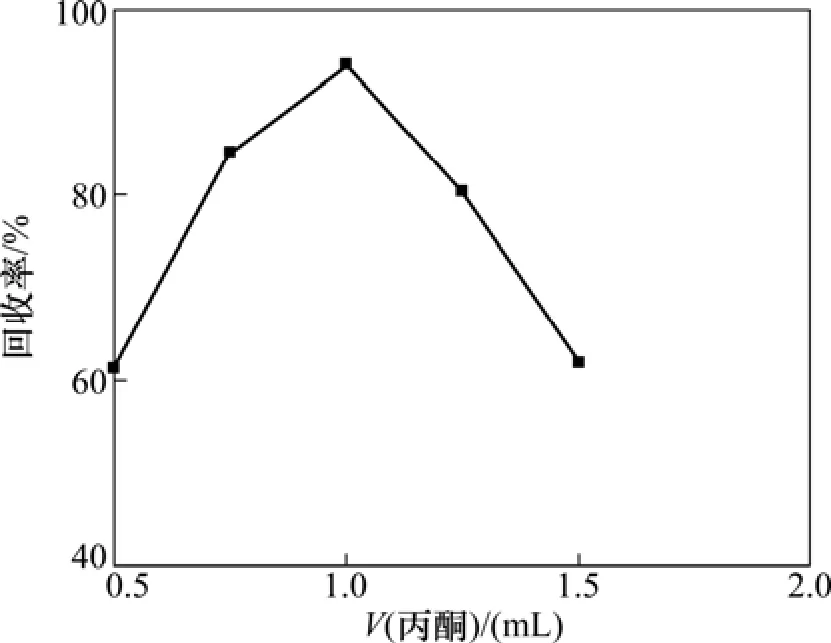
图3 分散剂体积对BDE-15萃取回收率的影响Fig.3 Effect of disperser solvent volume on extraction recovery
2.1.4 萃取时间的影响
在分散液相微萃取中,萃取时间是指萃取剂和分散剂注入水溶液之后和混合液离心前之间的时间。在萃取实验中,萃取时间影响两相之间的平衡。本实验考察了不同萃取时间(5,10,20,30和40 min)对萃取效率的影响,如图4所示。由图4可见:萃取时间对萃取回收率影响较小。说明该方法中萃取剂形成的微小液滴与水相的接触面积大,达到平衡需要的时间短,目标物可以很快地由水相转移到有机相。故选取萃取时间为5 min即可。

图4 萃取时间对BDE-15萃取回收率的影响Fig.4 Effect of extraction time on extraction recovery
2.1.5 离子强度
水溶液中无机盐质量分数对目标物的萃取效率有一定影响。本实验在最佳条件下(30 µL四氯乙烷为萃取剂,1 mL丙酮为分散剂,萃取5 min),通过在水相中加入不同含量的盐类(NaCl,质量分数为0~5%)以考察离子强度对萃取效率的影响。图5所示为萃取回收率和富集因子随NaCl质量分数变化图。由图5可知:盐质量分数对萃取效率无明显影响,但实验结果表明随 NaCl质量分数增大,富集因子减小,这可能是由于 NaCl的存在会导致萃取剂在水中的溶解度减小,从而使得沉积相体积增大,故富集因子减小。因此,本实验不需要加盐。
2.2 方法的线性范围、检出限、精密度以及富集因子
配制一系列不同质量浓度的BDE-15标准溶液,在最佳实验条件下对加标溶液进行萃取,气相色谱法测定,BDE-15的标准色谱图见图6。BDE-15的工作曲线如图7所示。由图7可知:BDE-15在0.1~50 μg/L范围内线性关系良好,相关性系数可达到0.998 3。根据信噪比为3计算得BDE-15的检出限为15.2 ng/L。将加标水平为1 μg/L的样品平行测定3次,其相对标准偏差(RSD)为8.6 %。该方法对BDE-15的富集因子可达到166.3。
2.3 实际水样分析
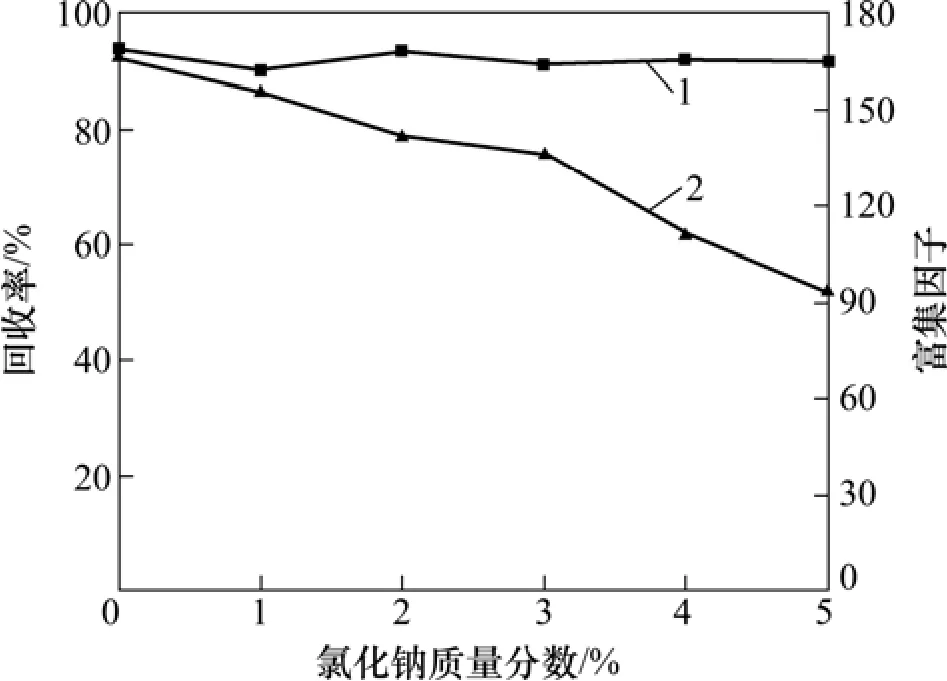
图5 离子强度对BDE-15萃取回收率和富集因子的影响Fig.5 Effect of ionic strength on extraction recovery and concentration factor
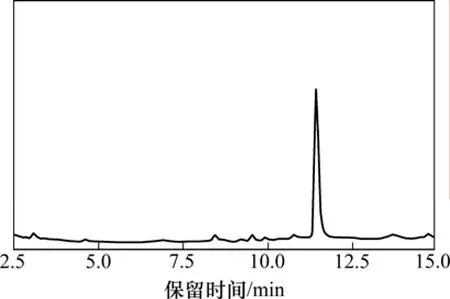
图6 BDE-15标准色谱图Fig.6 Typical chromatogram of BDE-15
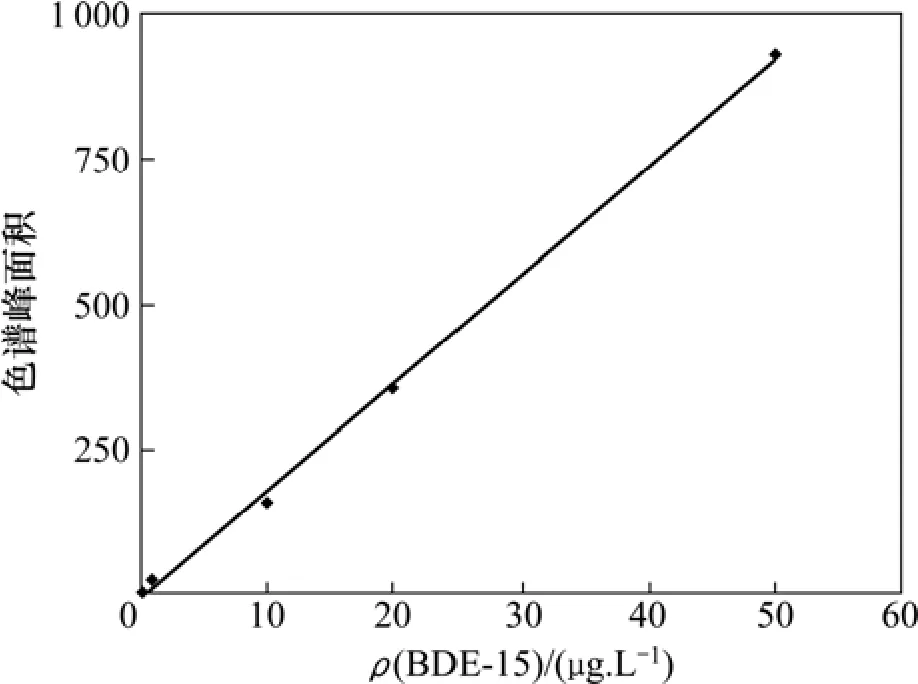
图7 BDE-15工作标准曲线Fig.7 Standard curve of BDE-15
生活污水取自江苏省镇江市市区窨井,海水取自上海崇明岛入海口水,水样过孔径为0.45 µm的滤膜后待用。在最佳萃取条件下,按分散液相微萃取步骤对水样进行萃取与测定,结果表明2种实际水样中均含有BDE-15,见表1。将2种水样各取3份平行加标(2 μg/L)进行萃取和测定,生活污水和海水中BDE-15的平均回收率分别为 93.5%和 92.5%,相对标准偏差(RSD)分别为 9.3%和 7.9%,能够满足水样中 PBDEs的测定。
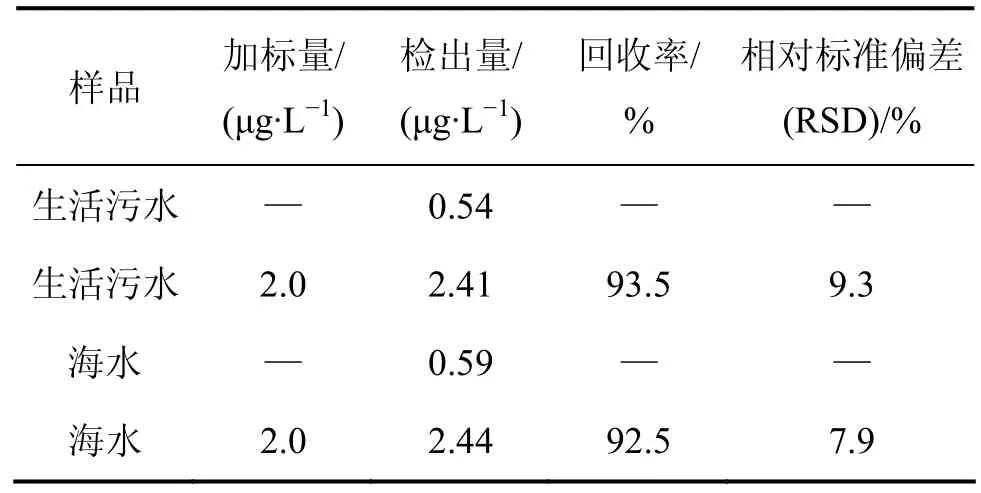
表1 实际样品分析结果Table 1 Results of real sample analysis

图8 生活污水萃取后的色谱图Fig.8 Chromatograms of extracted BDE-15 by DLLME
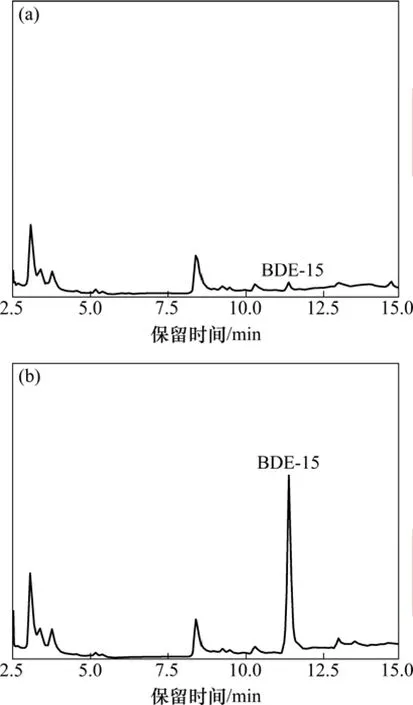
图9 海水萃取后的色谱图Fig.9 Chromatograms of extracted BDE-15 by DLLME
3 结论
(1) 采用分散液相微萃取(DLLME)与气相色谱−电子捕获检测器(GC-ECD)联用技术分析测定水样中多溴联苯醚,并对影响萃取效率的因素进行优化,得到最佳萃取条件。将该方法用于实际水样分析,生活污水和海水中样品平均加标回收率分别为 93.5%和92.5%,可以用于环境样品中多溴联苯醚的分析。
(2) 该方法具有操作简单、有机溶剂用量少、萃取时间短,富集因子高等优点,适用于环境水样中多溴联苯醚的分析。
[1] Wit C A D. An overview of brominated flame retardants in the environment[J]. Chemosphere, 2002, 46(5): 583−624.
[2] 饶勇, 毕鸿亮, 孙翠香, 等. 超声波辅助萃取测定土壤中的多溴联苯醚[J]. 环境污染与防治, 2007, 29(9): 704−707.RAO Yong, BI Hong-liang, SUN Cui-xiang, et al. Ultrasound enhanced solvent extraction and GC-ECD for measurement of PBDEs in soil[J]. Environmental Pollution & Control, 2007,29(9): 704−707.
[3] Brunete C S, Miguel E, Tadeo J L. Determination of polybrominated diphenyl ethers in soil by ultrasonic assisted extraction and gas chromatography mass spectrometry[J].Talanta, 2006, 70(5): 1051−1056.
[4] 张向荣, 薛科社. 高效液相色谱法测定沉积物中的多溴联苯醚[J]. 光谱实验室, 2009, 26(4): 986−989.ZHANG Xiang-rong, XUE Ke-she. Determination of polybrominated diphenyl ethers (PBDEs) in sediment by HPLC[J]. Chinese Journal of Spectroscopy Laboratory, 2009,26(4): 986−989.
[5] Moon H B, Kannan K, Lee S J, et al. Polybrominated diphenyl ethers (PBDEs) in sediment and bivalves from Korean coastal waters[J]. Chemosphere, 2007, 66(2): 243−251.
[6] 刘芃岩, 高丽, 赵雅娴, 等. 分散液相微萃取气相色谱/气相色谱质谱法测定白洋淀水中多溴联苯醚[J]. 分析化学, 2010,38(4): 498−502.LIU Peng-yan, GAO Li, ZHAO Ya-xian, et al. Determination of polybrominated diphenyl ethers in Baiyang Lake by dispersive liquid-liquid microextraction and gas chromatography/gas chromatography-mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2010, 38(4): 498−502.
[7] Rezaee M, Assadi Y, Hosseini M R M, et al. Determination of organic compounds in water using dispersive liquid-liquid microextraction[J]. Journal of Chromatography A, 2006,1116(1/2): 1−9.
[8] 杨运云, 李德良, 牟德海. 大流量采样-GC-NCI-MS测定环境空气中的多溴联苯醚[J]. 分析实验室, 2009, 28(2): 61−64.YANG Yun-yun, LI De-liang, MU De-hai. Determination of polybrominated diphenyl ethers in ambient air by high volume sampleing followed with gas chromatography-negative chemical ionization mass spectrometry[J]. Chinese Journal of Analysis Laboratory, 2009, 28(2): 61−64.
[9] Mariani G, Canuti E, Jiménez J C, et al. Atmospheric input of POPs into Lake Maggiore (Northern Italy): PBDE concentrations and profile in air, precipitation, settling material and sediments[J]. Chemosphere, 2008, 73(S1): S114−S121.
[10] 刘晓华, 高子燊, 于红霞. GC/MS法测定生物样品中多溴联苯醚类化合物[J]. 环境科学, 2007, 28(7): 1595−1599.LIU Xiao-hua, GAO Zi-shen, YU Hong-xia. Determination of polybrominated diphenyl ethers(PBDEs) in biota using GC/MS method[J]. Environmental Science, 2007, 28(7): 1595−1599.
[11] YU Mei, LUO Xiao-jun, WU Jiang-ping, et al. Bioaccumulation and trophic transfer of polybrominated diphenyl ethers (PBDEs)in biota from the Pearl River Estuary, South China[J].Environment International, 2009, 35(7): 1090−1095.
[12] 屈伟月, 毕新慧, 盛国英, 等. 色谱−负离子化学源−质谱联用仪测定人体血液中多溴联苯醚[J]. 分析化学, 2007, 35(7):1015−1017.QU Wei-yue, BI Xin-hui, SHENG Guo-ying, et al.Determination of polybrominated diphenyl ethers in human blood by gas chromatography-negative chemical ionization-mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2007,35(7): 1015−1017.
[13] Schecter A, Colacino J, Sjödin A, et al. Partitioning of polybrominated diphenyl ethers (PBDEs) in serum and milk from the same mothers[J]. Chemosphere, 2010, 78(10):1279−1284.
[14] Thomsen C, Stigum H, Frøshaug M, et al. Determinants of brominated flame retardants in breast milk from a large scale Norwegian study[J]. Environment International, 2010, 36(1):68−74.
[15] BI Xin-hui, QU Wei-yue, SHENG Guo-ying, et al.Polybrominated diphenyl ethers in South China maternal and fetal blood and breast milk[J]. Environmental Pollution, 2006,144(3): 1024−1030.
[16] Porcel J L, Sánchez G M, Álvarez B, et al. Analysis of nine polybrominated diphenyl ethers in water samples by means of stir bar sorptive extraction−thermal desorption−gas chromatography−mass spectrometry[J]. Analytica Chimica Acta,2006, 569(1/2): 113−118.
[17] ZHANG Zu-lin, Rhind S M. Optimized determination of polybrominated diphenyl ethers and polychlorinated biphenyls in sheep serum by solid-phase extraction-gas chromatography-mass spectrometry[J]. Talanta, 2011, 84(2): 487−493.
[18] Prado L S, Barreiro C G, Lores M, et al. Photochemical studies of a polybrominated diphenyl ethers (PBDEs) technical mixture by solid phase microextraction (SPME)[J]. Chemosphere, 2005,60(7): 922−928.
[19] Prado L S, Lores M, Llompart M, et al. Natural sunlight and sun simulator photolysis studies of tetra- to hexa-brominated diphenyl ethers in water using solid-phase microextraction[J].Journal of Chromatography A, 2006, 1124(1/2): 157−166.
[20] McKinney M A, Guise S D, Martineau D, et al.Biotransformation of polybrominated diphenyl ethers and polychlorinated biphenyls in beluga whale (Delphinapterus leucas) and rat mammalian model using an in vitro hepatic microsomal assay[J]. Aquatic Toxicology, 2006, 77(1): 87−97.
[21] XIA Chong-huan, Lam J C W, WU Xiao-guo, et al. Levels and distribution of polybrominated diphenyl ethers (PBDEs) in marine fishes from Chinese coastal waters[J]. Chemosphere,2011, 82(1): 18−24.
[22] SUN Su-ju, ZHAO Jian-hong, LENG Jun-hong, et al. Levels of dioxins and polybrominated diphenyl ethers in human milk from three regions of northern China and potential dietary risk factors[J]. Chemosphere, 2010, 80(10): 1151−1159.
