Ag对Pd/CeO2-ZrO2-La2O3-Al2O3催化氧化甲醇性能的影响
2012-09-15张雪乔王世丹信欣刘盛余陈耀强
张雪乔王世丹信 欣刘盛余陈耀强*,赵 明*,
(1四川大学化学学院,成都 610064)
(2成都信息工程学院资源环境学院,成都 610025)
Ag对Pd/CeO2-ZrO2-La2O3-Al2O3催化氧化甲醇性能的影响
张雪乔1,2王世丹1信 欣2刘盛余2陈耀强*,1赵 明*,1
(1四川大学化学学院,成都 610064)
(2成都信息工程学院资源环境学院,成都 610025)
采用等体积共浸渍法制备了一系列Pd-Ag/CeO2-ZrO2-La2O3-Al2O3催化剂。运用N2吸附-脱附,X射线衍射(XRD),H2程序升温还原(H2-TPR),紫外-可见漫反射光谱(UV-Vis DRS),X射线光电子能谱 (XPS)对催化剂进行表征,并考察其对甲醇的催化氧化性能。活性测试结果表明,Ag的添加可显著改善Pd催化剂对甲醇的催化氧化活性,T50、T90以及ΔT分别为125℃,150℃和25℃,具有较好的应用前景。H2-TPR表明,引入Ag可明显改善催化剂的还原性能,使表面易还原氧物种量增多,还原速率加快;UV-Vis DRS及XPS表明,Pd、Ag金属之间以及金属与载体之间存在电子效应,这种效应促使金属与载体界面产生大量具有活性的氧物种,不仅提高了催化剂的低温活性,还提高了催化剂的氧化速率。
银;钯;铈;催化氧化;甲醇
甲醇具有辛烷值高、汽化潜热大等优点,作为车用汽油代用燃料可明显降低尾气中HC、CO、NOX以及颗粒物的排放量[1-3],因此,在美国、日本、德国等发达工业国家已广泛使用[4]。然而,甲醇燃料在燃烧过程中,尾气中除含有常规污染物还含有未完全燃烧的甲醇以及部分氧化产物,如不经严格净化直接进入大气,必将造成环境二次污染。
催化净化是减少汽车尾气污染的一种有效手段。美国通用和福特汽车公司的Yung、Plummer等从上世纪八十年代初即开始了甲醇催化氧化方面的研究,并已获得多项有关催化剂研究方面的专利[5-6]。国内,以贵金属Pd为活性组分的研究较多,朱兵等[7]考察了550℃空气中焙烧的Pd/γ-Al2O3对甲醇的催化氧化性能,取得了较好的催化结果,T50、T95可达180℃、275℃,但深度氧化性能不佳;由于Ag对甲醇具有较好的深度氧化性能,故朱兵等[8]又研究了Pd-Ag/γ-Al2O3双金属催化剂对甲醇的催化氧化性能,发现Pd、Ag双金属催化剂性能优于单金属催化剂,T50和T90分别为125℃和170℃,且在一定程度上可抑制“CO的阻抑”,但之前研究的催化剂载体多为γ-Al2O3[9],因Ag易聚集而导致活性下降成为实际应用中的困难;此外,甲醇汽油车尾气空速较高,一般为 3×104~1×105h-1,因此,开发具有一定稳定性且在高空速下能够迅速转化甲醇的低温深度氧化型催化剂显得十分重要。
众所周知,CeO2-ZrO2具有较好的氧化还原特性且在一定程度上可促进贵金属的分散进而改善催化剂低温催化氧化性能等特点,故被广泛应用于三效催化剂[10-11],然而应用于甲醇催化氧化方面的研究较少。刘涛等[12]通过实验表明,Ce可促进Ag在γ-Al2O3载体上的分散,La能够降低甲醇的起燃温度,而La和Ce共同作用能够提高甲醇转化为CO2的选择性;王幸宜等[13]认为,La除对金属催化剂具有调变作用外,还可以大大降低含氧中间物的生成,即提高甲醇的深度氧化性能;因此,根据本实验室前期的研究 结 果[14-15],结合参考文献[13],选 择 Ce0.225Zr0.225La0.05Al0.5O1.725(CZLA)为载体,Pd、Ag为活性组分,在空速为3×104h-1的反应条件下考察了一系列不同比例的Pd-Ag催化剂对甲醇的催化氧化性能的影响,并结合 BET、XRD、TPR、UV-Vis、XPS 等表征,重点讨论了Pd-Ag双金属体系的协同作用以及影响催化活性的主要原因,得到了有意义的结果。
1 实验部分
1.1 催化剂制备
按一定的化学计量比将ZrO(CO3)2(CP)溶解在浓硝酸(AR)中,再分别加入到溶解于一定去离子水的Ce(NO3)3·6H2O(CP),La(NO3)3(CP)和 Al(NO3)3·9H2O 溶液中,混合均匀后用氨水溶液作为沉淀剂沉淀,pH值控制在8.5左右,滴定完成后经抽滤,干燥,所得粉体于 600 ℃焙烧 3 h 得催化剂载体 (nCe∶nZr∶nLa∶nAl=4.5∶4.5∶1∶10)。称取一定质量上述载体采用等体积共浸渍法浸渍于按一定比例配制的Pd(NO3)2与AgNO3的水溶液(Pd0.01-x-Agx,x=0.000 0、0.002 5、0.005 0、0.007 5、0.010 0)中,在 105 ℃烘箱中烘干,于550℃焙烧3 h,得催化剂粉体;然后将得到的粉体研磨制成浆液(固含量约40%~60%),涂覆于堇青石蜂窝陶瓷基体 (美国 Corning公司,93 hole·cm-2)小样(1.5 cm3)上,涂覆量为 140 g·L-1(L 代表陶瓷基体体积),再经105℃烘箱中烘干、于550℃焙烧3 h,制得的催化剂分别记为 Cat-1、Cat-2、Cat-3、Cat-4、Cat-5,催化剂中贵金属含量为 1.06%~1.07%。
1.2 催化剂表征
实验中所有表征均采用催化剂粉末样品。比表面积和孔结构测定在SSA-4200型孔隙比表面分析仪(Builder公司,北京)上进行,样品先于350℃下抽真空处理1 h,以高纯N2为吸附质,在-196℃下进行测定。H2-TPR在TP-5080全自动多用吸附仪(先权公司,天津)上进行,样品在 N2气(20 mL·min-1)吹扫下升温至400℃并保持40 min,降至室温后转为还原气 (体积分数为 5%H2+95%N2,30 mL·min-1),以10℃·min-1升温至800℃,TCD检测。XRD分析在日本理学 DX-2500型X射线衍射(XRD)仪上进行,激发光源为Cu Kα 射线(λ=0.154 18 nm),管电压 40 kV,管电流 25 mA,石墨孪晶单色器,正比计数器,扫描范围 2θ=20°~80°。DRS-UV-Vis在日本岛津公司UV-2550紫外分光光度计进行分析,扫描范围200~800 nm。XPS分析(催化剂无预处理)在 XSAM 800型电子能谱测试仪上进行,以Mg Kα作为X射线激发源,电压和电流分别为13 kV和12 mA;电子能结合数值用C(284.8 eV)校准。
1.3 催化剂活性评价
活性测试在实验室组装的多路固定床连续流动微型反应器中进行:催化剂直接装入反应器,程序升温进行活性测试,各路气体分别用质量流量计计量进入混合器。混合气体积组成为:0.02%~0.03%CH3OH、2.0%O2、N2为平衡气,气体的体积空速为30 000 h-1。有机气体组分由气相色谱仪(GD-2000,上海分析仪器厂)在线分析,Porapak-Q填充柱,FID检测。
2 结果与讨论
2.1 催化剂活性测试
Pd-Ag催化剂上甲醇转化率随温度变化的曲线如图1所示。用起燃温度T50(转化率达50%时对应的反应温度),完全转化温度T90(转化率达90%时对应的反应温度)以及ΔT(ΔT=T90-T50)作为催化剂活性的评价参数。T50、T90越低则催化剂反应活性越好,ΔT越小则反应速率随温度增加越快,活性的温度特性越好。T50、T90和ΔT列于表1。表1可见,单Pd催化剂Cat-1的T50和 T90分别为140℃和220℃,单Ag催化剂Cat-5的 T50和T90分别为242℃和275℃,即在单Pd催化剂达到完全转化(220℃)后单Ag催化剂还未达到起燃,单Pd催化剂的活性明显高于单Ag催化剂。对于Pd-Ag双金属催化剂而言,Cat-2、Cat-3和Cat-4的T50和 T90明显低于单 Ag催化剂 Cat-5的 T50和 T90,且 Cat-2、Cat-3的 T50(133 ℃和125℃),T90(170℃和125℃)较单Pd催化剂Cat-1的 T50(140 ℃),T90(220℃)低,可见 Pd-Ag双金属催化剂的活性优于单Ag催化剂,且当Ag添加量一定时,双金属催化剂的性能优于单Pd催化剂,文献[9]认为,Pd、Ag之间存在一定的几何效应和电子效应,这两种效应可明显改善催化剂上甲醇的催化氧化性能。表1还观察到,随Ag添加量的增加,Cat-4的T50(165℃)和T90(210℃)逐渐升高,即当Ag添加量超过一定值时,Cat-4的催化活性下降,原因可能是随着催化剂Ag含量的增加,Pd含量的减少,活性逐渐向Ag的活性靠近,同时,过量的Ag粒子将活性较高的Pd粒子覆盖,此结论与文献[16]结论一致。本实验制备的单金属催化剂Cat-1的T50(140℃)、T90(220 ℃)以及 ΔT(80 ℃)远低于文献[7]报道的T50(180 ℃)、T90(275 ℃)以及 ΔT(95 ℃),且 Pd-Ag双金属催化剂的ΔT均小于文献[9]报道,说明铈基材料的添加不但可明显降低单金属催化剂的起燃温度以及完全转化温度,而且还可有效提高催化反应的速率,使甲醇起燃后在较窄的温度范围内即可实现大部分的转化,这对甲醇燃料车尾气中未燃甲醇净化具有重要的意义,与文献[17]结论一致。实验中未检测到甲醛、甲酸甲酯等副产物生成,表明本实验制备的Pd-Ag/CZLA系列催化剂在高空速下具有较好的深度氧化性能,因而具有良好的应用前景。
综合以上分析,该系列催化剂活性顺序依次为:Cat-3>Cat-2>Cat-1>Cat-4>Cat-5。
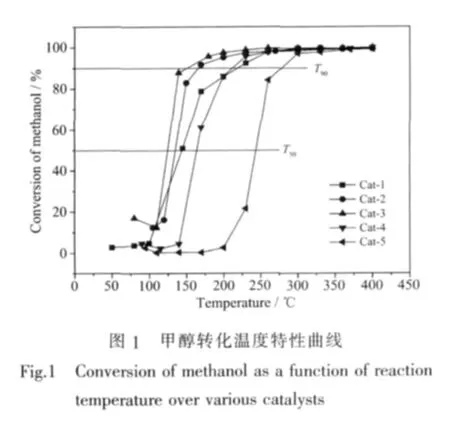
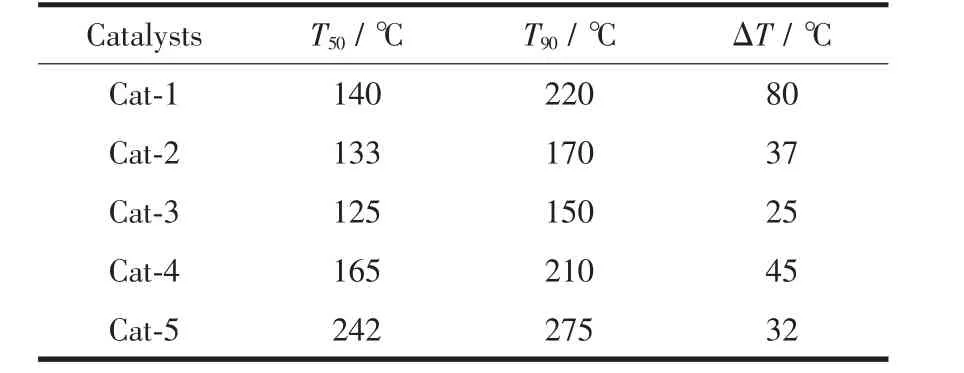
表1 催化剂上甲醇转化的T50、T90和ΔTTable 1 Light-off temperature(T50),complete conversion temperature(T90)and ΔT(T90-T50)of methanol over Pd-Ag catalysts
2.2 BET分析
为研究催化活性的影响因素,对该系列催化剂进行了织构性能测试,结果见表 2。SBET、VS、Rmean分别表示催化剂的比表面积、孔容和平均孔半径。
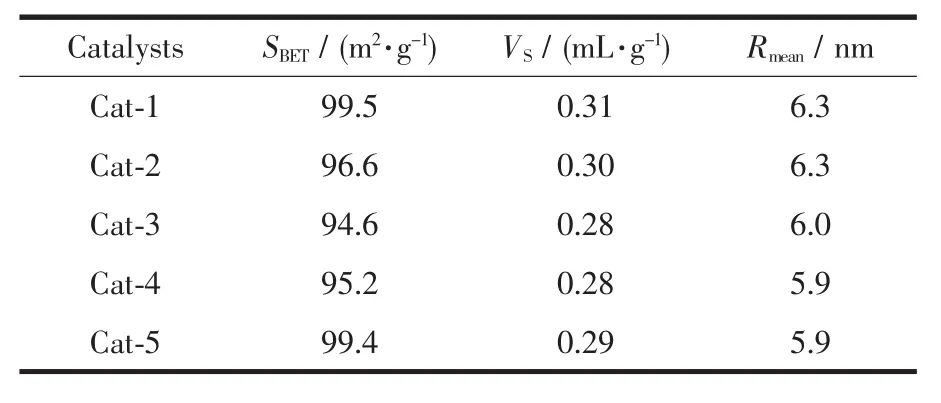
表2 催化剂的织构性能Table 2 Textural properties of catalyst samples
表2可见,5个催化剂样品的比表面积变化不大,均介于 99.5~94.6 m2·g-1之间;Cat-1 的孔容为0.31 mL·g-1,大于 Cat-5 的孔容 0.29 mL·g-1;双金属催化剂的孔容随Ag添加量的增加而减小,可能是由于在共浸渍过程中,浸渍金属将部分孔道堵塞[18],孔容递变规律为:Cat-1>Cat-2>Cat-5>Cat-3=Cat-4;平均孔径变化不明显,基本保持在5.9~6.3 nm之间,但平均孔径均较大,对高空速下的催化反应有利,已为活性测定结果所证实。一般认为较大的比表面积、孔容和平均孔径有利于反应分子的吸脱附,加快反应速率。
2.3 XRD分析
图2为Pd-Ag系列催化剂样品的XRD谱图。
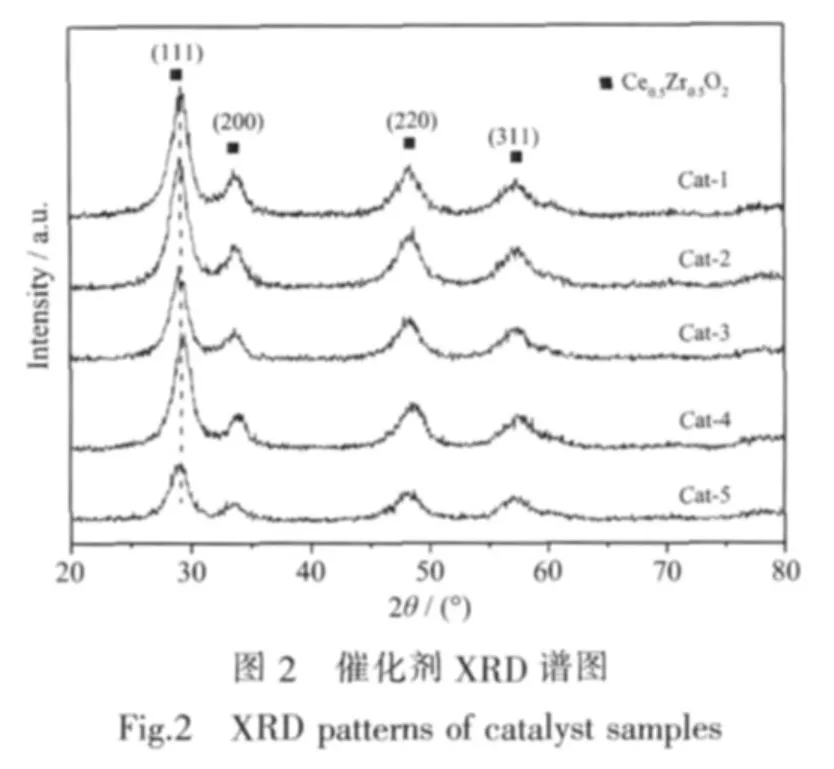
图2可见,各催化剂样品的峰形大体一致,均在 2θ为 28.94°、33.56°、48.38°、57.44°附近出现 4 个强衍射峰,分别对应于立方萤石结构 Ce0.5Zr0.5O2的(111)、(200)、(220)、(311)晶面;谱图中未观察到 Al2O3的衍射峰,由于 Al3+(0.054 nm)和 Ce4+(0.097 nm)的半径之差 Δr=79.6%(>41%),满足形成间隙固溶体的条件,因此,Al2O3可能插入到 CeO2-ZrO2的晶格间隙,形成间隙固溶体或者高度分散于固溶体表面[19];同样未检测到La2O3衍射峰,可能是由于La3+(0.106 nm)和 Ce4+的半径之差 Δr=8.5%(<41%),因此,La2O3可能以置换CeO2的形式进入CeO2-ZrO2晶格,或是高度分散于固溶体表面;此外谱图中未检测到Pd以及Ag物种的衍射峰,表明负载组分已高度分散于载体表面或是负载量较小无法检测。结合活性测试结果认为,较高的催化活性可能与均一的固溶体结构以及高度分散于载体表面的活性组分有关。
2.4 TPR分析
图3为Pd-Ag系列催化剂样品的H2-TPR谱图。由图可见,单金属催化剂Cat-1在200℃以下出现两个较为明显的还原峰,分别标记为α、α′,其中α可归属为高度分散于载体表面的PdO物种的还原或是载体表面Pd物种吸附氧的还原,而α′则为与载体相互作用比较稳定的PdO物种的还原[20-22]。图中Cat-5的还原峰形较其它几个样品峰形宽且峰强度小,这是由于随着温度的升高,银氧化物逐渐分解产生的氧消耗氢所致[23];Cat-5在200℃、257℃出现的两个还原峰(标记为 β、β′),根据文献[24]可知,分别对应于高度分散于载体表面的Ag2O以及以晶态存在的Ag2O的还原。

对于双金属催化剂Cat-2、Cat-3、Cat-4,随着Ag含量的增加,PdO的还原峰α、α′向高温方向移动且峰形逐渐宽化,β、β′消失,表明Ag的添加,使得Pd氧化物种的还原滞后,但却促进了Ag2O的还原,该结论与文献[25]结论一致;Ag2O还原性能的改善与Pd的氢溢流有关[26]。值得注意的是,双金属催化剂的还原峰面积与峰强度随Ag含量增加呈先增加后减小的变化趋势,其中Cat-3的还原峰面积与峰强度最大。通常认为还原峰面积越大,易还原氧物种量越多,峰强度高,还原速率越快,Cat-3还原性能的改善可能是由于Ag的添加削弱了部分Pd-O键的强度,促进了氧从Pd表面脱附进入气相[16],该结论与文献[27]结论一致。结合活性测试结果,Cat-3具有最佳的温度特性,可能与其具有最大的易还原氧量以及最快的还原速率有关。同时图中还观察到,除Cat-2、Cat-3峰位无明显偏移外,Cat-4的还原峰α明显弱化,这与催化剂中的Pd含量减少相关,α′更为突出,即催化剂Cat-4表面以与载体相互作用的较为稳定的PdO物种为主,可见过量Ag的引入,可使PdO与载体作用增强,趋向于稳定,这对Pd表面活性位的恢复以及甲醇的继续吸附不利,与活性测试结果吻合。
本文制备催化剂的还原性能顺序依次为Cat-3>Cat-2>Cat-1>Cat-4>Cat-5,与活性测试规律一致,表明还原性能是影响催化活性的重要原因之一,还原性能越好,催化活性也越好[28]。
2.5 UV-Vis DRS分析
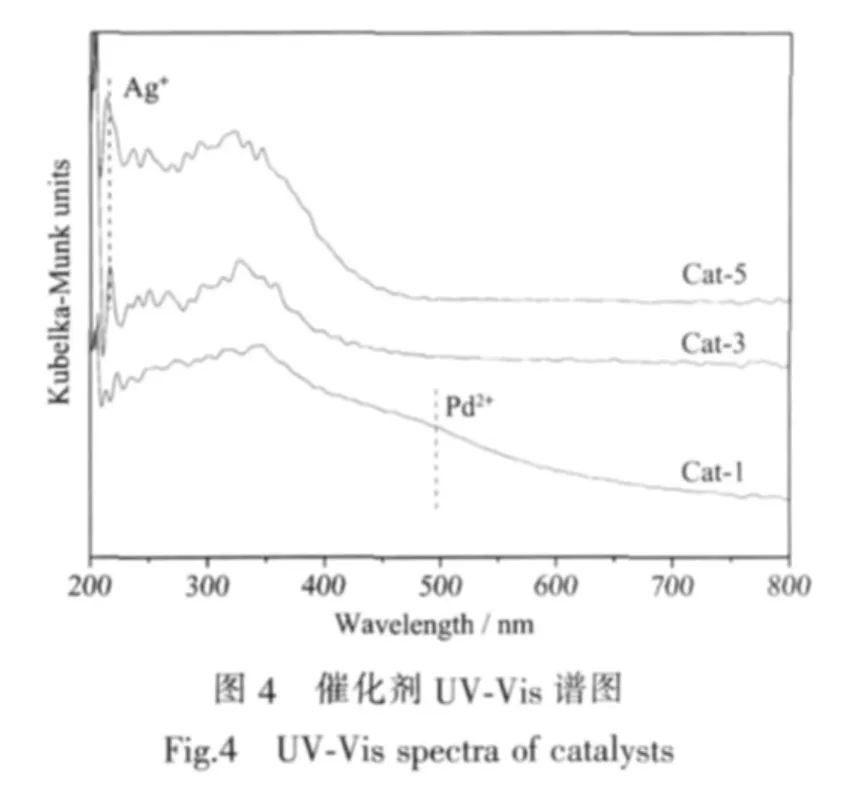
为进一步说明Pd、Ag之间的相互作用,分别对Cat-1、Cat-3、Cat-5进行紫外可见漫反射分析。谱图见图4。
图4可见,Cat-5在214 nm处出现的吸收峰为高度分散于载体表面的Ag+外层电子由4d10向4d95s1的转移[29],Cat-1在440 nm处出现的强度低的吸收带可归属于邻近的Pd-O基团间相互作用的Pd2+[30],3个催化剂在320 nm左右存在的吸收带可认为是Ce与氧配位体之间的电荷转移[31];文献[29]报道单质Ag的吸收峰位于284 nm,本文UV-Vis并未检测出,可能是由于Ag与载体间存在相互作用,使得Ag主要以离子形式存在;当Pd和Ag同时存在时,位于214 nm处吸收峰增强,440 nm处的吸收峰弱化,而320 nm处的吸收带略有增强,表明Pd、Ag之间存在一定相互作用,且这种作用使得催化剂表面Pd2+减少,Ag+增加,同时促进了活性组分与载体间的相互作用,进而改善Ce与氧配位体之间的电荷效应。根据活性测试规律推断,双金属催化剂Pd-Ag活性的改善可能与Pd、Ag金属的存在形态以及金属与载体间作用有关。
2.6 XPS分析
分别对 Cat-1、Cat-3、Cat-5 进行 XPS 测试,Pd3d和Ag3d谱图分别见图5(A),(B),Pd3d、Ag3d和Ce3d结合能值见表3。
由图5(A)和表3可知,Cat-1的Pd3d5/2结合能为 336.3 eV,而 Cat-3 结合能为 335.6 eV,较 Cat-1降低了0.7 eV。由于Ag和Pd的电负性大小分别为1.93和 2.2,表明 Pd的吸电子能力强,当在 Pd中添加Ag,Ag周围的电子会向Pd偏移,从而增加了Pd周围的电子密度,屏蔽作用增强,内层电子的结合能减少。由于两催化剂中Pd3d5/2的结合能均介于335.0 eV(Pd0)与 336.5 eV(Pd2+)之间,可知 Cat-1 及Cat-3中的 Pd主要以 Pdδ+(0<δ<2)形式存在。采用XPS 分峰软件,根据 Pd0、Pd2+的标准结合能[32-33],对Pd3d5/2拟合,得到 Pd3d5/2a(Pd0)和 Pd3d5/2b(Pd2+),积分计算得Pd0、Pd2+含量比,列于表3。表3可见,Cat-1中 Pd0/Pd2+为 45.59/54.41,而 Cat-3的Pd0/Pd2+为54.91/45.09,可见,添加 Ag 后,Pd 的主要存在状态发生变化,由氧化态向还原态过渡。
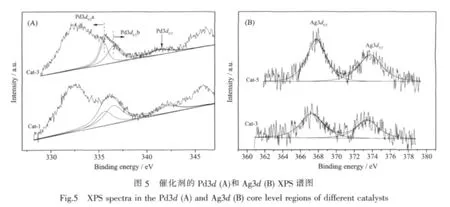

表3 Pd3d、Ag3d结合能值Table 3 Binding energy data of Pd3d and Ag3d from XPS analysis
同样表3可见,Cat-5的Ag3d5/2结合能为367.7 eV,介于 368.0 eV(Ag0)367.5 eV(Ag+)[34]之间,因此可归属为 Ag+δ(0<δ<1) 物种; 添加 Pd 后,Cat-3 中的Ag3d5/2结合能降低为367.2 eV,较Cat-5向氧化态位移 0.5 eV,根据文献[34]可知,对应于 Ag1+δ(0<δ<1)物种,通常认为Ag2O在400℃以上焙烧会分解为Ag和O2,然而本文制备的催化剂均在600℃焙烧,焙烧后的催化剂中的Ag处于氧化态,可见Ag与载体之间存在较强的相互作用,使得载体表面的氧物种易迁移至Ag表面,从而使其处于氧化态,由于Pd、Ag之间的相互作用,进一步促进了这部分氧物种的迁移,这与TPR、UV-Vis结论一致。文献[17]认为,CeO2-ZrO2的引入可在金属与载体界面产生较多的活性氧,且这种活性氧可在较低的温度下释放出来并参与甲醇的催化氧化;Yamazaki等[35]也认为相对于Ag-Al2O3来说,Ag-CeO2催化剂可通过 Ag/CeO2界面的氧迁移产生大量的活性氧,因此推断,Pd-Ag双金属催化剂具有较好的低温活性可能与这部分金属-载体界面间因氧迁移而产生的具有活性的氧物种有关。此外,Cat-3中Ag向氧化态过渡,Pd向还原态过渡,表明Pd、Ag之间存在电子效应,这种电子效应改变了Pd、Ag周围的化学环境,结合活性测试结果可知,新的化学环境的形成更有利于甲醇的催化氧化,Wang[9]、McCabe 和 Mitchell[36-37]通过实验证明,Pd、Ag之间存在电子效应,这种效应有利于催化氧化反应的顺利进行,与本文结论一致。
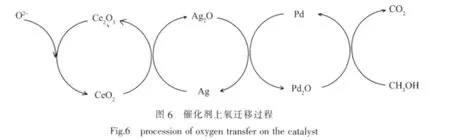
表3 中,Cat-1的Ce3d5/2结合能为 882.2 eV,Cat-3的结合能为 882.6 eV,较 Cat-1 升高了 0.4 eV,即Ag的引入改变了金属Pd与载体中CeO2作用,由于Pd与CeO2存在强相互作用,从Pd到Ce可发生电子转移[38-39],故引入Ag可通过改变Pd-Ce电子作用进而改变Ce周围的化学环境。因Ce4+和Ce3+之间存在相互转化,使催化剂具有储释氧的能力,且当CeO2中掺杂其它离子,可产生氧空位,将气相氧活化为具有活性的表面吸附氧;那么可以推断,未添加Ag时,Pd-O直接供出氧给CH3OH,之后自身变为Pd0,临近载体CeO2中的表面吸附氧转移至Pd0,使Pd0恢复成Pd-O,构成氧化还原循环,Imamura等认为由于CeO2具有氧储释能力,可将活性氧提供给MnOx,使MnOx氧化态升高[40],也有类似的报道[41];添加Ag后,由于Ag和氧的结合能力较弱,很容易脱出,而Pd正好相反,与氧结合较强,不易脱出,但很容易氧化,因此Ag-O很容易将氧提供给Pd,使Pd价态升高,对于Pd-Ag双金属催化剂,氧化还原循环过程变化为:Pd-O供氧给CH3OH后被还原为Pd0,这时Ag-O将氧转移给Pd0,使恢复为Pd-O,而自身变为Ag0,随后载体表面的活性吸附氧使Ag0又恢复成Ag-O,即Ag通过促进载体表面的活性吸附氧在金属与载体间的流动,从而加快催化反应的速率,这种促进作用可用以下过程描述,如图6所示。
综合以上分析可知,Ag的引入一方面改变了Pd、Ag以及金属与载体间的电子效应,从而形成了更有利于甲醇催化氧化的化学环境;另一方面促进了活性氧物种在金属与载体间的流动,这可能是加快催化反应速率的主要原因。
3 结 论
采用等体积共浸渍法制备的Pd-Ag系列催化剂对甲醇具有较好的低温深度催化氧化性能,当Ag为 0.005 0 时,催化氧化性能最佳,T50、T90以及ΔT分别为125℃,150℃和25℃。通过BET、XRD、H2-TPR、UV-Vis DRS和XPS等分析手段对催化剂的织构性能、物相结构、还原性能和电子性能进行了分析。其中H2-TPR证明,Ag的添加可使催化剂上易还原氧物种量增多,还原速率加快,还原性明显改善。UV-Vis DRS和XPS表明Ag的存在不但可以改变Pd、Ag之间以及Pd、Ag与载体间的电子效应,而且还可加速表面活性氧物种在金属与载体界面间的流动,促使反应速率明显加快。
[1]Aboul Fotouh S M K,Aboul Gheit N A K,Hassan M M I.Chin.J.Catal.,2011,32:412-420
[2]Hsieh A.Atmos.Environment,2002,36:403-410
[3]Stump F,Knapp K,Ray W,et al.J.Air Waste Manage.Assoc.,1996,46:1149-1161
[4]Pullman J B.SAE Patent,800260.1980-06-11.
[5]Yung F,Yu Y.Ind.Eng.Chem.Process Des.Dev.,1984,23:60-67
[6]Plummer H K.Appl.Catal.,1987,29:261-270
[7]ZHU Bing(朱 兵),WANG Ren(汪 仁).J.Fuel Chem.Tech.(Ranliao Huaxue Xuebao),1997,25:533-538
[8]ZHU Bing(朱兵),WANG Ren(汪仁).Chin.J.Catal.(Cuihua Xuebao),1997,18:468-472
[9]Wang J A,Aguilar-Ríos G.,Wang R.Appl.Surf.Sci.,1999,147:44-51
[10]Kanazawa T.Catal.Today,2004,96:171-177
[11]Morikawa A,Suzuki T,Kanazawa T,et al.Appl.Catal.B,2008,78:210-215
[12]LIU Tao(刘 涛),FENG Liu(冯 流),LI Gang(李 钢),et al.Nonferr.Metals.(Youse Jinshu),2004,56(4):77-79
[13]WANG Xing-Yi(王幸宜),WAN Ying(万颖),LU Guan-Zhong(卢冠忠).J.Rare Earths.(Xitu Xuebao),2003,21(1):51-54
[14]Wei Z L,Li H M,Zhang X Y,et al.J.Alloys Compd.,2008,455(1-2):322-327
[15]LI Hong-Mei(李红梅),ZHU Qing-Chao(祝清超),LI Yi-Le(李移乐),et al.J.Rare Earths(Xitu Xuebao),2010,28(1):79-83
[16]ZHOU Li-Ping(周丽萍).Ind.Catal.(Gongye Cuihua),2004,12:42-47
[17]Luo Y J,Xiao Y H,Cai G H,et al.Fuel,2011,93:533-538
[18]Fan J,Weng D,Wu X D.J.Catal.,2008,258:177-186
[19]LI Hong-Mei(李红梅),ZHOU Ju-Fa(周菊发),ZHU Qing-Chao(祝清超),et al.Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),2009,30:2484-2486
[20]CAI Li(蔡 黎),ZHAO Ming(赵 明),PI Zhan(皮 展),et al.Chin.J.Catal.(Cuihua Xuebao),2008,29:108-112
[21]Luo M F,Zheng X M.Appl.Catal.A,1999,15:189-195
[22]YUE Lei(岳雷),ZHAO Lei-Hong(赵雷洪),ZHANG Qing-Bao(张庆豹),et al.J.Rare Earths.(Xitu Xuebao),2009,27(5):733-740
[23]Teng J W,Cai T X,Bao X H.Chin.Chem.Lett.,1999,10:83
[24]Luo M F,Yuan X X,Zheng X M.Appl.Catal.,1998,175:121-129
[25]Emerson A S,Jose J,Mariod J M,et al.J.Catal.,2000,195:88-95
[26]Venezia A M,Liotta L F,Deganello G,et al.Appl.Catal.A,2001,211:167174
[27]Bongkot N,Nina B,Piyasan P,et al.Catal.Commun.,2004,5:243-248
[28]Su S C,Carstens J N,Bell A T.Catal.,1998,176:125-135
[29]Shimizu K,Satsuma A.J.Phys.Chem.,2006,8:2677-2682
[30]Rakai A,Tessier D,Bozon V F.Chem.Soc.Faraday Tran.,1992,88:741-747
[31]Liu L J,Yao Z J,Liu B,et al.Catal.,2010,275:45-60
[32]Pillo T,Zimmermann R,Steiner P,et al.J Phys.Condens.Matter.,1997,9:3987-3990
[33]Burn M,Berthet A,Bertolini C.J.Electron Spectrosc.Relat.Phenom,1999,104:55-60
[34]Onodera Y,Iwasaki T,Chatterjee A,et al.Appl.Clay Sci.,2001,18:123-130
[35]Yamazaki K,Kaya T,Dong F,et al.J.Catal.,2011,282:289-298
[36]McCab R W,Mitchell P.J.Appl.Catal.,1986,27:73-80
[37]McCab R W,Mitchell P.J.Catal.,1986,103:419-423
[38]TIAN Dong-Xu(田东旭),WANG Hao-Jin(王浩静),WANG Xin-Kui(王心葵).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2001,17:527-532
[39]Serre C,Garin F,Belo G.J.Catal.,1993,1:141-148
[40]Imamura S.Ind.Eng.Chem.Res.,1999,38:1743-1753
[41]Tang X F,Chen J L,Li Y G,et al.Chem.Eng.J.,2006,118:119-125
Effects of Ag on Performance of Methanol Oxidation over Pd/CeO2-ZrO2-La2O3-Al2O3
ZHANG Xue-Qiao1,2Wang Shi-Dan1Xin Xin2LIU Sheng-Yu2CHEN Yao-Qiang*,1ZHAO Ming*,1
(1College of Chemistry,Key Laboratory of Green Chemistry and Technology Ministry,Sichuan University,Chengdu 610064,China)
(2College of Resource and Environment,Chengdu University of Technology,Chengdu 610025,China)
Pd-Ag/CeO2-ZrO2-La2O3-Al2O3catalysts were prepared by the co-impregnation method.Low temperature nitrogen adsorption-desorption,X-ray diffraction (XRD),H2-temperature-programmed reduction (H2-TPR),Ultra violet-visble difuse reflectance spectroscopy (UV-Vis DRS)and X-ray photoelectron spectroscopy (XPS)were carried out.The catalytic activities of these catalysts for the oxidation of methanol were investigated.The results of catalytic activity indicate that the presence of Ag significantly improves catalytic performance for methanol oxidation.The T50,T90 and ΔT are 125℃,150℃ and 25℃,respectively.H2-TPR results suggest that the addition of Ag increases the amount of active oxygen and promotes the reductive ability.The UV-Vis DRS and XPS results indicate that electron effects between Pd and Ag,Pd-Ag and support are favorable for producing larger activated oxygen via easy migration on the Pd-Ag/CeO2interface,thus promoting both the catalytic activity at low temperature and the speed of catalytic oxidation.
silver;palladium;cerium;catalytic oxidation;methanol
O643.36+1;O643.31
A
1001-4861(2012)08-1563-07
2012-03-06。收修改稿日期:2012-04-10。
国家自然科学基金(No.21173153)和四川省科技厅支撑计划基金(No.2011GZ0035)资助项目。
*通讯联系人。E-mail:nic7501@scu.edu.cn,Tel:028-85418451;会员登记号:S06N4556M1006。
