CuO/Mn2O3/γ-Al2O3催化剂的制备、表征及其在CO氧化反应中的性能研究
2012-09-15越李珊珊汤常金姚小江齐蕾刘斌高飞董
戴 越李珊珊汤常金姚小江齐 蕾刘 斌高 飞董 林*,,2
(1南京大学介观化学教育部重点实验室,南京大学化学化工学院,南京 210093)
(2江苏省机动车尾气污染控制重点实验室,南京大学现代分析中心,南京 210093)
CuO/Mn2O3/γ-Al2O3催化剂的制备、表征及其在CO氧化反应中的性能研究
戴 越1李珊珊1汤常金1姚小江1齐 蕾1刘 斌1高 飞*,2董 林*,1,2
(1南京大学介观化学教育部重点实验室,南京大学化学化工学院,南京 210093)
(2江苏省机动车尾气污染控制重点实验室,南京大学现代分析中心,南京 210093)
采用浸渍法在γ-Al2O3载体上分步负载改性剂Mn2O3和活性组分CuO,制备了一系列不同配比的CuO/Mn2O3/γ-Al2O3催化剂,并运用CO+O2模型反应、XRF、XRD、H2-TPR、in-situ FTIR等手段表征了催化剂的活性和物理化学性质。活性测试结果表明,锰氧化物对γ-Al2O3载体的改性能有效地提高CuO/γ-Al2O3催化剂在CO+O2模型反应中的催化活性。XRD结果表明,锰氧化物对γ-Al2O3载体的改性可以促进氧化铜在载体表面的分散,从而提高了分散态氧化铜的含量,不过这与活性变化的趋势并不完全一致。进一步结合H2-TPR、in-situ FTIR表征结果,我们发现,分散态铜、锰氧化物的还原性质也是影响其催化活性的重要因素,催化剂中分散态铜、锰物种越容易被还原,其对CO+O2模型反应的催化活性就越高。
CuO/Mn2O3/γ-Al2O3催化剂;分散态;还原性质
近年来,随着世界各国汽车保有量的逐年攀升,汽车尾气中的CO、NOx等有害气体给环境带来了巨大危害。因此,汽车尾气净化已经成为人们关注的焦点。据文献报道,当将CuO负载到Al2O3、ZrO2、SiO2等载体表面时,其对CO+O2及CO+NO等反应都表现出良好的催化作用[1-9]。Mn是一种具有多种价态的金属元素,MnOx因容易形成Mnn+/Mn(n+1)+电子对而在氧化还原反应中显示出良好的催化活性。据报道,锰氧化物在Al2O3、SiO2和MgO等载体上对CO+O2及CO+NO等反应也表现出了良好的催化性能[10-12],这主要是由于Mn具有多种价态以及不同价态之间的转化所致。
同时,Mn在不同价态之间的转化还可以有效地提高Cu物种的催化活性,Spassova等曾就Cu-Mn复合氧化物在NOx催化消除中的作用进行了深入研究,他们首先采用共沉淀法制备CuO-MnOx复合氧化物来实现低温下对NO的催化消除[13];接着又从动力学的角度提出在Cu-Mn氧化物共存的情况下存在以下反应循环:Cu2++Mn3+⇌Cu++Mn4+[14],进而证实该循环对CO+NO反应的转化率有着显著的促进作用。
在本课题组先前的研究中[15],我们考察了低含量的铜、锰氧化物在γ-Al2O3载体表面的分散状态,及其在NO+CO模型反应中的催化活性。结果表明,锰物种以Mn2O3的形式在γ-Al2O3表面外延生长,而铜物种将优先分散在Mn2O3表面的四面体空位。在本文中,我们进一步制备了不同配比的CuO/Mn2O3/γ-Al2O3催化剂,测试了该系列样品在CO+O2模型反应中的催化活性;并通过XRF、XRD、TPR、in-situ FTIR等检测手段考察其物理化学性质,初步分析了影响CO+O2催化活性的主要因素。
1 实验部分
1.1 催化剂的制备
1.1.1 Mn2O3/γ-Al2O3的制备
以计算负载量的Mn(Ac)2溶液浸渍γ-Al2O3(700℃焙烧 7 h,SBET=207.4 m2·g-1)。室温搅拌 1 h 后置于约100℃的油浴中搅拌蒸干。在100℃烘箱中干燥过夜,研磨均匀,在流动空气气氛下,经500℃焙烧5 h。为方便讨论,把样品记为yMnAl,如05MnAl表示 1 m2γ-Al2O3上负载有 5 μmol的 Mn3+。
1.1.2 CuO/Mn2O3/γ-Al2O3的制备
以计算负载量的Cu(NO3)2溶液浸渍已经制得的yMnAl,室温搅拌1 h后置于约100℃的油浴中搅拌蒸干。在100℃烘箱中干燥过夜,研磨均匀,在流动空气气氛下,经500℃焙烧5 h。为方便讨论,把样品记为xCuyMnAl,如05Cu05MnAl表示在1 m2γ-Al2O3上先负载 5 μmol的 Mn3+,再负载 5 μmol的Cu2+。
本文中,系列 xCuyMnAl催化剂中 Cu2+、Mn3+的含量为 x=05、10、15,y=00、05、10。
1.2 催化性能测试
CO+O2模型反应在固定床流动体系内进行,以He为载气,反应气体组成为 1.6%CO、20.8%O2、77.6%N2。催化剂用量为50 mg,空速约为30 000 mL·g-1·h-1。反应前,催化剂在 100 ℃下经高纯 N2吹扫1 h。反应后的气体通过5A分子筛(30~60 M)分离后采用热导检测器检测。
1.3 催化剂表征
1.2.1 X 射线荧光光谱分析(XRF)
X射线荧光光谱分析在瑞士ARL公司Advant’XP型仪器上进行,采用铑靶作为激发源,管电压为60 kV,管电流为20 mA。
1.2.2 X 射线衍射(XRD)
X射线衍射在Philips X′pert Pro衍射仪上进行,采用 Cu-Kα 辐射源,入射波长 λ=0.154 18 nm,Ni滤波片,扫描范围 2θ=10°~80°,管压 40 kV,管流 40 mA。
1.2.3 程序升温还原(TPR)
H2-TPR在自组装的TPR仪器上完成,采用热导池检测器,样品装入U型石英管内,100℃下经高纯N2吹扫1 h,切换至Ar-H2混合气,其中H2体积百分含量为7%,升温速率10℃·min-1。样品用量为 50 mg,粒度 20~40 目。
1.2.4 CO 吸附原位红外(in-situ FTIR)
CO吸附原位红外在Nicolet 5700傅立叶变换红外光谱仪上进行测试(分辨率为4.0 cm-1)。取一定量样品压制成自支撑片,放入HTC-3高温原位池,100℃下高纯N2处理1 h,冷却至室温后吸附COAr混合气30 min,其中CO含量为10%(体积百分比)。开始升温并在设定温度下采集红外谱图(背景扣除采用相同温度下CO-Ar气体振动为背景)。
2 结果和讨论
2.1 CO+O2模型反应活性结果
图1(a)给出了在未改性的γ-Al2O3载体上负载不同含量铜物种的CO+O2反应活性结果。由图可见,05CuAl、10CuAl和15CuAl 3种催化剂的反应活性相差不大。在100℃及以下时,3种催化剂都未显示出明显活性;当温度达到125℃时,开始渐渐表现出一定的反应活性;在150~200℃的温度区间中,反应活性迅速提升;当温度达到225℃时,3种催化剂的CO转化率都达到100%。

但在改性载体05MnAl上,样品的催化性能随着铜含量的变化呈现出明显的差异(见图1(b))。当铜含量为 5 μmol·m-2γ-Al2O3时,催化剂表现出了良好的催化性能,在200℃时CO转化率即达到100%;当铜含量为 10 μmol·m-2γ-Al2O3时,反应活性又有所提升;进一步增加铜含量至15 μmol·m-2γ-Al2O3时,反应活性与10Cu05MnAl基本一致,两个样品在175℃同时达到CO的完全转化。在改性载体05MnAl上,反应活性顺序为15Cu05MnAl≈10Cu05MnAl>05Cu05MnAl>05MnAl。
在改性载体10MnAl上(图1(c)),当铜含量为5 μmol·m-2γ-Al2O3时,催化剂的反应活性相对于载体10MnAl有显著提升;当铜含量增加至10 μmol·m-2γ-Al2O3时,反应活性基本不变;进一步增加铜含量 至 15 μmol·m-2γ-Al2O3时,反应活性比10Cu10MnAl有了小幅提升;3个样品同时在175℃达到CO的完全转化。在改性载体10MnAl上,反应活性顺序为 15Cu10MnAl>10Cu10MnAl≈05Cu10MnAl>10MnAl。
在以上3组样品中,我们可以观察到,随着锰物种的引入,样品的催化活性都有明显的提高。与此同时,样品中铜负载量的变化也带来了催化活性的改变,但两者之间的相关关系并不单调。因此,下文将从该系列催化剂的理化性质出发,对这两者之间的联系进行深入探讨。
2.2 XRF结果
用X射线荧光光谱仪(XRF)对系列催化剂进行元素含量分析测试,分析结果示于表1。从实验结果可以看出,催化剂中Cu、Mn、Al物种的质量百分比与是实际投料比基本一致,说明Cu、Mn物种的前驱体都能稳定地负载在γ-Al2O3载体表面,且本实验体系的制备方法造成的样品损失较小,可以忽略不计。

表1 催化剂xCuyMnAl的元素含量Table 1 Element content analysis for xCuyMnAl catalysts
2.3 XRD结果
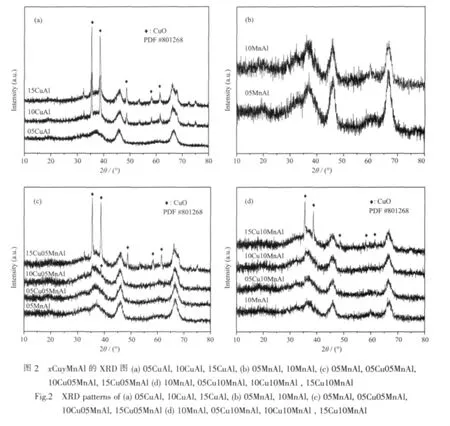
图2(a)、(b)分别给出了 xCuAl(x=05,10,15)和yMnAl(y=05,10)样品的XRD结果。在10CuAl和15CuAl中出现位于 35.5°和 38.7°两处对应于晶相CuO(PDF No.80-1268)的衍射峰,说明 2个样品中,存在晶相CuO物种。而在05CuAl样品中,铜物种全部以分散态的形式存在。这与我们课题组早期得出CuO 在 γ-Al2O3表面的分散容量结果(7.5 μmol Cu2+/m2γ-Al2O3)一致[16]。在 05MnAl和 10MnAl 2 个样品中,未观察到任何锰物种的衍射峰,表明锰物种以高度分散的形式存在于载体表面。
图2(c)给出了在05MnAl表面负载不同含量铜物种xCu05MnAl(x=05,10,15)样品的XRD结果。从图中可以看出,铜物种含量为5 μmol Cu2+/m2γ-Al2O3时,所有的铜物种在05MnAl表面高度分散,观察不到晶相CuO的衍射峰。而当铜含量增大至10 μmol Cu2+/m2γ-Al2O3时,在 38.7°处可以观察到微弱的晶相CuO的衍射峰。随着铜含量的进一步增加,晶相CuO的衍射峰强度增大。由此可知,在05MnAl表面,铜物种的分散容量介于5~10 μmol Cu2+/m2γ-Al2O3之间。从图2(d)中可以看出,铜物种含量为 10 μmol Cu2+/m2γ-Al2O3时,谱图上没有观察到氧化铜物种的晶相衍射峰,因此铜物种的在10MnAl表面的分散容量介于 10~15 μmol Cu2+/m2γ-Al2O3之间。由此可知,锰物种的改性显著地提高了铜物种在γ-Al2O3载体表面的分散容量。
根据以往的研究结果,研究人员一般认为分散态的铜物种是CO+O2模型反应的活性物种,随着分散态铜物种的增加,反应活性将会提高[15,17]。但在本体系中,分散态铜物种的含量并不是影响活性的唯一因素,如10Cu10MnAl和05Cu10MnAl中的铜物种都处于高度分散的状态,但是10Cu10MnAl并没有表现出明显优于05Cu10MnAl的催化活性,为解释这一现象,我们进一步对催化剂的氧化还原及吸附性质进行了考察。
2.4 H2-TPR结果
图3(a)、(b)分别给出了 xCuAl(x=05,10,15)和yMnAl(y=05,10)样品的H2-TPR结果。结合文献报道[18,19],xCuAl在低温和高温处的还原峰可分别归属为分散态 CuO(~220 ℃)和晶相态 CuO(~240 ℃)的还原。对于yMnAl样品,在170~500℃的温度区间内,呈现一个大范围的宽包,根据前人以醋酸盐为前驱体制备的负载型锰氧化物的研究,此还原峰归属为从Mn2O3到MnO的一步还原[20]。
图3(c)、(d)给出了双组分 xCuyMnAl(x=05,10,15,y=05,10)催化剂的H2-TPR表征结果。根据还原峰面积的计算结果 (表2),谱图中的还原峰包含了铜、锰两个物种的还原。由此可知,铜物种的存在使得锰氧化物的还原温度向低温方向移动,这可能是氢溢流效应所致[21-24]。结合单组分负载样品的TPR结果,我们认为,在100~400℃的温度区间中,所有CuO物种均被还原为Cu0,而Mn2O3被还原为MnO,这一推测与峰面积的计算结果吻合。


表2 xCuyMnAl的耗氢量计算结果Table 2 Calculating results of H2consumptions of prepared catalysts

表3 反应活性与TPR还原峰温对照表Table 3 Comparison of activities and reduction temperatures
在(c)、(d)两张谱图中,当铜含量比较低时,只出现一个还原峰P1(~220℃),这个还原峰包含了分散态的铜、锰物种的共同还原;随着铜含量的增加,分散态Cu2+的量不断增加,因此P1峰面积不断增大,而位置保持不变(~220℃);当铜含量进一步增大直至超过分散容量之后,P1峰向低温方向移动(~200℃),同时在较高温度(~225℃)出现一个新的还原峰P2。结合XRD结果,P2峰可以归属为晶相态氧化铜物种的还原。
通过TPR数据与反应活性数据的对比 (表3),我们发现在每个样品中第一个还原峰的峰温(P1)与其催化活性密切相关。在任何一组催化剂中,有较低的P1还原峰温的样品,在CO+O2活性测试中也表现出较好的反应活性;而反应活性相近的样品,其对应的P1还原峰温也相近。由此可见,该还原峰对应物种的还原性质在很大程度上影响了催化剂的反应活性。
2.5 CO吸附原位红外结果
为了进一步解释铜、锰物种还原性质与其活性之间的关系,我们对部分样品进行了CO气氛下的原位红外表征。据文献报道[25-29],CO分子在Cu2+、Cu+、Cu0物种上的吸附分别位于 2 220~2 150 cm-1,2 160~2 080 cm-1和2 130 cm-1以下,且吸附强度为Cu+-CO>Cu0-CO>>Cu2+-CO。因此,在 05CuAl的红外谱图(图 4(a))中,2 103~2 116 cm-1的吸附峰归属为Cu+吸附CO分子的振动。05CuAl样品在25℃时就有一定Cu+-CO的吸附振动,这可能是由吸附CO之前经N2处理的过程中少量CuO的氧脱附而形成了Cu+所致,这与很多文献报道结果一致[30,31]。这一吸附振动峰随着温度的升高逐渐增大,在150℃达到最大值,说明在CO气氛下,催化剂中的Cu2+逐渐被还原形成Cu+物种;在温度超过175℃之后,该吸附振动峰又随着温度的升高逐渐减小,这可能是吸附物种在高温下的脱附以及Cu+进一步被还原成Cu0所致。
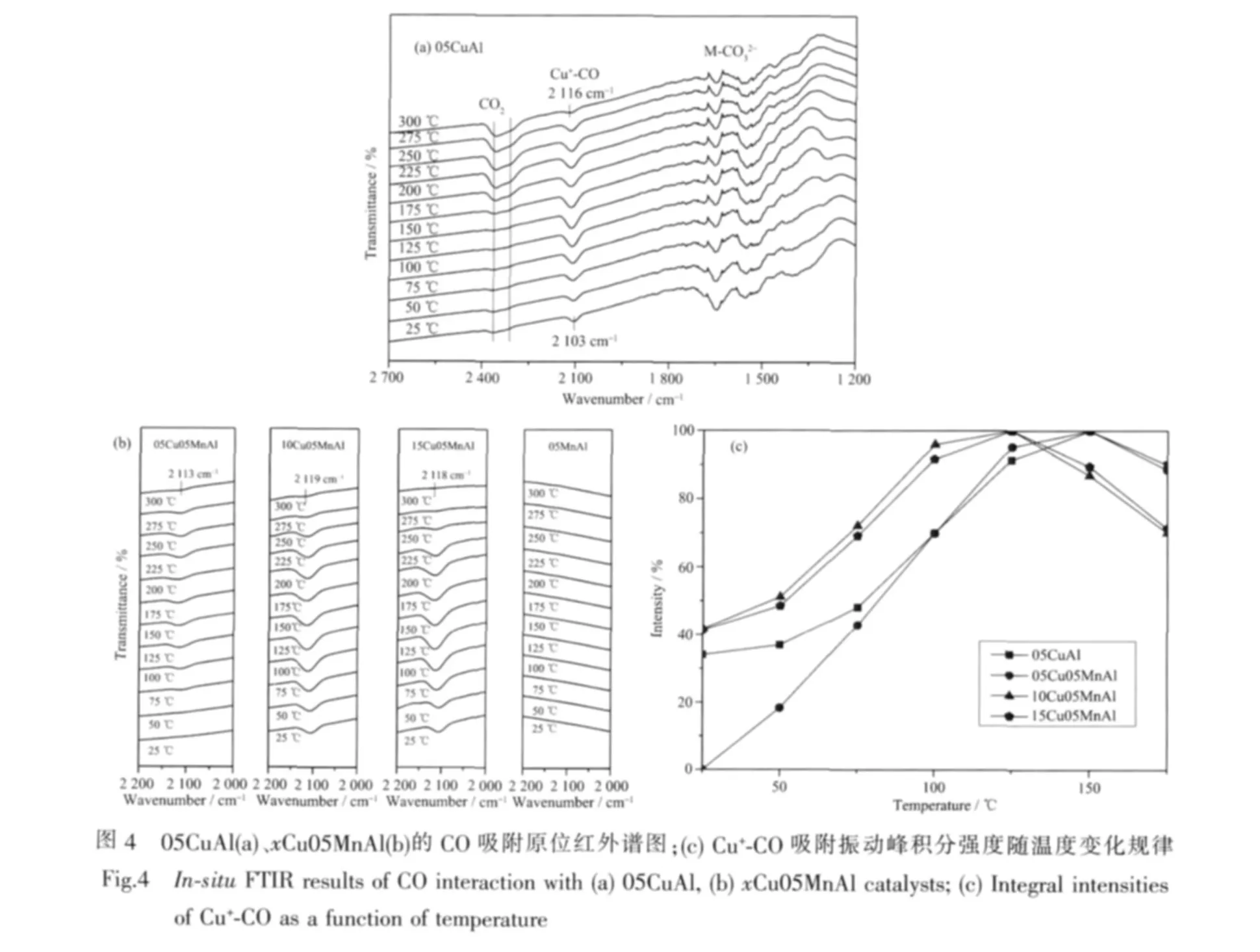
图4(b)给出了xCu05MnAl(x=0,05,10,15)样品中的Cu+吸附产生的振动峰,为了便于比较,也给出了05MnAl的吸附结果。从图中可以看出,单纯的05MnAl样品上未出现CO的吸附振动,因此对于xCu05MnAl样品中的吸附振动可以归属为CO在铜物种上的吸附。结合05CuAl的红外表征结果,这些2115 cm-1附近的吸附振动峰都是Cu+-CO产生的信号。05Cu05MnAl,是唯一在常温(25℃)下没有观察到Cu+-CO吸附振动峰的样品,说明分散态的铜、锰物种之间的相互作用,减弱了铜物种的还原性能。而随着铜含量的进一步增加,10Cu05MnAl和15Cu05MnAl中的分散态铜、锰物种的还原性能逐渐增强,并产生了较为显著的常温Cu+-CO吸附振动峰。
接着,我们对谱图中Cu+-CO振动峰的峰面积进行了积分,探索该吸附物种存在量的变化规律,并试图由此表征出Cu+含量的变化规律,结果示于图4(c)。从室温开始,随着温度的逐渐升高,越来越多的Cu2+物种被CO还原成Cu+,因此Cu+-CO吸附物种的量也逐渐增加;当温度升高到125℃时,10Cu05MnAl和15Cu05MnAl样品的Cu+-CO吸附量达到峰值;温度进一步升高到150℃ 时,05CuAl和05Cu05MnAl样品中的Cu+-CO吸附量也达到了峰值。由此可以看出,在CO气氛下,10Cu05MnAl和15Cu05MnAl样品中的铜物种比较容易被CO还原,生成Cu+,而05CuAl和05Cu05MnAl样品中的铜物种较难被还原。这一结论,与H2-TPR测试结果中的还原峰温变化规律相吻合:05CuAl、05Cu05MnAl、10Cu05MnAl、15Cu05MnAl的 P1峰还原峰温分别为 213 ℃、219 ℃、202 ℃、201 ℃,10Cu05MnAl和15Cu05MnAl的还原性能明显优于05CuAl和05Cu05MnAl,这是导致活性差异的重要原因之一。
3 结 论
本文系统地研究了 xCuyMnAl(x=05,10,15,y=05,10)催化剂在CO氧化反应中的催化活性并从样品的物理化学性质的角度予以解释。实验结果表明:
(a)锰氧化物对γ-Al2O3载体的改性能有效地提高xCuAl催化剂在CO+O2模型反应中的催化活性;
(b)不同铜、锰负载量的样品,其还原性能也有较大的差异:在改性载体yMnAl表面,分散态铜物种的负载将显著降低锰物种的还原温度;随着铜含量进一步增加,晶相态铜物种出现,进一步提升了分散态铜、锰物种的还原性能。
(c)xCuyMnAl系列催化剂的反应活性,与分散态铜、锰物种的还原性能密切相关。催化剂中的分散态铜、锰物种越容易被还原,该催化剂对CO+O2模型反应的催化效率就越显著。
[1]Okamoto Y,Gotoh H.Catal.Today,1997,36:71-79
[2]Zhang R,Alamdari H,Kaliaguine S.J.Catal.,2006,242:241-253
[3]Godowski P J,Onsgaard J,Gagor A,et al.Chem.Phys.Lett.,2005,406:441-445
[4]Aguila G,Gracia F,Araya P.Appl.Catal.A:Gen.,2008,343:16-24
[5]Fu Y,Tian Y,Lin P.J.Catal.,1991,132:85-91
[6]YANG Li-Juan(杨丽娟),LI Xiao-Wei(李晓伟),LIU Bin(刘斌),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2007,23(10):1717-1722
[7]Li Hui-Juan(李惠娟),JIANG Xiao-Yuan(蒋晓原),ZHANG Xu(张旭),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2008,24(6):848-855
[8]Stankova N B,Khristova M S,Mehandjiev D R.J.Colloid Interface Sci.,2001,241:439-447
[9]Zhu H,Shen M,Kong Y,et al.J.Mol.Catal.A:Chemical,2004,219:155-164
[10]YAO Jin-Song(姚金松),MENG Ming(孟明),LUO Jin-Yong(罗金勇),et al.J.Mol.Catal.(China)(Fenzi Cuihua),2006,20:300-305
[11]ZOU Han-Bo(邹汉波),DONG Xin-Fa(董新法),LIN Wei-Ming(林维明).Natur.Gas Chem.Ind.(Tianranqi Huagong),2004,29:10-13
[12]Yamashita T,Vannice A.J.Catal.,1996,163:158-168
[13]Spassova I,Khristova M,Panayotov D,et al.J.Catal.,1999,185:43-57
[14]Spassova I,Khristova M,Nyagolova N,et al.Stud.Surf.Sci.Catal.,2000,130:1313-1318
[15]Wan H,Li D,Dai Y,et al.J.Mol.Catal.A:Chemical,2010,332:32-44
[16]Wan H,Wang Z,Zhu J,et al.Appl.Catal.B:Environ.,2008,79:254-261
[17]YU Yi-Fu(于一夫),ZOU Zhi-Qiang(邹志强),MENG Ming(孟明),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26(2):223-228
[18]ZHANG Li-Ping(张丽萍),WAN Hai-Qin(万海勤),ZHU Jie(朱捷),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2007,23(3):427-431
[19]Larsson P O,Andersson A.Appl.Catal.B:Environ.,2000,24:175-192
[20]Kapteijin F,Langeveld A D,Moulijn J A,et al.J.Catal.,1994,150:94-104
[21]Wang L C,Huang X S,Liu Q,et al.J.Catal.,2008,259:66-74
[22]Fan J,Wu X,Wu,X,et al.Appl.Catal.B:Environ.,2008,81:38-48
[23]Ferrandon M,Bjornbom E.J.Catal.,2001,159:148-159
[24]Buciuman F C,Patcas F,Hahn T.Chem.Eng.Process,1999,38:563-569
[25]Hierl R,Knozinger H,Urbach H P.J.Catal.,1981,69:475-486
[26]Hadjiivanov K I,Vayssilov G N.Adv.Catal.,2002,47:307-511
[27]Padley M B,Rochester C H,Hutchings G J,et al.J.Catal.,1994,148:438-452
[28]Bijsterbosch J W,Kapteijn F,Moulijn J A,J.Mol.Catal.,1992,74:193-205
[29]Dulaurent O,Courtois X,Perrichon V,et al.J.Phys.Chem.B,2000,104:6001-6011
[30]Davydov A A,Budneva A A.React.Kinet.Catal.Lett.,1984,25:121-124
[31]Busca G.J.Mol.Catal.,1987,43:225-236
Preparation,Characterization and Catalytic Performance of CuO/Mn2O3/γ-Al2O3Catalysts over CO Oxidation
DAI Yue1LI Shan-Shan1TANG Chang-Jin1YAO Xiao-Jiang1QI Lei1LIU Bin1GAO Fei*,2DONG Lin*,1,2
(1Key Laboratory of Mesoscopic Chemistry of Ministry of Education,School of Chemistry and Chemical Engineering,Nanjing University,Nanjing 210093,China)
(2Jiangsu Key Laboratory of Vehicle Emissions Control,Center of Modern Analysis,Nanjing University,Nanjing 210093,China)
A series CuO/Mn2O3/γ-Al2O3catalysts were prepared by impregnation and characterized by XRF,XRD,H2-TPR,in-situ FT-IR and activity test for oxidation of carbon monoxide.The model reaction of CO+O2tests showed that,modification of γ-Al2O3by Mn2O3promoted activities of CuO/γ-Al2O3catalysts.XRD results proved that the amount of well-dispersed Cu2+species was increased after the modification by Mn2O3,and it was also found that the catalytic activities were not only decided by the amount of well-dispersed Cu2+species.Furthermore,TPR and in-situ FT-IR results revealed that the activities of catalysts were in good line with the reducibility of well-dispersed copper and manganese oxides species.
CuO/Mn2O3/γ-Al2O3catalysts;well-dispersed state;reducibility
O614.121;O614.71+1;O613.3+1;TQ426.6
A
1001-4861(2012)08-1555-08
2012-01-05。收修改稿日期:2012-03-09。
国家自然科学基金(No.20873060,20973091)、国家重点基础研究规划课题(No.2010CB732300)资助项目。
*通讯联系人。E-mail:gaofei@nju.edu.cn,donglin@nju.edu.cn
