高效表达L-乳酸的酿酒酵母工程菌构建研究
2012-09-12吴晓燕张光一
吴晓燕,张光一
(1.河北省产品质量监督检验院,河北石家庄 050051;2.河北经贸大学生物科学与工程学院,河北石家庄050061)
高效表达L-乳酸的酿酒酵母工程菌构建研究
吴晓燕1,张光一2,*
(1.河北省产品质量监督检验院,河北石家庄 050051;2.河北经贸大学生物科学与工程学院,河北石家庄050061)
采用基因工程方法和进化工程相结合的策略对酿酒酵母进行遗传改造,获得高效表达L-乳酸的酿酒酵母适应工程菌。以酵母丙酮酸脱羧酶基因1为同源序列构建乳酸脱氢酶编码基因整合片段,并与酵母自主表达质粒pUT332共转化酿酒酵母菌,筛选具有乳酸脱氢酶活性的转化子。再通过进一步适应进化筛选高产乳酸的酿酒酵母工程菌。结果表明,工程菌的培养介质组成(g/L)为糖蜜总糖120、玉米黄浆水1000、K2HPO46,起始pH 5.0;发酵条件为发酵时间4 d,接种量10%,搅拌速度650 r/min,通气量1.5 L/min,发酵温度30℃。
L-乳酸;适应进化;遗传改造;农副产品;环境友好
Abstract:An engineered Saccharomyces cerevise strain was constructed by genetic engineering and evolution method.First,construct the integrated chimeric fragment of lactic dehydrogenase(LDH)using yeast pyruvate decarboxylase 1 gene as the homologous integrative site,then co-transform the fragment into the S.cerevise with yeast episomal plasmid pUT332 and select the transformants with LDH activity.Further screen was carried out by adaptive evolution method and obtain the interest strain which grows quickly and secrets L-lactic acid efficiently.The optimized culture media composition(g/L)was molasses 120,corn paste waste water 1000,K2HPO46,pH 5.0.The optimized fermentation parameters are as follow,fermentation time 4 d,inoculating rate 10%,stirring rate 650 r/min,aeration rate 1.5 L/min,fermentation temperature 30 ℃。
Key words:L-lactic acid;adaptive evolution;genetic modification;agricultural by-products;environmentfriendly
L-乳酸作为高科技含量的生物制品,不仅在化学工业中得到广泛应用,而且已被广泛应用于食品饲料、医药、化妆品生产,市场潜力很大。用酿酒酵母发酵生产L-乳酸,生产工艺简化、可持续性好,利于环境保护,降低加工成本,更好地满足聚乳酸生产要求,有广阔的发展前景。Nobuhiro Ishida[1]等通过在染色体整合牛乳酸脱氢酶基因,构建有效产生L-乳酸的酿酒酵母菌,产量可达55.6 g/L。Satoshi Saitoh[2]等将6拷贝牛乳酸脱氢酶基因整合在葡萄酒酵母染色体上构建高产乳酸菌株,并以甘蔗汁作培养介质,乳酸产量高达122 g/L。光学纯度达99.9%。Danilo Porro等[3]将牛的L-乳酸脱氢酶基因在丙酮酸脱羧酶基因突变的Kluyveromyces lactis中表达,使乳酸产量达到109 g/L,转基因K.lactis菌株大大改进分批补料发酵条件下产量。国内未见酒酵母高效表达L-乳酸的系统研究报道。
以农副产品为原料进行深加工、生产L-乳酸产品,提高农副产品的附加值,提高乳酸生产的经济效益,又有利于环境保护,减少废物的排放,促进社会的可持续发展。为了使酿酒酵母有效地产生乳酸,本研究借助丙酮酸脱羧酶编码基因的启动子,将乳酸脱氢酶基因整合在酵母染色体上,并结合适应进化技术获得酿酒酵母工程菌。并采用农副产品或副产物作为发酵介质,对构建高产L-乳酸、菌体生长旺盛的酿酒酵母菌株进行了初步研究。
1 材料与方法
1.1 菌株和载体
大肠杆菌(E.coli)DH5α用于基因克隆。工业酿酒酵母菌为本研究室保存,作为出发菌株。各种质粒为本研究室保存,质粒在大肠杆菌中选择标记为氨苄青霉素抗性(Ampr)。酵母自主表达质粒pUT332携带腐草霉素抗性基因[4]。所用酵母在30℃培养,在4℃麦汁斜面保存。
1.2 培养基
LA培养基:大肠杆菌生长培养基LB(0.5%酵母粉、1%蛋白胨、1%氯化钠),根据需要添加氨苄青霉素(浓度为50 μg/mL),用于质粒扩增。酵母生长复合培养基(YEPD):1%酵母粉、2%蛋白胨、2%葡萄糖,琼脂2%。YNB培养基:YNB 6.7 g/L,葡萄糖2%。含腐草霉素250 μg/mL,用于酵母菌转化子筛选。
1.3 酶和试剂
限制性内切酶、Pfu DNA聚合酶、T4DNA连接酶为宝生物工程(大连)有限公司产品。小牛胸腺DNA及其它分子生物学试剂为Sigma公司产品。引物由上海生工生物技术服务有限公司合成。
1.4 仪器
RS-1型涡旋振荡器:北京鼎昊源科技有限公司;Gene PulserTM电转仪:美国Bio-rad公司;Mini-BeadBeater-1小型珠磨式组织研磨器:美国BioSpec公司;BLBIO-5GJ发酵罐:德国B.Braun生物技术公司;惠普-1100型高效液相色谱仪、HP5890气相色谱仪:美国Agilent公司。
1.5 细胞破碎液制备[5]
3000 r/min离心5 min收集1×109细胞,首先用pH 7的100mmol/L的KH2PO4洗,然后用pH7的10mmol/L的KH2PO4洗。取100 mg(湿重)酵母细胞加1 g直径0.5 mm玻璃珠、0.5 mL pH 7的50 mmol/L的KH2PO4(含1 mmol/L MDDT和2 mmol/L MgCl2)的混合液洗。试管在涡旋振荡器中振荡1 min,冰浴1 min,重复5次。然后13000 r/min离心1 min,收集上清液。
1.6 目的基因PCR
根据 GenBank(accession number Z81318)报导的瑞士乳杆菌(Lactobacillus helveticus)的乳酸脱氢酶基因L-LDH基因序列设计引物。引物1:5'-gcggatccagg agatttattgtt-3',引物 2:5'-ctggtaccgaaaagagatgctc-3'。其5'端有BamHI酶切位点,3'端有KpnI酶切位点。按下面条件PCR,获得L-乳酸脱氢酶基因,大小1 kb。
根据 GenBank(accession number X04675)报导的酿酒酵母基因组丙酮酸脱羧酶基因为模板设计引物。编码序列上游序列3:5'-atatatgaattcgcgtttatttacctatctt-3',4:5'-atatatggatcctttgattgatttgactgtg-3',其 5'端 有EcoRI酶切位点,3'端有BamHI酶切位点。编码序列的下游序列 5:5'-atataggtcgacttgaacgtcccagctaagttg-3',6:5'-atatattctagactcgtcagcaatagtggtcaac-3',其 5'端有SalI酶切位点,3'端有XbaI酶切位点。按下列条件进行PCR,获得丙酮酸脱羧酶1的部分启动子序列和编码序列的下游序列。
PCR 体系组成(50 μL):模板1 μL;E.Master酶混合物 25 μL;引物 2 μL×2;重蒸水加至 50 μL。
参数:

1.7 酵母转化
酵母细胞经10 mL YEPD培养基30℃过夜培养,然后转接500 mL YEPD培养液(2 L三角瓶)摇床培养至OD600=1.3~1.5。4℃,4000r/min收集细胞重悬于80mL重蒸无菌水,添加10mLpH7.5的10×TE缓冲液、10mL 1 mol/L LiAc,30℃低速振荡45 min;再加2.5 mL新配制的1 mol/L的DTT,温浴15 min。酵母悬液用重蒸水稀释至500 mL,洗3次。细胞重悬于250 mL冰冷的重蒸水,再悬于30 mL冰冷的1 mol/L山梨醇。收集细胞并重悬于0.5 mL冰冷的1 mol/L山梨醇中,调节细胞悬液 OD600=200。向 1.5 mL 离心管添加 40 μL 细胞,5 μL DNA(线性 DNA:质粒 DNA=10∶1,最好是 50ngpUT332)。细胞-DNA混合物转入带帽的0.2 cm冰浴电转移管进行电脉冲处理(1.5 kV,25 mF and 200 ohms),然后立即加入1 mL冰冷的YEPD培养基,30℃轻微振动2 h~4 h。取250 μL涂含腐草霉素的转化平板,30℃培养3 d~4 d。
1.8 适应进化实验
保藏菌株涂基本培养基平板,选单菌落接种5 mL液体试管,30℃摇床(40 r/min)培养过夜,然后转接250mL三角瓶,其工作量50 mL,30℃40 r/min摇床培养3 d。转接培养7 d。培养细胞重复上面步骤,碳源或盐浓度增加。培养介质定期更新(3.5 d更新一次),共12次。培养液葡萄糖浓度为20%~30%。碳酸钠浓度为3%~5%。培养40多天后,取5 mL转接50 mL培养液培养,再转接1.0 L YNB介质,(含葡萄糖300 g/L或碳酸钠5 g/L,发酵1 d。培养物涂平板,挑单菌落依次转接如上5 mL、50 mL、1.0 LYNB介质(含葡萄糖300 g/L或碳酸钠50g/L),发酵16h。第3次重复上述步骤发酵13 h。最后收集细胞涂平板。用乳酸调节发酵液的pH<4.6。筛选生长旺盛的适应菌株。
1.9 乳酸脱氢酶测定
YEPD培养基培养,将对数生长期的细胞(OD600=0.8)转至含0.9 mol/L NaCl的YEPD培养基,30℃培养2 h。离心收集细胞,用等渗盐溶液洗2次,置于沸腾的乳酸脱氢酶LDH提取缓冲液(0.1 mol/L Mops,pH 7.2,10%甘油,1 mmol/L二硫苏糖醇),然后酵母用小型珠磨式组织研磨器破碎细胞,添加0.5-mm zirconia-silica珠,然后4℃13000 r/min离心15 min除去细胞碎片,上清液用于乳酸脱氢酶活性测定。
在磷酸缓冲液(73 mmol/L KH2PO4,3.5 mmol/L Na2HPO4,pH 5.6)添加1 mmol/L丙酮酸和0.2 mmol/L NADH,25℃分光光度法测定乳酸脱氢酶活性。酶活性定义为在反应条件下,1 min将1 mmol/L底物还原为乳酸所需的酶量。蛋白质含量用考马斯亮蓝染色法测定,以牛血清蛋白作为测定参照标准。
1.10 发酵实验
储存菌株培养物2mL接种250mL三角瓶(100mL YEPD培养介质),30℃150 r/min摇瓶培养至平衡期作为种子培养物。发酵采用合成培养基,发酵罐装有3 L培养介质,121℃灭菌40 min。发酵罐接种量为1.0×107个/mL~1.5×107个/mL,转速 650 r/min。控制通气量1.5 L/min,发酵温度控制在30℃。如果需要可用10%无菌氨水控制。发酵6 d,每天取样测定发酵液的pH、细胞生物量、糖消耗量、乙醇含量和乳酸含量。
1.11 分析方法
乳酸、残糖用高效液相色谱HPX-87H(300 mm×7.8 mm)Aminex色谱柱(Bio-Rad)或DNS法测定。用NucLeosiL 5C-18100A柱。流动相为重蒸水,流速1 mL/min。5mmol/LH2SO4作为洗脱液,流速0.5mL/min。乳酸的光学纯度用惠普-1100型高效液相色谱仪测定。Hypersil ODS(C18)色谱柱(150 mm×2.1 mm i.d,5 μm);流动相:0.65mmol/L2,3,6三甲基β环糊精(TM-β-CD,含 5 mmol/L H2SO4),pH 2.5;流速:0.5 mL/min;紫外检测波长:210 nm;进样量:5 μL;柱温:室温。乙醇用气相色谱测定,采用火焰离子化检测器。取1 μL注入HP5890气相色谱仪,配备DBWAX大孔柱。载气为氮气,流速为10 mL/min。加样和检测温度分别为240、250℃。炉温:80℃保持2 min,然后升至200℃,升温速度10℃/min。
2 结果与讨论
2.1 乳酸脱氢酶基因整合片段获得
2.1.1 乳酸脱氢酶基因LDH获得
将乳酸脱氢酶基因LDH基因引入酿酒酵母,使其可以用另一代谢途径再生NAD+,糖酵解转向乳酸生成途径,使胞内丙酮酸直接还原为乳酸,导致乙醇和乳酸同时积累。已经证明[6]:瑞士乳杆菌(L.helveticus)乳酸脱氢酶基因LDH可以与酵母的丙酮酸脱羧酶竞争使乙醇生产方向转至乳酸生产方向。故本研究以瑞士乳杆菌基因组为模板,进行PCR获得乳酸脱氢酶基因。
2.1.2 乳酸脱氢酶基因嵌合片段构建
将PCR获得的丙酮酸脱羧酶基因的5'插入pBluescriptM13-的EcoRI/BamHI位点,然后再将3'片段插入SalI/XbaI位点。重组载体1经BamHI+SalI酶切,与将L.helveticus的L-LDH/BamHI+KpnI基因和乙醇脱氢酶下游3'基因片段/KpnI+SalI一同连接,获得携带5'PDC1+LDH+ADH1T+3'PDC1基因片段的重组载体2。用AatII+XbaI酶切获得该嵌合片段如图1,大小约为2.9 kb。

2.2 产乳酸酿酒酵母菌株构建
2.2.1 电转化及整合验证
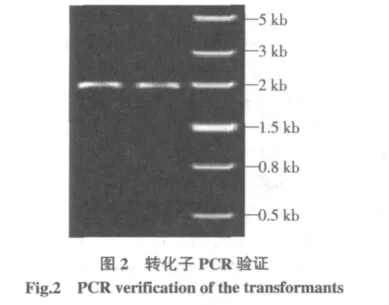
通过电转化法将整合片段与酵母自主表达质粒pUT332转化工业酿酒酵母菌,在含150 μg/mL腐草霉素的YEPD培养基上筛选阳性转化子。提取转化子基因组进行PCR验证,如图2,以乳酸脱氢酶基因LDH上游引物和PDC1终止序列的下游引物为引物,获得基因片段为2.1 kb。表明乳酸脱氢酶基因整合在酵母的基因组上,并破坏丙酮酸脱羧酶1基因。
2.2.2 转化子的筛选标记丢失培养
对目标转化子进行YEPD非选择性培养数代,选择腐草霉素抗性丢失的菌株进一步研究。
2.2.3 转化子初步生长研究
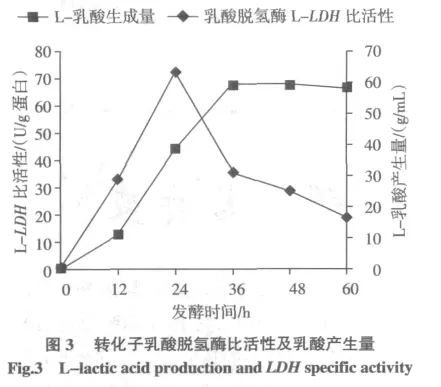
对转化子进行细胞生长及初步发酵性能测试,转化子30℃培养72 h,接种量为10%。测定L-乳酸产生量最高为48.9 g/L,见图3。
2.3 转化子适应进化
研究发现,在高渗透胁迫条件下,酵母细胞通过激活不同的机理合成一些代谢产物并在胞内积累滞留,达到适应存活[5]。酵母细胞中pH越高,生存能力越强,乳酸产量越高。本研究采用高渗胁迫适应和低pH适应相结合的筛选策略。
首先采用高糖/高盐作为选择条件诱导菌株发生遗传改变获得突变子库。用30%葡萄糖及5%的碳酸钠的合成基本培养基进行适应筛选(40 r/min摇瓶培养),使获得的重组菌株产生抗胁迫能力,并经连续传代培养28 d(约200代)的系列转移-稀释策略,筛选生长旺盛的适应菌株60个;然后用低pH 4.5的合成培养介质(用乳酸调节发酵液的pH<4.5)进一步适应培养,筛选生长旺盛的适应菌株30个。最后,筛选生长旺盛、胞内pH高、乳酸产量高的菌株3个。
2.4 适应菌株发酵优化研究
2.4.1 发酵介质组成优化
对糖蜜、玉米黄浆水、尿素比例进行研究,采用三因素四水平,按正交表L9(34)设计正交试验,30℃250 mL三角瓶(装瓶量100 mL)摇床培养48 h,确定培养基最佳组成。优化培养基组成(g/L):糖蜜总糖120;玉米黄浆水 1000;K2HPO46。
2.4.2 发酵条件研究
1)以菌体接种量、培养基初始pH、培养时间,按正交表L9(34)设计正交试验,250 mL三角瓶装有100 mL培养介质30℃200 r/min摇瓶培养,测定乳酸生成量,确定最适初始发酵介质pH 5.0,接种量1.3 cells/mL×107cells/mL,培养 5 d。
2)采用5-L发酵罐(BIOSTAT-B,B.Braun,Germany),介质填充量3 L,发酵介质初始pH 5.0,接种量1.3×107cells/mL。控制溶氧30%~50%,搅拌速度300 r/min~1000r/min,发酵温度30℃,发酵6d。每天取样测定发酵液的pH、细胞生物量、糖消耗量、乙醇含量和乳酸含量。
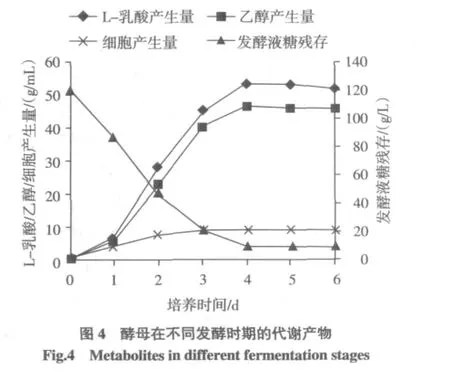
确定最佳发酵条件:发酵介质初始pH 5.0,接种量1.3×107个/mL,发酵温度 30℃,溶氧 30%,搅拌速度650 r/min,发酵时间4 d。最终得率:乳酸52.2 g/L,乙醇45.8 g/L;49.2%的糖转化为乳酸,乙醇产生量降低到原来的46.8%。
酵母在不同发酵时期的代谢产物见图4。
3 结论
聚L-乳酸作为一种非常有吸引力的热塑性无毒高分子材料,生物相容性好,易与市政环卫管理处理体系结合,没有白色污染,满足社会可持续发展要求。本课题获得高效表达L-乳酸的酵母适应工程菌,可利用价格低廉的糖蜜、玉米黄浆水发酵生产乳酸。发酵介质组成(g/L):糖蜜120,玉米黄浆水1000,K2HPO46,pH 5.0。最适发酵条件为:发酵温度30℃,装液量 60%,接种量 1.3×107个/mL,溶氧 30%,搅拌速度650 r/min,发酵时间4 d。构建的酵母适应工程菌可以用廉价培养介质发酵生产,生产成本低;引入的乳酸脱氢酶基因整合在酵母染色体上,遗传稳定;没有引入细菌来源的抗药性基因,利于食品应用;可以进行高密度培养;酵母酸耐受性强,减少发酵过程中中和剂使用。该酵母适应工程菌的乳酸产量比一般乳酸菌低,仍有部分乙醇产生,今后应进一步进行遗传修饰,提高L-乳酸产量。由于廉价发酵介质杂质多,发酵后的低成本纯化方法选择具有挑战性,应继续进行纯化研究,降低纯化成本。
[1]Ishida N,Saitoh S,Tokuhiro K,et al.Efficient production of l-lactic acid by metabolically engineered saccharomyces cerevisiae with a genome-integrated l-lactate dehydrogenase gene[J].Appl Environ Microbiol,2005,71(4):1964-1970
[2]Saitoh S,Ishida N,Onishi T,et al.Genetically engineered wine yeast produces a high concentration of l-lactic acid of extremely high optical purity[J].Appl Environ Microbiol,2005,71(5):2789-2792
[3]Bianchi M M,Brambilla L,Protani F,et al.Efficient homolactic fermentation by Kluyveromyces lactis strains defective in pyruvate utilization and transformed with the heterologous LDH gene[J].Appl Environ Microbiol,2001,67(12):5621-5625
[4]Stanley D,Bandara A,Fraser S,et al.The ethanol stress response and ethanol tolerance of Saccharomyces cerevisiae[J].J Appl Microbiol,2010,109(1):13-24
[5]Zengran Liu,Guangyi Zhang,Yunping Sun.Mutagenizing brewing yeast strain for improving fermentation property of beer[J].J Biosci Bioengin,2008,106(1):33-38
[6]Savijoki K,Palva A.Molecular genetic characterization of the L-lactate dehydrogenase gene(ldhL)of Lactobacillus helveticus and biochemical characterization of the enzyme[J].Appl Environ Microbiol,1997,63(7):2850-2856
Construction of Commercial Saccharomyces cerevisiae with L-lactic acid Efficient Production Ability
WU Xiao-yan1,ZHANG Guang-yi2,*
(1.Hebei Institute of Product Quality Supervision and Inspection,Shijiazhuang 050051,Hebei,China;2.Bioscience and Bioengineering College,Hebei University of Economics and Business,Shijiazhuang 050061,Hebei,China)
2012-03-25
河北省引进留学人员资助项目(2011226);河北省社会科学发展研究课题(201103161)
吴晓燕(1964—),女(汉),副研究员,硕士,研究方向:食品安全与可持续发展。
*通信作者:张光一(1964—),男(汉),副教授,硕士,研究方向:食品安全与可持续发展。
