钛胶正相高效液相色谱法同时分析三聚氰胺和三聚氰酸
2012-09-12姜子涛
李 曼,李 荣,谭 津,姜子涛
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津300134)
钛胶正相高效液相色谱法同时分析三聚氰胺和三聚氰酸
李 曼,李 荣,谭 津,姜子涛*
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津300134)
建立了同时分析液态奶、自来水和游泳池水中三聚氰胺和三聚氰酸的钛胶正相高效液相色谱法。色谱条件:分离柱为Titania Sachtopore-NP柱(250mm×4.6mm×5μm),流动相为水∶甲醇=50∶50(V/V)、流动相中含醋酸盐1.0mmol/L、pH7.0、流速0.8mL/min、柱温60℃、UV检测波长210nm。 三聚氰胺和三聚氰酸分别在0.1~10μg/mL和2~100μg/mL范围内与对应的峰面积呈良好的线性关系,检出限分别为0.02μg/mL和0.1μg/mL,本方法三聚氰胺的回收率为94.8%~111.7%,三聚氰酸回收率为103.9%~114.3%,三聚氰胺和三聚氰酸测定结果的相对标准偏差分别为0.62%和0.78%(n=8)。
三聚氰胺,三聚氰酸,钛胶柱,高效液相色谱法
Abstract:A method for simultaneous determination of melamine(MLM) and cyanuric acid(CA) in liquid milk,tap-water and swimming pool water by high performance liquid chromatography on normal-phase(NP) titania was devoloped.The samples were separated with a Titania Sachtopore-NP column(250mm×4.6mm×5μm).The chromatographic separation conditions were as follows:a mixture of water and methanol in the ratio of 50 to 50(V/V) containing 1.0mmol/L acetate at pH7.0 was used as mobile phase,flow rate was 0.8mL/min,column temperature was 60℃,and the detection wavelength was 210nm.Calibration curves for MLM and CA exhibited good linearity over the concentration range from 0.1 to 10μg/mL for MLM and from 2 to 100μg/mL for CA.The limits of detection(LOD) of MLM and CA were 0.02μg/mL and 0.1μg/mL,respectively.The recoveries of the method ranged from 94.8%to 111.7%for MLM and from 103.9%to 114.3%for CA,and the relative standard deviations(RSDs) for MLM and CA were 0.62%and 0.78%,respectively.
Key words:melamine;cyanuric acid;titania-based stationary phase;high performance liquid chromatography
近几年食品安全问题引起了全世界的关注。其中最为典型、影响最大的当属三聚氰胺相关事件。三聚氰胺俗称密胺、蛋白精,是一种三嗪类含氮杂环有机化合物,常被用作化工原料。因为其含氮量高,有些人将其作为伪蛋白添加到食品中,虽有研究证据显示单独摄入少量的三聚氰胺毒性较低[1],但它在人体内会逐步水解成其结构类似物三聚氰酸,二者共存则会导致肾结石[2]。因为两者共存时,会通过氢键作用生成稳定且难溶于水的大分子复合物[3]。国外已有在乳制品中检出三聚氰酸的报道[4]。三聚氰酸作为消毒液的原料之一可以降低氯的释放速度,延长杀菌时间[5]。因此,开展三聚氰胺和三聚氰酸分析方法的研究具有很大的实际应用价值。近年来,单独测定三聚氰胺或三聚氰酸的研究较多,并且已有湖水和游泳池水中三聚氰酸检测方面的报导[6]。但是同时分析三聚氰胺和三聚氰酸的文献较少,主要的分析方法是高效液相色谱法[5-6]、液相色谱-串联质谱法[7-10]、酶联免疫法[11]、气相色谱-串联质谱法[12-13]。本文将新型HPLC固定相用于三聚氰胺和三聚氰酸的同时测定。钛胶基质固定相是近年发展起来的新型色谱填料,其具有传统硅胶基质固定相不可比拟的优点,不存在硅胶固定相对碱性化合物存在“不可逆吸附”的致命缺陷。并且钛胶具有极好的化学稳定性,在pH1~14的范围内都是非常稳定的,可以弥补硅胶固定相的不足。在现在的研究中,我们应用钛胶基质固定相正相柱,建立了钛胶正相HPLC法同时测定三聚氰胺和三聚氰酸含量的新方法,并获得较高的灵敏度、精密度和准确度,结果满意。为食品的安全检测提供了一个新途径,同时也为拓展钛胶固定相在食品分析中的应用奠定了一定的理论基础。
1 材料与方法
1.1 材料与仪器
甲醇 天津市科密欧化学试剂有限公司,色谱纯;无水醋酸铵 天津市北联精细化学品开发有限公司,分析纯;冰乙酸 天津市科密欧化学试剂有限公司,色谱纯;氨水 天津市石英钟厂,分析纯;娃哈哈纯净水 杭州娃哈哈集团有限公司;液态奶 购于天津商业大学某超市;三聚氰酸标准品 上海远帆助剂厂,分析纯,配制成100μg/mL标准贮备液:称取10mg三聚氰酸置于100mL容量瓶中,用甲醇-水(50∶50)溶解并定容至刻度,贮备液在2~8℃冷藏保存;三聚氰胺标准品 天津市科密欧化学试剂有限公司,分析纯,配制成50μg/mL标准贮备液:称取5mg三聚氰胺置于100mL容量瓶中,用甲醇-水(50∶50)溶解并定容至刻度,贮备液在2~8℃冷藏保存;自来水 采自天津商业大学食品科学实验室;游泳池水 采自天津商业大学游泳馆。
Agilent 1200系列高效液相色谱仪 配有单泵(型号G1310A),单可变波长紫外检测器(型号G1314B),手动进样器(型号G1328B),20μL定量环,柱温箱(Yamatake HT-230A),安捷伦公司;钛胶基质正相色谱柱(Sachtopore-NP,5μm,250mm×4.6mm i.d.) 美国Zirchrom公司;FA1104N电子天平 上海精密科学仪器有限公司。
1.2 色谱条件
流动相为水∶甲醇=50∶50(V/V),pH7.0,乙酸铵浓度为1.0mmol/L,流速为0.8mL/min,柱温为60℃,UV检测器波长210nm。以保留时间定性、峰面积定量。
1.3 标准曲线的绘制
1.3.1 三聚氰酸标准曲线的绘制 取100μg/mL的标准贮备液,稀释为2、5、10、25和50μg/mL,进样体积20μL,以三聚氰酸浓度(μg/mL)为横坐标,峰面积为纵坐标绘制标准曲线并计算线性回归方程。
1.3.2 三聚氰胺标准曲线的绘制 取50μg/mL的标准贮备液,稀释为0.1、0.2、0.5、1.0、2.0、5.0和10μg/mL,进样体积20μL,以三聚氰胺浓度(μg/mL)为横坐标,峰面积为纵坐标绘制标准曲线并计算线性回归方程。
1.4 样品前处理
1.4.1 液态奶的前处理 取1.0mL液态奶于15mL带刻度塑料离心管中,加入20g/L的醋酸铅0.5mL和5.0mL乙腈,用娃哈哈纯净水定容至10mL,超声30min后,3000r/min离心10min,取上清液用0.45μm微孔滤膜过滤。
1.4.2 游泳池水和自来水 取5mL样品用甲醇定容至10mL,经0.45μm微孔滤膜过滤后进样,进样体积20μL。根据三聚氰胺和三聚氰酸色谱峰面积,通过回归方程计算得到样液中三聚氰酸和三聚氰酸的含量(μg)。
2 结果与分析
2.1 流动相中醋酸盐浓度的选择
首先选定柱温60℃、流速0.8mL/min、甲醇占流动相比例为50%和pH7.0,分别选取醋酸盐的浓度为0.1、0.5、1.0、5.0和10mmol/L对三聚氰胺和三聚氰酸进行分析。结果显示,随着醋酸盐的增加三聚氰酸的保留时间和半峰宽呈现增大的趋势,有文献报道随着醋酸盐浓度的增加钛胶柱表面的水层变厚[14],根据分配机理三聚氰酸更多的分配在水相中,所以其保留时间增加。三聚氰胺则相反,随着醋酸盐的增加三聚氰胺的保留逐渐变弱,这可能是因为三聚氰胺与钛胶柱之间还存在着更强的吸附作用,而醋酸盐与钛胶柱之间的配体交换作用会抑制三聚氰胺与固定相的作用,所以随着盐浓度的增加三聚氰胺与钛胶柱的接触机率减小,其保留减弱。由于在高醋酸盐浓度下三聚氰胺保留时间太弱,而低醋酸盐浓度下二者分离度不高,为了将两者更好的分离,最终选择醋酸盐浓度为1.0mmol/L。
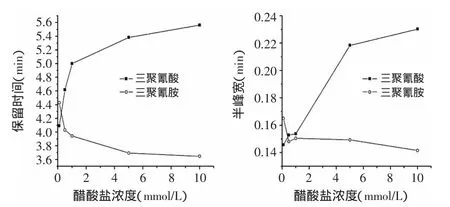
图1 保留时间和半峰宽与醋酸盐浓度的关系Fig.1 Relations between retention time,peak width at half height and the concentration of sodium acetate in mobile phase
2.2 流动相pH的选择
在柱温60℃、流速0.8mL/min、甲醇占流动相体积比例50%和醋酸盐浓度1.0mmol/L的条件下,通过加入醋酸和氨水来调节流动相的pH,分别为9.0、8.0、7.0、6.0和5.0用于三聚氰胺和三聚氰酸的分离分析。对于三聚氰酸来说,随着pH的增加三聚氰酸分子中羟基氢的解离增强,分子极性增强,在正相柱上保留时间理应增大,而有结果显示当pH大于7.0时三聚氰酸随着pH的增加保留时间反而减小,这可能是因为pH大于7时钛胶柱表面带负电,与三聚氰酸发生静电排斥。对于三聚氰胺,结果显示总体上随着pH的增加保留时间显示出逐渐减小的趋势,这可能是由于三聚氰胺分子中氨基的质子化随pH增大(氢离子浓度减小)而减弱,即极性减弱,且钛胶与电负性物质的吸附作用随着pH增大也逐渐减弱。综合考虑保留时间与峰型(随着pH减小,倒峰的干扰致使三聚氰酸的峰型变差),最终选择流动相的pH为7.0。

图2 保留时间和半峰宽与pH关系Fig.2 Relations between peak width at half height,retention time and pH
2.3 流动相中甲醇含量的选择
在柱温60℃、流速0.8mL/min、pH7.0和盐浓度1.0mmol/L的条件下,改变甲醇和水的比例分离分析三聚氰胺和三聚氰酸,甲醇的含量分别为70%、60%、50%、40%和30%。随着甲醇含量的增加三聚氰胺和三聚氰酸的保留时间也增加。三聚氰酸和三聚氰胺均为极性物质,随着甲醇比例的增加、水含量减少,流动相的极性逐渐减弱,根据相似相容原理所以二者的保留时间增大。在甲醇含量为40%和50%时柱效相对较高,但是当甲醇为40%时三聚氰胺的保留相对较弱,所以最终选择甲醇含量为50%。分析物在正相钛胶柱上的保留可能有两种作用机理[15]:分配作用和吸附作用。当符合公式(1)时,柱子与分析物之间是分配作用,其中k是保留因子,φ是流动相中强洗脱剂占流动相的体积比例。当符合公式(2)时,柱子与分析物之间是吸附作用,其中k是保留因子,NB是流动相中强洗脱剂的摩尔百分含量。将三聚氰胺和三聚氰酸的数据代入,结果显示用公式(1)和(2)做线性拟和均有比较好的线性,说明它们与柱子间既有分配作用又有吸附作用,但是随着条件的改变两种作用的强度也会发生变换。从二者随醋酸盐浓度的变化结果来看,三聚氰酸在正相钛胶柱上的保留更倾向于分配机理,而三聚氰胺与钛胶柱的作用以吸附作用更强。

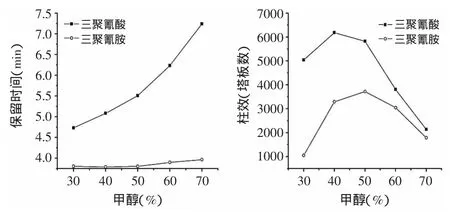
图3 保留时间和柱效与甲醇含量的关系Fig.3 Relations between retention time,number of plates and the proportion of methanol
2.4 流动相流速的选择
在柱温60℃、盐浓度1.0mmol/L、pH7.0和甲醇占流动相体积50%条件下调节流速分别为1.0、0.9、0.8、0.7和0.6mL/min。随着流速的增加分析物的保留时间也增加,半峰宽减小,但是柱压逐渐增大,综合考虑柱压与分析时间最终选择流速为0.8mL/min。
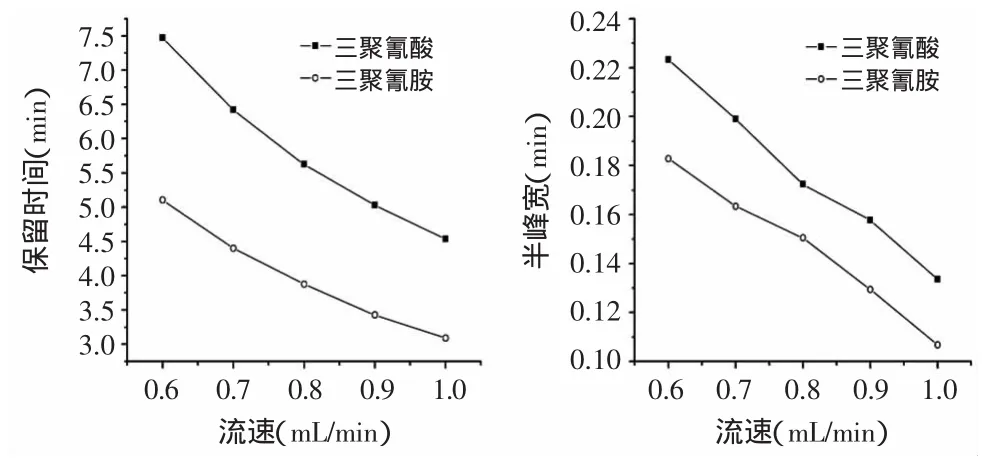
图4 保留时间和半峰宽与流速的关系Fig.4 Relations between retention time,peak width at half height and flow rate
2.5 柱温的选择
在盐浓度1.0mmol/L、pH7.0、甲醇含量50%和流速0.8mL/min的条件下,改变柱温分别为30、40、50和60℃,对分析物三聚氰胺和三聚氰酸的分离分析影响不大,考虑到高温下柱压较低所以最终选择温度为60℃。

图5 保留时间和柱效与柱温的关系Fig.5 Relations between peak width at half height,retention time and number of plates
通过上述实验因素条件的考察,最终确定三聚氰酸和三聚氰胺分离分析最佳条件为:流动相为水∶甲醇=50∶50、醋酸盐1.0mmol/L、pH7.0、柱温60℃、流速0.8mL/min、检测波长210nm,三聚氰胺(1μg/mL)和三聚氰酸(10μg/mL)标准品的色谱图如下,在该条件下分离度达7.24。

图6 三聚氰胺和三聚氰酸标准品的色谱图Fig.6 Chromatogram of melamine and cyanuric acid standard samples
2.6 检出限及线性范围
2.6.1 三聚氰酸的检出限及线性范围 将三聚氰酸标准储备液分别稀释成2、5、10、25、50和100μg/mL的浓度进样,考察了此方法的线性范围。当三聚氰酸浓度在2~100μg/mL范围内,标准曲线线性良好,线性回归方程为y=-19.0563+17.1396x,R=0.9994,检出限(以3倍噪声计算)为0.1μg/mL。
2.6.2 三聚氰胺的检出限及线性范围 将三聚氰酸标准储备液分别稀释成0.1、0.2、0.5、1.0、2.5、5.0和10μg/mL的浓度进样,考察了此方法的线性范围。当三聚氰酸浓度在0.1~10μg/mL范围内,标准曲线线性良好,线性回归方程为y=12.1886+377.2558x,R=0.9999,检出限(以3倍噪声计算)为0.02μg/mL。
2.7 方法精密度和准确度
在选定的准确度的色谱条件下,用三聚氰胺(1.0μg/mL)和三聚氰酸(10μg/mL)的标准溶液重复进样8次,计算得三聚氰胺和三聚氰酸的相对标准偏差即精密度分别为0.62%和0.78%。经测定后自来水与游泳池水样品中分析物样的浓度在检出限以下,在样品中加入一定量三聚氰胺和三聚氰酸的混合标准溶液,与样品一致处理后进样测定方法回收率见表1,加标后样品色谱图见图7。液态奶中由于本身基质较复杂,在本实验不采取固相萃取柱净化等复杂前处理条件的情况下,在三聚氰胺吸收峰处有干扰物质,所以需进行更有效的样品前处理以减少系统峰的影响从而可以实现三聚氰胺的定性与定量。不过三聚氰酸可以与邻近峰实现较好的分离,其与邻近峰的分离度为1.82。综上三种样品的测定结果,本法三聚氰胺的回收率范围是94.8%~111.7%,平均回收率为101.5%。三聚氰酸的回收率范围是103.9%~114.3%,平均回收率为110.0%。
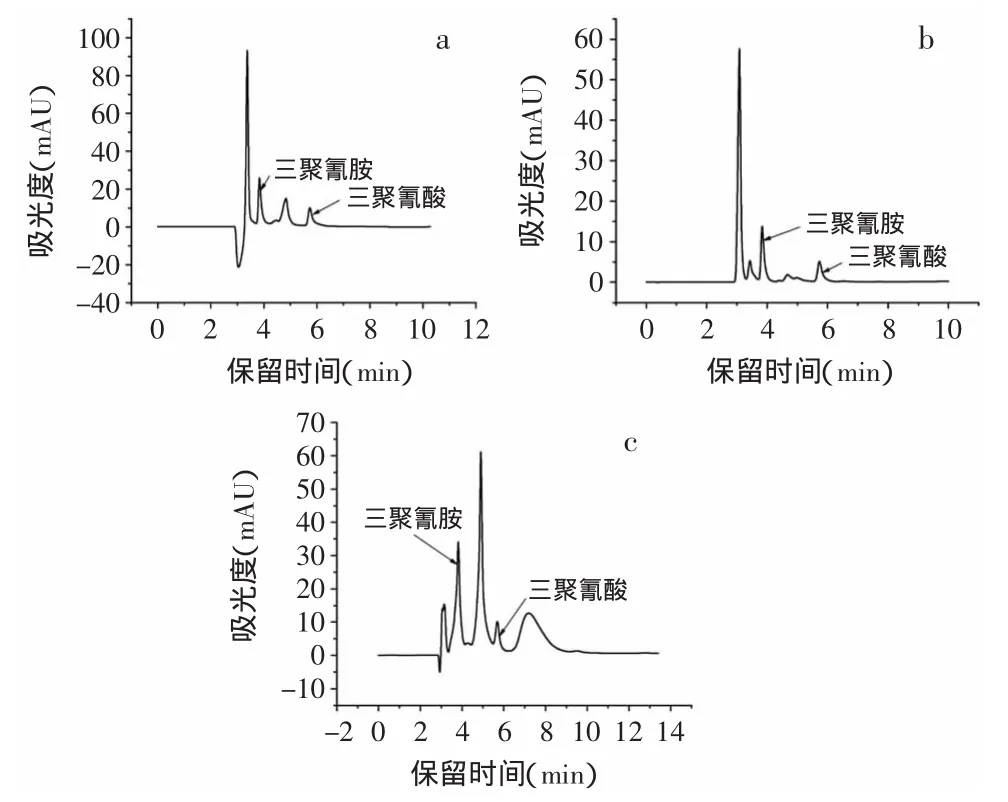
图7 加标后样品色谱图Fig.7Chromatograms of(a)swimming pool water,(b)tap water,and(c)liquid milk samples after standard addition
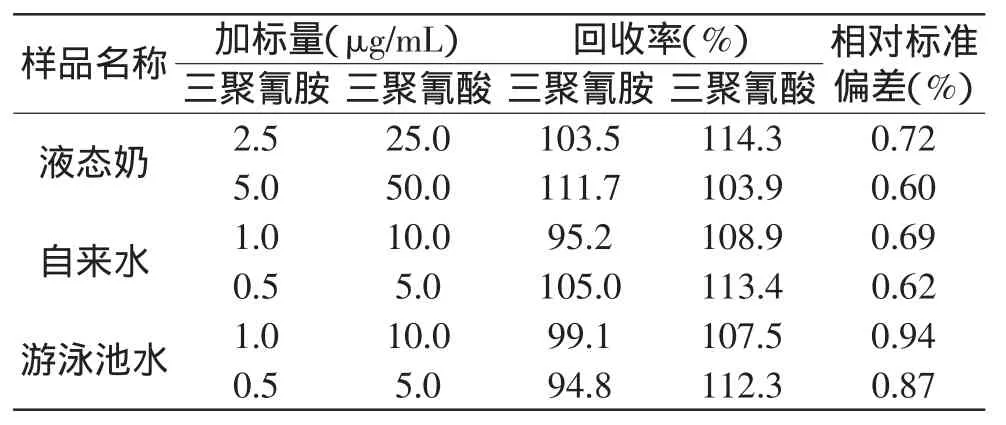
表1 样品加标回收率Table 1 Spiked recoveries of samples
3 结论
本文建立了以钛胶正相高效液相法检测三聚氰胺和三聚氰酸的最佳检测条件。与三聚氰胺相比,三聚氰酸在食品安全领域还没有广泛引起人们对其危害的关注,但是作为游泳池水消毒液原料之一的三聚氰酸已经引起了人们的注意。由于三聚氰酸常与三聚氰胺共同存在,建立一个简便快速并且可以同时测定三聚氰酸和三聚氰胺的方法是十分必要的。本文在不进行较复杂样品前处理的情况下,对液态奶、自来水和游泳池水进行了加标分析三聚氰胺和三聚氰酸。但是对于像奶制品这样基体复杂的样品来说,需要进行较为复杂的前处理才可以将三聚氰胺与基体中的干扰物质分开,因此若想将此方法应用于复杂样品,还需要采取更有效的样品前处理方法,从而避免基体物质对三聚氰胺测定时产生的干扰。
[1]Melnick RL,Boorman GA,Haseman JK,et al.Urolithiasis and bladder carcinogenicity of melamine in rodents[J].Toxicol Appl Pharm,1984,72(2):292-303.
[2]Dobson RLM,Motlagh S,Quijano M,et al.Identification and characterization of toxicity of contaminants in pet food leading to an outbreak of renal toxicity in cats and dogs[J].Toxicol Sci,2008,106(1):251-262.
[3]Ogasawara H,Imaida K,Ishiwata H,et al.Urinary bladder carcinogenesis induced by melamine in F344 male rats:correlation between carcinogenicity and urolith formation[J].Carcinogenesis,1995,16(11):2773-2777.
[4]Filigenzi MS,Puschner B,Aston LS,et al.Diagnostic determination of melamine and related compounds in kidney tissue by liquid chromatography/tandemmass spectrometry[J].Agric Food Chem,2008,56(17):7593-7599.
[5]王绍安,覃卫国,刘永峰,等.强氯精用于游泳池水消毒的实验研究[J].中国氯碱,2002(7):31-33.
[6]闫欣,李洁,孙杰,等.反相高效液相色谱法分析三聚氰酸[J].环境化学,2011,30(2):567-568.
[7]吴彩梅,白洁,贾刚,等.液相色谱-串联质谱法测定鸡组织中的三聚氰胺和三聚氰酸[J].食品科学,2010,31(12):185-192.
[8]Desmarchelier A,Cuadra MG,Delatour T,et al.Simultaneous quantitative determination of melanine and cyanuric acid in cow’s milk and milk-based infant formula by liquid chromatographyelectrospray ionization tandem mass spectrometry[J].Agric Food Chem,2009,57(16):7186-7193.
[9]Tran BN,Okoniewski R,Storm R,et al.Use of methanol for the efficient extraction and analysis of melamine and cyanuric acid residues in dairy products and pet foods[J].Agric Food Chem,2010,58(1):101-107.
[10]Tang HW,Ng KM,Chui SY,et al.Analysis of melamine cyanurate in urine using matrix-assisted laser desorption/ionization mass spectrometry[J].Anal Chem,2009,81(9):3676-3682.
[11]Garber EA.Detection of melamine using commercial enzymelinked immunosorbent assay technology[J].J Food Prot,2008,71(3):590-594.
[12]李锋格,姚伟秦,苏敏,等.气相色谱法-质谱法快速测定牛奶中的三聚氰胺和三聚氰酸[J].色谱,2009,27(2):233-236.
[13]Tang HP,Lai SS,Lai AY,et al.Improved method for the determination of cyanuric acid in animal feed by GC-MS[J].Chromatographia,2009,70(9/10):1405-1410.
[14]Zhou T,Lucy CA.Separation of carboxylates by hydrophilic interaction liquid chromatography on titania[J].J Chromatogr A,2010,1217(1):82-88.
[15]Zhou T,Lucy CA.Hydrophilic interaction chromatography of nucleotides and their pathway intermediates on titania[J].J Chromatogr A,2010,1187(1/2):87-93.
Simultaneous determination of melamine and cyanuric acid by titania-based high performance liquid chromatography
LI Man,LI Rong,TAN Jin,JIANG Zi-tao*
(Tianjin Key Laboratory of Food Biotechnology,College of Biotechnology and Food Science,Tianjin University of Commerce,Tianjin 300134,China)
TS207.3
A
1002-0306(2012)13-0311-05
2011-10-20 *通讯联系人
李曼(1987-),女,硕士研究生,研究方向:食品添加剂。
国家自然科学基金项目(20875069);天津商业大学青年基金项目(090107)。
