乙型肝炎病毒X基因真核表达载体的构建
2012-09-11李晓斐
李晓斐
(青岛市传染病医院检验科 山东 青岛 266033)
乙型肝炎是一种高发传染病,乙型肝炎病毒(hepatitis B virus,HBV)感染后有5% ~10%的患者将发展为慢性肝炎(chronic hepatitis,CH),而这又是肝细胞癌(hepatocellular carcinoma,HCC)发生的高危险因素(几率比正常人大100倍)[1-2]。HBV基因具有4个开放式阅读框架(open reading frame,ORF),其中X基因是最小的开放式阅读框架,位于第1374~1835位核苷酸之间,全长462bp,编码154个氨基酸,为相对分子质量17000的X蛋白。目前认为HBx是一种多效转录激活因子,其本身不能与双链DNA直接结合,而是通过蛋白与蛋白之间的相互作用来行使功能。HBx基因是HBV复制和扩散所必需的基因,在乙肝慢性化和HCC的发生中具有重要作用[3-4]。
为了进一步研究X基因的生物学特性及其与HCC发生的关系,我们构建了HBV X基因的真核表达载体,并在真核细胞中进行表达。
材料和方法
一、材料
乙型肝炎患者血清采自青岛市传染病医院门诊及住院患者。DH5α由青岛市传染病医院检验科保存,HepG2细胞由青岛大学微生物实验室惠赠;pcDNA6(+)质粒购自Invitrogen公司;多聚乙烯酰胺(PEI)购自Sigma公司;dNTP、Taq酶、T4连接酶、EcoRⅠ、HindⅢ、100 bp DNA Marker购自上海生物工程公司;鼠抗人HBV X一抗、辣根过氧化物酶标记的羊抗鼠二抗购于晶美生物工程公司;Western Blot试剂盒购自 RPL公司;RPMI 1640和胎牛血清购自Gibco公司;引物由上海生物工程公司合成提供。
二、方法
1.真核表达载体pCDNA6(+)-HBx的构建
(1)血清HBV DNA提取:100 μL血清加入300 μL TES液混匀,60℃消化1 h,等体积苯酚/氯仿及氯仿抽提各1次,上清加入2倍体积无水乙醇及1/10体积3 mol/L醋酸钠(pH值4.8)沉淀病毒DNA,再以70%乙醇漂洗1次,并溶于20μL灭菌双蒸水中;(2)PCR扩增X基因:引物设计,扩增X基因片段。用 Primer引物设计软件进行软件设计,分别在上游引物和下游引物5'端添加限制性内切酶EcoRⅠ和HindⅢ酶切位点,根据载体校正读码框,保证终止密码正常读码,并于引物两端加入相应数目保护碱基。所设计引物如下:primer1:5'-GTA TAA GCT TAC CAT GGC TGC TAG GC-3';Primer 2:5'-TGA AGA ATT CGA TCT CAG TGG TGG T-3'。在25μL反应体系中加入2.5μL 10 × 反应缓冲液,0.5μL 1 mmol/L dNTP,HBV DNA 模板 1.0 μL,两引物各 0.5 μL,Taq 酶0.2 μL,MgCl 21.8 μL,补水至25 μL。反应条件:95℃预变性3 min,94℃变性60 s,56℃退火30 s,72℃延伸60 s,40个循环,72℃再延伸 10 min。进行琼脂糖凝胶电泳鉴定;(3)载体pcDNA6(+)-HBx构建:将 PCR产物与质粒pcDNA6(+)用EcoRⅠ和HindⅢ双酶切后,琼脂糖凝胶电泳,回收约500 bp目的基因片段与pcDNA6(+)质粒片段,用T4连接酶连接,构建载体pcDNA6(+)-HBx,转化感受态细胞DH5α,经EcoRⅠ和HindⅢ双酶切后,琼脂糖凝胶电泳证实含有目的基因片段,再经测序进一步鉴定。
2.重组质粒的表达及鉴定 (1)细胞培养:转染前16 h将HepG2细胞(5×104/mL)接种于6孔板中,置37℃、5%CO2,10%胎牛血清的RPMI 1640培养液培养;(2)细胞转染:设空白对照组、pcDNA6(+)空质粒对照组和 pcDNA6(+)-HBx实验组。吸弃细胞培养液,加入无血清16401 mL/孔,再加入C液100 μL。37℃培养箱放置1 h后,每孔加入 110 μL胎牛血清,37℃、5%CO2培养24h~48h,分别收集细胞和上清液;(3)Western Blot鉴定X蛋白表达取转染后48 h瞬时表达细胞,消化后于试管内离心,去上清,用PBS洗涤2次,加入十二烷基磺酸钠(SDS)上样缓冲液,100℃煮沸3 min,冷却后进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳及Western Blot检测表达蛋白。
3.Western Blot鉴定X蛋白表达 取转染后48h瞬时表达细胞,消化后于试管内离心,去上清,用 PBS洗涤2次,加入 SDS上样缓冲液,100℃煮沸3 min,冷却后进行SDS-PAGE电泳及Western Blot检测表达蛋白。
结 果
一、X基因真核载体的构建
1.PCR扩增X基因 PCR扩增后,电泳可见约500 bp处有一明显条带,见图1。
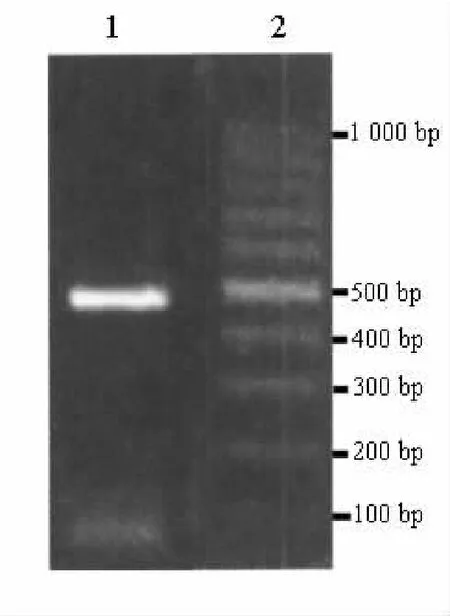
图1 HBx基因琼脂糖电泳结果
2.HBx基因表达载体 pcDNA6(+)-HBx的双酶切鉴定 重组质粒pcDNA6(+)-HBx经HindⅢ、EcoR I双酶切,出现2个片段,大片段与pcDNA6空质粒迁移率接近,小片段位于 DNA Mark约500 bp处,与X基因大小一致。测序结果表明,重组质粒pcDNA6(+)-HBx含有完整的正确的X基因片段。见图2。测序结果表明,重组质粒pcDNA6(+)-HBx含有完整的正确的X基因片段。
二、真核表达载体 pcDNA6(+)-HBx在HepG2细胞中的表达
将pcDNA6(+)-HBx和pcDNA6(+)分别转染HepG2细胞。转染后48 h做Western Blot,pcDNA6(+)-HBx转染组在17000处出现了阳性条带,而在pcDNA6(+)转染组与HepG2细胞对照组没有阳性条带。表明所构建的真核表达载体pcDNA6(+)-HBx可以在真核细胞内表达。见图3。

图2 HBx基因琼脂糖电泳结果

图3 HepG2细胞表达X蛋白Western Blot结果
讨 论
乙型肝炎是严重威胁人类健康的世界性传染病。据世界卫生组织(WHO)报道,我国乙型肝炎表面抗原阳性患者人数在1.2亿以上,每年因HBV感染致死的人数有100万左右[5]。HBx基因表达产物X蛋白具有多种生物功能,可通过与多种转录因子间的相互作用,发挥对多种病毒和细胞因子的激活作用,如原癌基因(c-myc、N-myc等)、转录因子(AP-1,NF-κB 等)、HBV 增强子等;也可激活RAS、Fas L、STAT-3及MAKP/JAK途径等,在HCC的发病过程中起核心作用[6-7]。X蛋白不仅是一种复杂的反式激活因子,而且可通过影响正常的细胞周期,干扰DNA的修复,调节肝细胞增殖、分化和凋亡等,其影响细胞凋亡[8-9]的作用是通过参与多条信号传导通路发挥的。关于X蛋白在细胞凋亡中的作用,目前有两种截然相反的观点,一种观点认为X蛋白可诱导细胞凋亡,另一种观点认为其可抑制细胞凋亡。Lee等[10]发现 HBx可以影响宿主的免疫功能。同时,由于HBV感染的宿主专一性很强,因此,大大限制了我们对肝炎、肝癌的研究和防治。利用现代分子生物学技术,我们便可将其转染到细胞中稳定、持续地表达,在体外细胞水平上了解并分析X基因的表达及其产物的生物学功能。我们的研究利用基因重组技术构建了HBx基因的真核表达载体pcDNA6(+)-HBx,并筛选到了稳定表达X蛋白的 HepG2细胞,表明 HBx基因表达载体pcDNA6(+)-HBx可在真核细胞中表达,为进一步研究HBx蛋白在肝癌发生中的致病作用奠定了前期实验基础。
HBX蛋白引发的促或抗凋亡作用可能因其作用不同阶段和不同细胞环境而异。现在的许多研究结果仅是针对不同的细胞株和不同的HBX分子伴侣,而且未能完全考虑到HBX在不同时空上的差异。加上多细胞机体的信号调节系统是复杂多样的,研究者也仅能在相对理想的条件下获得结果。因此,HBX蛋白对机体细胞凋亡的调节作用和确切机制还有待进一步实验研究。
[1]Beasley RP.Hepatitis B virus.The major etiology of hepatocellular carcinoma[J].Cancer,1988,61(10):1942-1956.
[2]Zentgraf H,Herrmann G,Klein R,et al.Mouse monoclonal antibody directed against hepatitis B virus X protein synthesized in Escherichia coli:detection of reactive antigen in liver cell carcinoma and chronic hepatitis[J].Oncology,1990,47(2):143-148.
[3]Chen HS,Kaneko S,Girones R,et al.The woodchuck hepatitis virus X gene is important for establishment of virus infection in woodchucks[J].J Virol,1993,67(3):1218-1226.
[4]Zoulim F,Saputelli J,Seeger C.Woodchuck hepatitis virus X protein is required for viral infection in vivo[J].J Virol,1994,68(3):2026-2030.
[5]Arbuthnot P,Kew M.Hepatitis B virus and hepatocellular carcinoma[J].Int J Exp Pathol,2001,82(2):77-100.
[6]Wang XZ,Chen XC,Chen YX,et al.Overexpression of HBxAg in hepatocellular carcinoma and its relationship with Fas/FasL system [J].World J Gastroenterol,2003,9(12):2671-2675.
[7]Diao J,Khine AA,Sarangi F,et al.X protein of hepatitis B virus inhibits Fas-mediated apoptosis and is associated with up-regulation of the SAPK/JNK pathway[J].J Biol Chem,2001,276(11):8328-8340.
[8]Balsano C,Billet O,Bennoun M,et al.Hepatitis B virus X gene product acts as a transactivator in vivo[J].J Hepatol,1994,21(1):103-109.
[9]Lee S,Tarn C,Wang WH,et al.Hepatitis B virus X protein differentially regulates cell cycle progressionin X-transforming versus nontransforming hepatocyte(AML12)cell lines[J].J Biol Chem,2002,277(10):8730-8740.
[10]Lee DK,Park SH,Yi Y,et al.The hepatitis B virus encoded oncoprotein pX amplifies TGF-beta family signaling through direct interaction with Smad 4:potential mechanism of hepatitis B virus-induced liver fibrosis[J].Genes Dev,2001,15(4):455-466.
