钯催化重氮盐的C—C偶联反应研究进展
2012-09-11魏文珑王利超常宏宏张聪霞
魏文珑, 王利超, 常宏宏, 张聪霞, 李 兴
(太原理工大学化学化工学院,山西 太原 030024)
引 言
作为C—C键构建的重要方法之一,C—C偶联反应[1]在现代有机合成中受到越来越广泛的关注。而重氮盐由于其简单易得的制备方法、较高的反应活性以及无需加碱等优点,在C—C偶联反应亲核试剂的选择中体现出明显的优势[2-10]。本文对重氮盐参与的钯催化C—C偶联反应进行了系列总结。
1 钯催化重氮盐的Suzuki偶联反应
20世纪80年代,Akira Suzuki和Norio Miyaura发现了在碱作用下钯催化的有机硼化物与卤代烃、磺酸酯等偶联生成新的C—C键的Suzuki-Miyaura交叉偶联反应[11],见式(1)和式(2)。由于其反应具有条件温和、原料低毒、易处理、高的区域选择性、立体选择性以及良好的官能团容忍性等优点而受到人们的广泛关注。
Saumitra Sengupta等[4]用 Pd(OAc)2作催化剂,在甲醇中回流反应1 h得到了偶联产物,收率为40% ~90%,且大部分产率在70%以上,见式(3)。
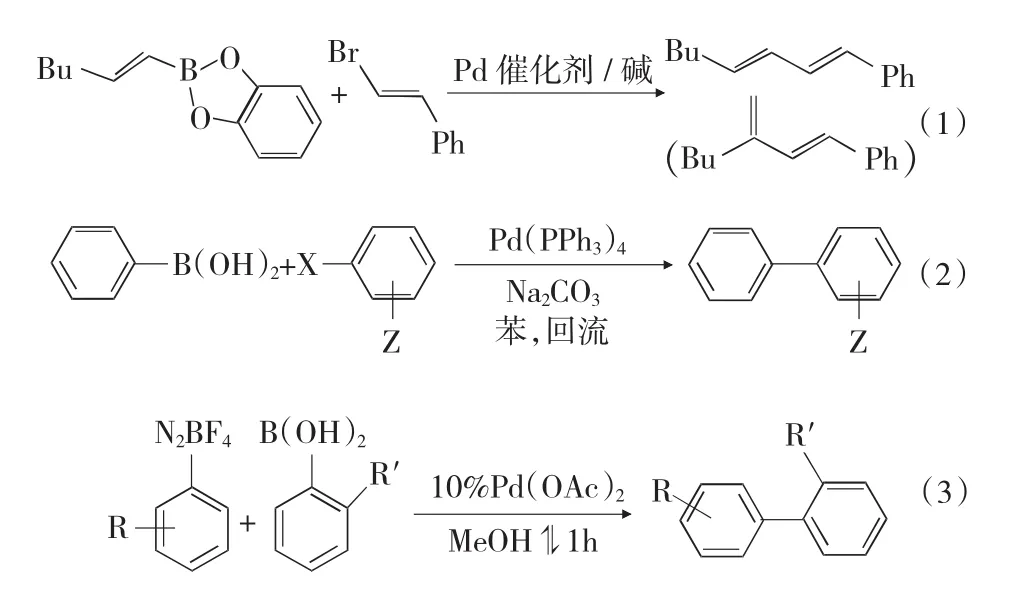
Dai M J等[12]报道了二茂铁结构的配体负载Pd催化剂催化的Suzuki偶联反应,见式(4)。苯硼酸和芳基氟硼酸钾在需氧条件下,在二氧六环中室温反应几小时到十几小时。反应结束后催化剂可以高产率的回收再利用。在一系列底物扩展中催化剂回收率均大于95%,很多高达100%,从而大大降低了反应成本。

Li Xing等[13]报道了氢氧化铝负载的纳米钯催化剂催化的Suzuki偶联反应。室温下,用简单易得的负载钯催化剂,在甲醇中反应几个小时,得到较高的产率,并且反应的广谱性非常好。同时,催化剂循 环使用3次以后,产率没有明显的下降。见式(5)。

2 钯催化重氮盐的Stille偶联反应
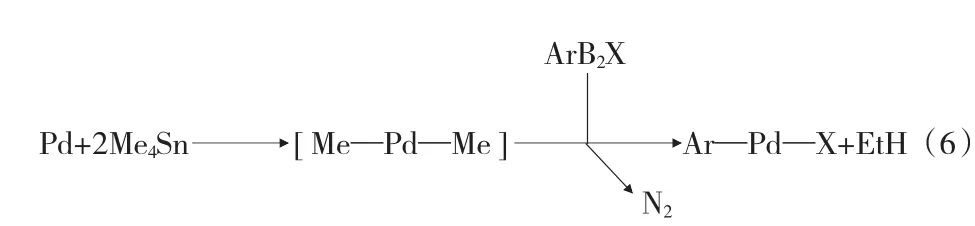
1983 年,Kiyoshi Kikukawa等[14]首次报道了重氮盐参与的Stille偶联反应,见式(6)。四氟化硼重氮盐或者六氟化磷重氮盐和四甲基锡在醋酸钯催化下反应2 h,可得到34% ~95%的产物。
2005年和2006年,Stefano Dughera等先后报道了重氮盐与三丁基芳基锡和芳基铟的偶联反应[15,16],并均在温和条件下得到理想产率,见式(7)、式(8)。

Francesco Babudri等报道了 Pd(PPh3)4或者Pd(OAc)2催化的重氮盐和烯烃的 Heck偶联反应[18],三氯化硼的二氯甲烷溶液逐滴加入烯烃中,

3 钯催化重氮盐的Heck偶联反应
Mizoroki-Heck交叉偶联反应分别于1971年和1972 年由 Mizoroki和 Heck报道[17]。随后,Heck 研究小组系统地研究了这一反应(见式9),并把它发展成为偶联反应的重要方法,具体包括芳基或烯基卤、三氟甲磺酸的芳基或烯基酯、碘盐或重氮盐在钯催化剂下与烯烃的偶联反应。

然后加入亲电试剂,0℃下反应,可得对应的偶联产物,见式(10)。
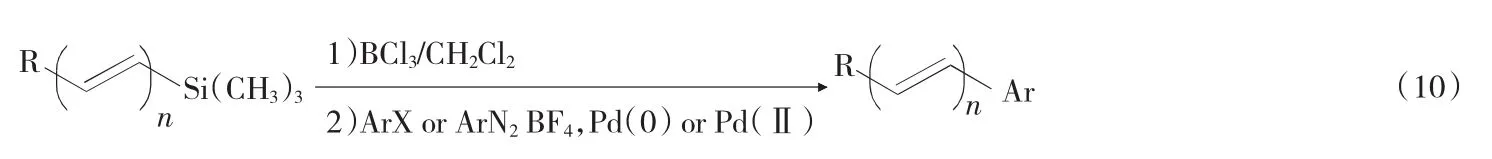
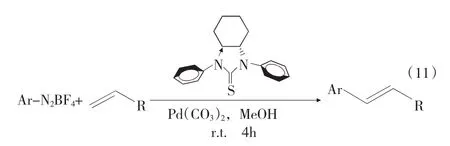
Dai Mingji等报道了醋酸钯和硫脲配体催化的Heck偶联反应[见式(11)],重氮盐和末端烯烃在甲醇中室温反应4 h,大部分产率80%以上[12]。
4 钯催化重氮盐的Sonagashira反应
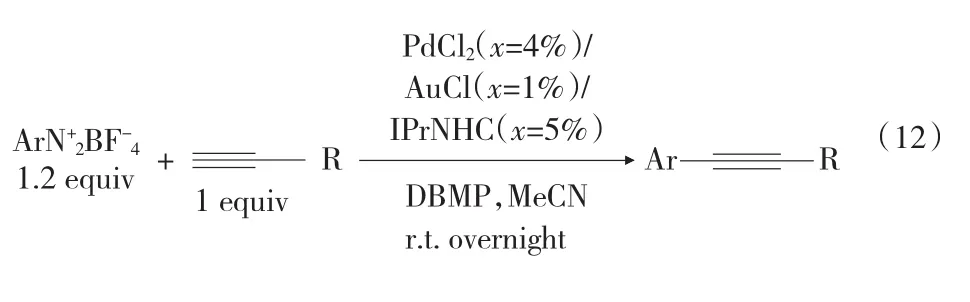
Sonogashira反应是Pd/Cu催化有机卤代物与末端炔烃的交叉偶联反应。2010年4月,Biswajit Panda[19]首次报道了重氮盐参与炔烃的Sonogashira交叉偶联反应见式(12),以氯化钯作催化剂,氯化亚铜为添加剂,甲基磷酸二丁酯为碱,四氟化硼重氮盐和芳香、脂肪末端炔烃作反应原料,获得了51% ~80%的产率,并且没有炔烃自偶联产物。随后,Giancarlo Fabrizi[20]报道了另一重氮盐的 Sonagashira反应[见第28页式(13)],以三苯基膦基氯化钯为催化剂,二乙胺为碱,在碘化亚铜和四丁基碘化铵存在下,室温反应仅0.5 h~2.0 h,得到了63% ~92%的产率。
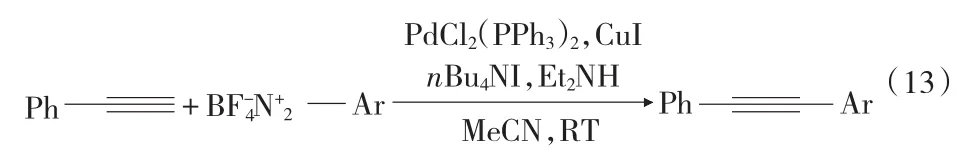
5 结语
以重氮盐为芳基化试剂的钯催化的C—C偶联反应已经得到了系统的发展,应用钯催化的重氮盐构建新的C—C键,已经成为现代有机合成中一种重要的方法。今后,C—C偶联反应研究领域的重点是开发出更多高效的新型催化剂体系,拓宽底物的适用范围,将C—C偶联反应更好地应用于现代有机合成中。
[1]Miyaura N,Suzuki A.Palladium-catalyzed cross-coupling reactions of organoboron compounds[J].Chem Rev,1995,95(7):2457-2483.
[2]Darses S,Jeffery T,Genêt JP,et al.Cross-coupling of arenediazonium tetrafluoroborates with arylboronic acids catalysed by palladium[J].Trtrahedron Lett,1996,37(22):3857-3860.
[3]Darses S,Jeffery T,Genêt J P,et al.Cross-coupling reactions of arenediazonium tetrafluoroborates with potassium aryl-or alkenyltrifluoroborates catalyzed by palladium[J].Trtrahedron Lett,1997,38(25):4393-4396.
[4]Sengupta S,Bhattacharyya S.Palladium-catalyzed crosscoupling of arenediazonium salts with arylboronic acids[J].JOrg Chem,1997,62(10):3405-3406.
[5]Darses S,Michaud G,Genêt J P.Potassium organotrifluoroborates:new partners in palladium-catalysed cross-coupling reactions[J].Eur J Org Chem,1999(8):1875-1883.
[6]Willis D M,Strongin R M.Palladium-catalyzed cross-coupling of aryldiazonium tetrafluoroborate salts with arylboronic esters[J].Tetrahedron Lett,2000,41(33):6271-6274.
[7]Andrus M B,Song C.Palladium-catalyzed cross-coupling of arenediazonium salts with arylboronic acids[J].Org Lett,2001,3(23):3761-3764.
[8]Kikukawa K,Nagira K,Terao N,et al.Reaction of diazonium salts with transition metals:Ⅱ:palladiumcatalyzed arylation of ethylene with arenediazonium salts[J].Bull Chem Soc Jpn,1979,52(9):2609-2610.
[9]Akiyama F,Miyazaki H,Kaneda K,et al.Arylation and alkylation of olefins by arylamines or hydrazines via the carbonnitrogen bond cleavage in the presence of palladium(II)salts[J].J Org Chem,1980,45(12):2359-2361.
[10]Kikukara K,Nagira K,Wada F,et al.Reaction of diazonium salts with transition metals:Ⅲ:palladium(0)-catalyzed arylation of unsaturated compounds with arenediazoium salts[J].Tetrahedron,1981,37(1):31-35.
[11]Miyaura N,Yamada K,Suzuki A.Sesquiterpenoids:27:X-ray crystallographic analysis of istanbulin-B,A 1-oxo[J].Tetrahedron Lett,1979,36(23):3437-3441.
[12]Dai M J,Liang B,Wang C H,et al.Synthesis of a novel C2-symmetric thiourea and its application in the Pd-catalyzed cross-coupling reactions with arenediazonium salts under aerobic conditions[J].Org Lett,2004,6(2):221-224.
[13]Li X,Yan X Y,Chang H H,et al.Suzuki-miyaura crosscouplings of arenediazonium tetrafluoroborate salts with arylboronic acids catalyzed by aluminium hydroxide-supported palladium nanoparticles[J].Org Biomol Chem,2012(10):495-497.
[14]Kiyoshi K,Fumio W.Reaction of diazonium salts with transition metals:8:palladium-catalyzed carbon-carbon coupling of arenediazonium salts with organotin compounds[J].J Org Chem,1983,48(8):1333-1336.
[15]Dughera S.Palladium-catalyzed cross-coupling reactions of dry arenediazonium o-benzenedisulfonimides with aryltin compounds[J].Synthesis,2006,2006:1117-1123.
[16]Barbero M,Cadamuro S,Dughera S,et al.Reactions of dry arenediazonium o-benzenedisulfonimides with triorganoindium compounds[J].Euor J Org Chem,2006,21:4884-4890.
[17]Heck R F.Acylation,methylation and carboxyalkylation of olefins by group VIII metal derivatives[J].JAm Chem Soc,1968,90(20):5518-5526.
[18]Babudri F,Farinola GM,Naso F,et al.A novel regio-and stereoselective formal cross-coupling reaction of unsaturated silanes with arenediazonium tetrafluoroborates[J].J Org Chem,2000,65(5):1554-1557.
[19]Panda B,Sarkar T K.Gold and palladium combined for the sonogashira-type cross-coupling of arenediazonium salts[J].Chem Comm,2010,46:3131-3133.
[20]Fabrizi G,Goggiamani A,Sferrazza A,et al.Sonogashira cross-coupling of arenediazonium salts[J].Angewandte Chemie,122(24):4161-4164.
