L-茶氨酸对黄羽肉鸡生产性能和免疫功能的影响
2012-09-11魏时来张石蕊侯德兴肖文军
文 慧 魏时来 张石蕊 侯德兴 肖文军 贺 喜*
(1.甘肃农业大学动物科技学院,兰州 730070;2.湖南农业大学饲料安全与高效利用教育部工程研究中心,长沙 410128;3.湖南农业大学国家植物功能成分利用工程技术研究中心,长沙 410128)
L-茶氨酸(L-theanine)是茶叶中的一种非蛋白质氨基酸,占茶叶中游离氨基酸总量的40%~70%[1]。多数学者认为茶氨酸是茶叶的特征氨基酸,目前除了在茶梅、山茶、油茶、蕈这4种天然植物中检测出其微量存在外,其他植物中尚未发现。L-茶氨酸系统命名为N-乙基-谷氨酰胺(N-ethyl-L-glutamine),属酰胺类化合物,由日本学者酒户弥二郎[2]1950年首次从绿茶中分离并命名的,结构式为 CH3CH2NH-CO(CH2)2-CH(NH2)-COOH。自然存在的茶氨酸均为L型,合成类茶氨酸多为D型和L型的混合物。因构型不同,D-茶氨酸在机体内代谢生物活性较低,L-茶氨酸生物活性较高[3]。自L-茶氨酸被分离鉴定以来,国内外对L-茶氨酸在动物体内的吸收与代谢途径及其对大脑神经系统机能、免疫机能等方面的作用等进行了系列研究[4],但很少有关L-茶氨酸在经济动物中的应用及其效果的研究。为此,本试验旨在探讨L-茶氨酸对黄羽肉鸡生产性能和免疫功能的影响,以期为L-茶氨酸在动物生产中的应用提供依据和参考。
1 材料与方法
1.1 试验动物及饲粮
试验动物选用1日龄(出雏)的黄羽肉鸡(新广快大型黄羽肉鸡,佛山市高明区新广农牧有限公司培育),参照 NRC(1994)和 NY/T 33—2004《鸡饲养标准》中黄羽肉鸡营养需要,以玉米、豆粕等为主要原料配制成基础饲粮,其组成及营养水平见表1。前期为粉料,后期为颗粒料。
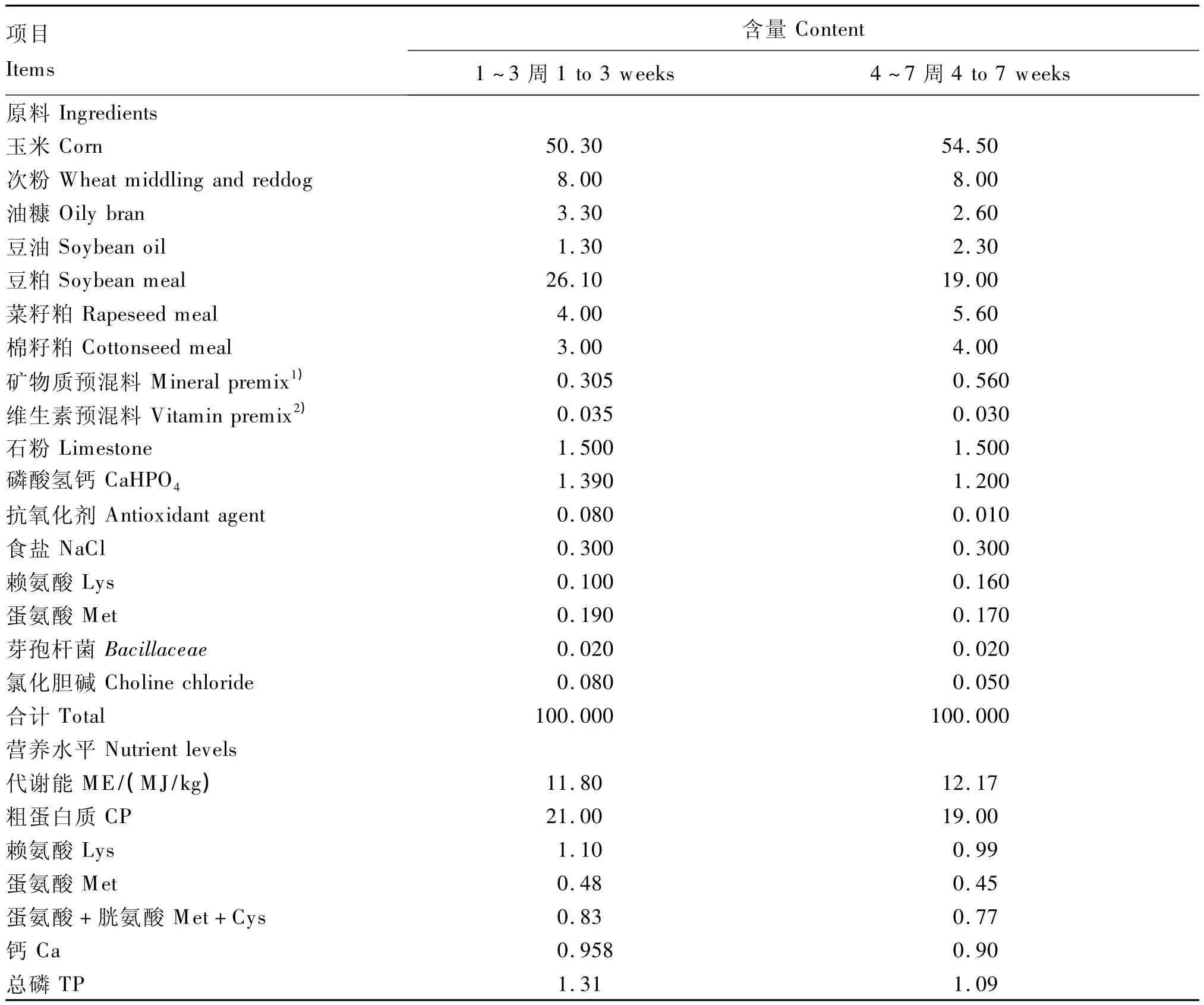
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of basal diets(air-dry basis) %
1.2 试验设计与饲养管理
将690只1日龄黄羽肉鸡随机分为6个处理,每个处理设5个重复,每个重复23只。6个处理分别为对照组(饲喂无抗生素基础饲粮)、抗生素组[饲喂在基础饲粮中添加10%硫酸黏杆菌素的饲粮,前期(1~3周)添加200 mg/kg、后期(4~7周)添加150 mg/kg]、4 个不同梯度(100、200、400和800 mg/kg)L-茶氨酸(L-茶氨酸含量98%)试验组。试验期为49 d,试验鸡自由采食,自由饮水,24 h光照。
1.3 样品采集及测定方法
1.3.1 生产性能
以重复为单位记录1~3周龄、4~7周龄和1~7周龄的采食量,试验21、49 d以重复为单位空腹称重、剩料称重,计算阶段体增重和料重比。
1.3.2 免疫器官指数
试验21、49 d时,颈部放血致死后屠宰鸡只,摘取脾脏、胸腺、法氏囊,拭去表面血污,称重,计算其占体重之比,即器官指数(g/kg)=器官重/活体重。
1.3.3 血清抗体水平及肠道分泌性免疫球蛋白A(sIgA)含量
抗牛血清白蛋白(BSA)抗体水平:试验14和28 d时,从各处理的每个重复随机选取黄羽肉鸡2只,腿肌注射0.5%BSA(用生理盐水溶解)2 mL,并做标记。于一免后第6、10、14天和二免后第5、9、13天从翅静脉采血,分离血清,-30℃冷冻保存,酶联免疫吸附试验(ELISA)法测定抗BSA抗体水平。
新城疫抗体滴度:新城疫疫苗一免在试验14 d,二免于28 d进行,均采用滴鼻点眼方式完成。于一免后第 6、10、14天和二免后第 5、9、13天从翅静脉采血,分离血清,-30℃冷冻保存,用红血球凝集法检测新城疫抗体滴度。
肠道sIgA含量:收集试验21、42 d各处理黄羽肉鸡空肠内容物,空肠内容物与生理盐水按1∶1稀释,混匀,3 000 r/min、4 ℃ 离心 15 min,分装上清液,-30℃保存备用,ELISA法测定空肠内容物中sIgA含量。
1.3.4 血清溶菌酶活性
试验21、28、35、42 和 49 d时,从每重复选取1只体重接近平均体重的黄羽肉鸡翅静脉采血,3 000 r/min、4℃离心10 min,分装血清,-30℃保存备用。用南京建成生物工程研究所生产的试剂盒测定血清溶菌酶的活性。
丹麦哥本哈根皇家图书馆收藏有14件敦煌汉文写卷,这批文献被编为16个号码,一份是道教写经,其余都是佛教写经,均为丹麦商人索雷森(Arthur Bollerup Sorensen)在1915年11月29日捐赠给图书馆的,推测捐赠者可能是从王道士那里得到的。德国巴伐利亚州立图书馆所藏的3件敦煌写本均为唐人写经,其中两件分别出自端方旧藏和张颐旧藏,另一件亦为中国某人所藏。瑞典远东古代博物馆现藏有1件敦煌文献。爱尔兰都柏林市切斯特·比蒂图书馆(Chester Beatty Library)于1955年购入4件敦煌汉文写卷和1件吐蕃文写卷,其中4件敦煌汉文写卷全部为《佛说无量寿宗要经》。
1.3.5 血清免疫细胞因子含量
试验21和49 d时,从每重复选取1只体重接近平均体重的黄羽肉鸡翅静脉采血,3 000 r/min、4℃离心10 min,分装血清,-30℃保存备用。ELISA法测定血清白细胞介素-2(IL-2)、白细胞介素 -4(IL-4)及干扰素 - γ(IFN-γ)含量。
1.4 数据处理
结果以平均值±标准误表示,数据处理与分析采用Excel 2007和SPSS 17.0进行,LSD多重比较,以P<0.05作为差异显著性判断标准。
2 结果
2.1 生产性能
从表2可知,除1~3周时,100 mg/kg L-茶氨酸组黄羽肉鸡的体增重显著低于其他各组(P<0.05)外,其他各阶段各组的采食量、体增重和料重比差异均不显著(P>0.05)。
2.2 免疫器官指数
从表3可知,整个试验期间,各组间黄羽肉鸡的脾脏指数和胸腺指数差异均不显著(P>0.05)。21 d时,100 mg/kg L-茶氨酸组黄羽肉鸡的法氏囊指数显著低于对照组和抗生素组(P<0.05),200和800 mg/kg L-茶氨酸组黄羽肉鸡的法氏囊指数显著低于对照组(P<0.05)。
2.3 血清抗体水平及肠道sIgA含量
2.3.1 血清抗BSA抗体水平
从表4可知,一免后第14天时,对照组、抗生素组、100和800 mg/kg L-茶氨酸组黄羽肉鸡的血清抗BSA抗体水平显著低于200、400 mg/kg L-茶氨酸组(P<0.05)。一免和二免后的其他各阶段各组间黄羽肉鸡的血清抗BSA抗体水平差异均不显著(P>0.05)。
2.3.2 血清新城疫抗体滴度
从表5可知,一免后第 6天时,100和200 mg/kg L-茶氨酸组黄羽肉鸡的血清新城疫抗体滴度显著低于对照组和抗生素组,400和800 mg/kg L-茶氨酸组显著低于抗生素组(P<0.05)。一免和二免后的其他各阶段各组间黄羽肉鸡的血清新城疫抗体滴度差异均不显著(P>0.05)。
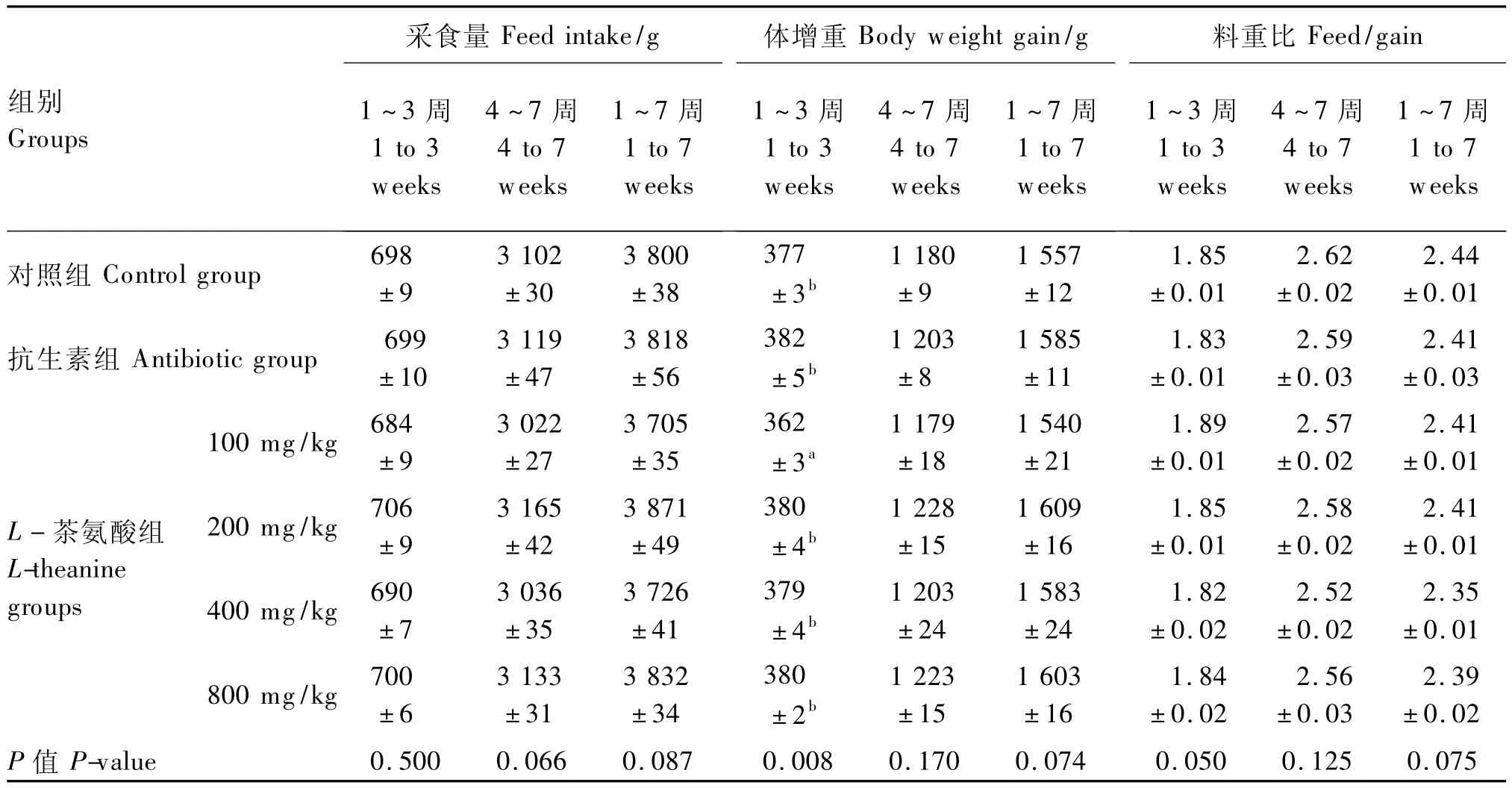
表2 不同L-茶氨酸水平对黄羽肉鸡生产性能的影响Table 2 Effects of different L-theanine levels on performance of yellow-feathered broilers
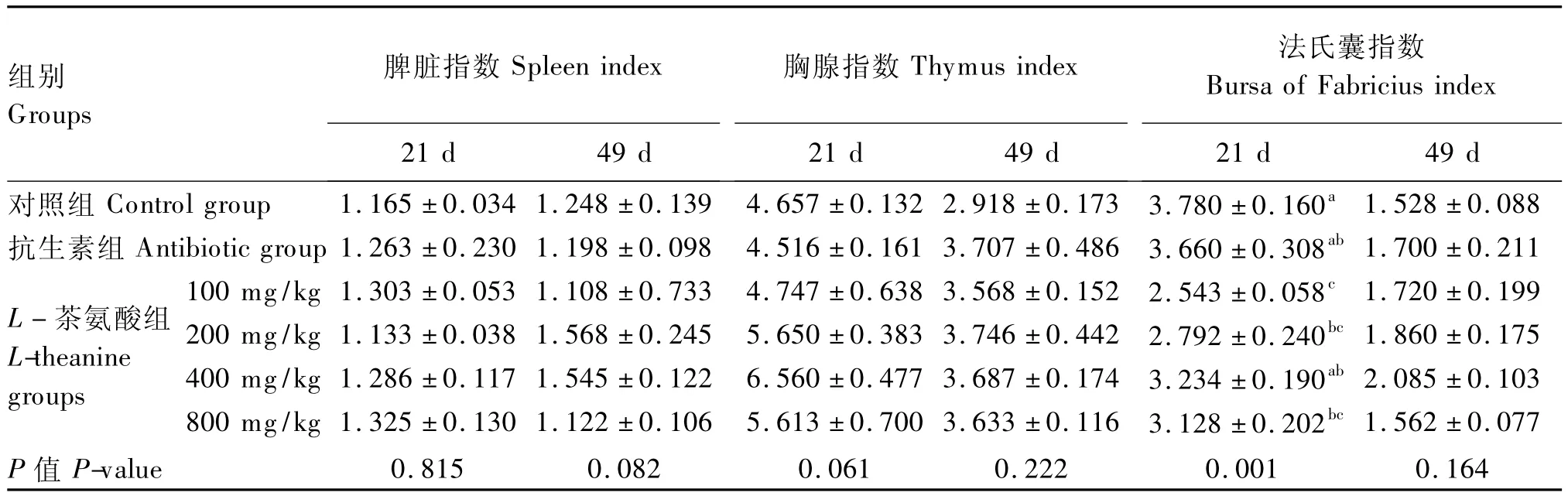
表3 不同L-茶氨酸水平对黄羽肉鸡免疫器官指数的影响Table 3 Effects of different L-theanine levels on immune organ indices in yellow-feathered broilers
2.3.3 肠道sIgA含量
从表6可知,21 d时,与对照组及抗生素组相比,200、400和800 mg/kg的L-茶氨酸均显著提高了黄羽肉鸡肠道sIgA的含量(P<0.05)。49 d时,各组间黄羽肉鸡的肠道sIgA含量差异不显著(P>0.05)。
2.4 血清溶菌酶活性
由表7可知,L-茶氨酸对黄羽肉鸡血清溶菌酶活性的影响不显著(P>0.05)。
2.5 血清免疫细胞因子含量
从表8可知,21 d时,L-茶氨酸对黄羽肉鸡血清IL-2含量的影响差异不显著(P>0.05),49 d时,100、200和400 mg/kg L-茶氨酸组黄羽肉鸡血清IL-2的含量均显著高于对照组(P<0.05),200和400 mg/kg L-茶氨酸组黄羽肉鸡血清IL-2的含量显著高于抗生素组(P<0.05)。L-茶氨酸对黄羽肉鸡血清 IL-4的含量影响差异不显著(P>0.05)。21 d时,各L-茶氨酸组黄羽肉鸡血清IFN-γ的含量均显著高于对照组(P<0.05),100和200 mg/kg L-茶氨酸组黄羽肉鸡血清IFN-γ的含量显著高于抗生素组(P<0.05),49 d时,200和400 mg/kg L-茶氨酸组黄羽肉鸡血清IFN-γ的含量显著高于对照组(P<0.05)。
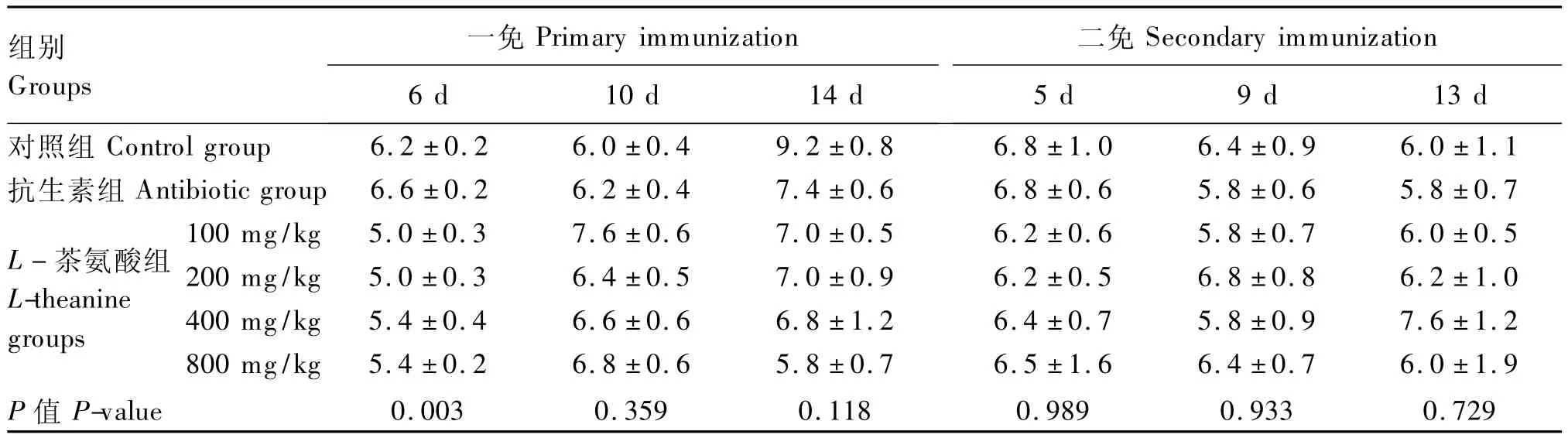
表5 不同L-茶氨酸水平对黄羽肉鸡血清新城疫抗体滴度的影响Table 5 Effects of different L-theanine levels on serum anti-NDV titers in yellow -feathered broilers
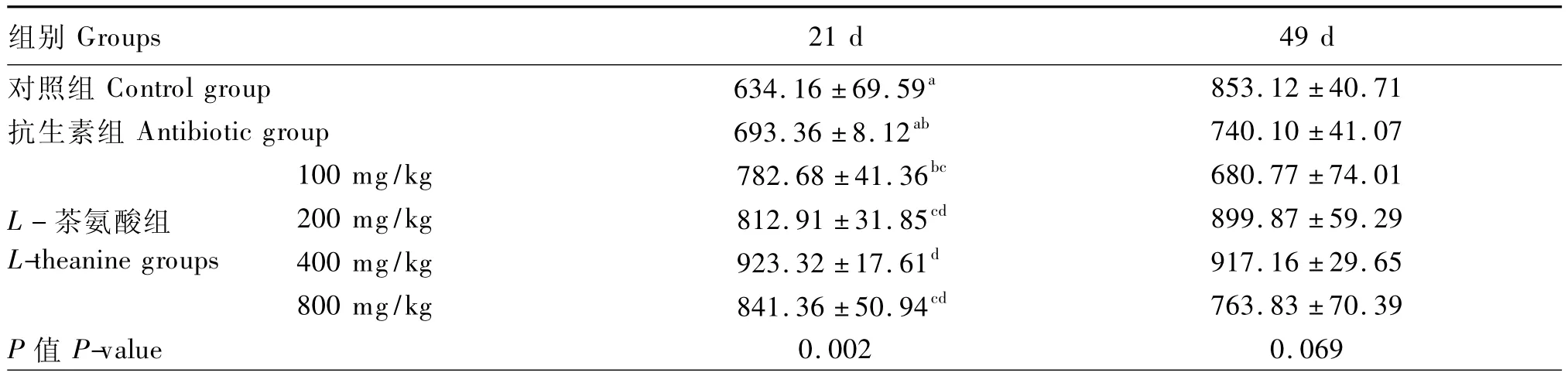
表6 不同L-茶氨酸水平对黄羽肉鸡肠道sIgA含量的影响Table 6 Effects of different L-theanine levels on intestinal sIgA content in yellow-feathered broilers pg/mL
3 讨论
L-茶氨酸是一种安全、无毒且具有多种生理功能的天然植物成分,广泛用于食品和保健品行业。L-茶氨酸的化学结构与谷氨酰胺相似,在大鼠肾脏内经酶促水解代谢为谷氨酸和乙胺[5-6],通过肠道刷状缘黏膜的钠偶联协同转运蛋白吸收[7],与谷氨酸类似。消化吸收后,L-茶氨酸可通过血液循环作用于各组织器官,还可通过血脑屏障最终作用于脑组织,调控机体功能,最后全部排出体外。大鼠灌喂L-茶氨酸1 h后,血清和肝中L-茶氨酸的浓度显著增加且达到峰值,此后随着时间延长,血清和肝中的L-茶氨酸浓度逐渐减少,L-茶氨酸还可以透过血脑屏障到达脑组织,脑组织内L-茶氨酸的浓度在灌喂5 h后达到峰值,在给药24 h后,L-茶氨酸在这些组织中完全消失[8]。此外,有研究报道,L-茶氨酸对ICR小鼠的体重、胸腺指数和脾脏指数均无显著影响,经急性毒性试验判定无毒[9]。本试验中,除21 d时100 mg/kg L-茶氨酸组黄羽肉鸡的体增重显著低于其他各组,100、200和800 mg/kg L-茶氨酸组法氏囊指数显著低于对照组外,其他各阶段L-茶氨酸对黄羽肉鸡的生产性能和免疫器官指数均无显著影响,与谭俊峰等[9]试验结果基本一致。因此,L-茶氨酸对黄羽肉鸡饲养后期而言是一种安全的添加剂。
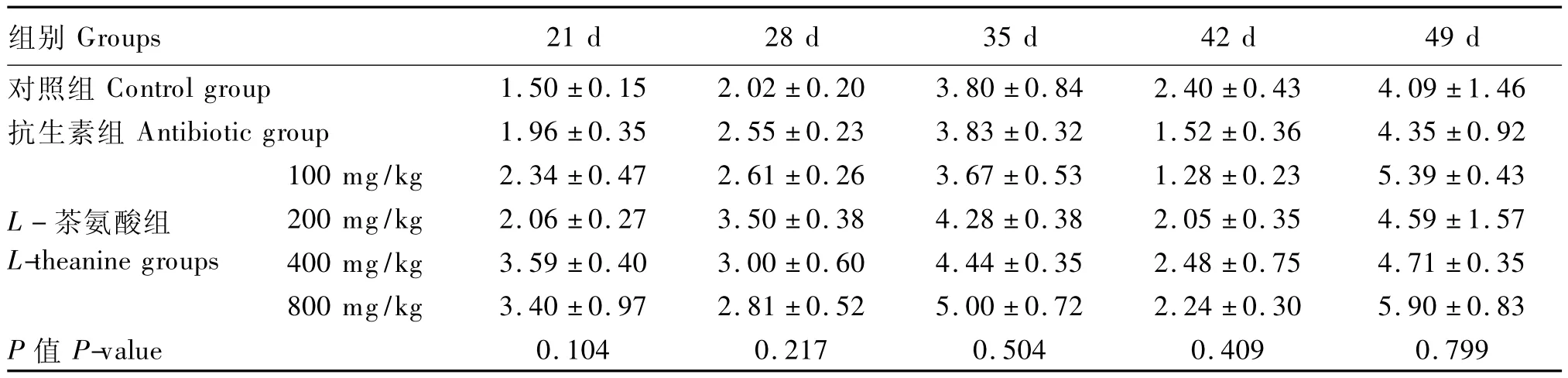
表7 不同L-茶氨酸水平对黄羽肉鸡血清溶菌酶活性的影响Table 7 Effects of different L-theanine levels on serum lysozyme activity in yellow-feathered broilers μg/mL
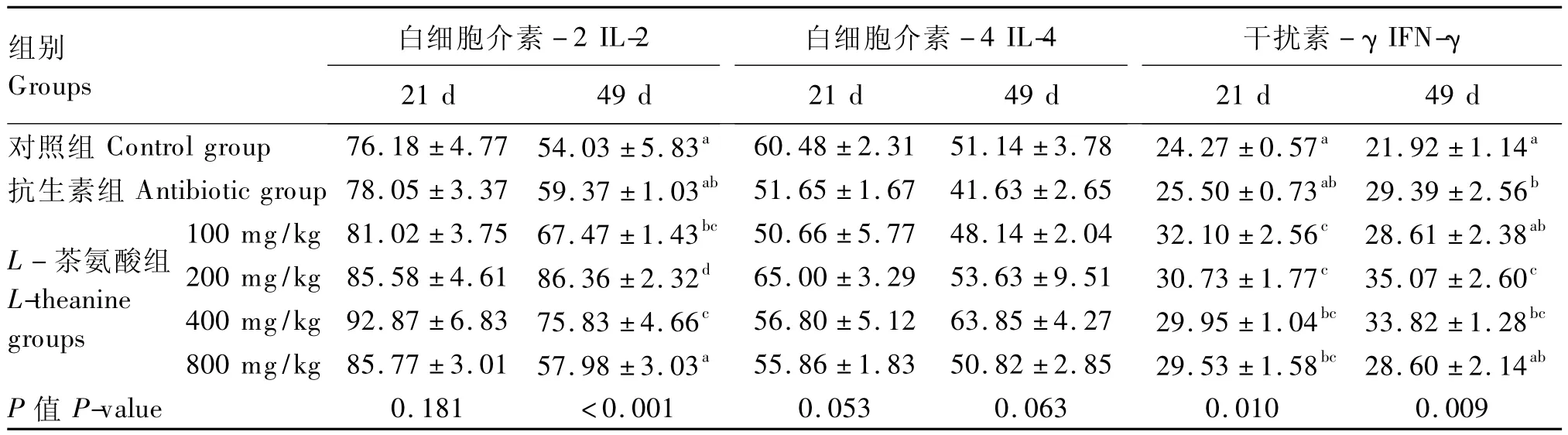
表8 不同L-茶氨酸水平对黄羽肉鸡血清免疫细胞因子含量的影响Table 8 Effects of different L-theanine levels on serum cytokine contents in yellow-feathered broilers pg/mL
抗体水平在一定程度上反映了机体的体液免疫能力。本试验中,一免后第 14天时,200、400 mg/kg L-茶氨酸组黄羽肉鸡的血清抗BSA抗体水平显著高于对照组、抗生素组、100和800 mg/kg L-茶氨酸组;但一免后第6天时,100和200 mg/kg L-茶氨酸组黄羽肉鸡的血清新城疫抗体滴度却显著低于对照组,其他各阶段L-茶氨酸对黄羽肉鸡的血清抗BSA抗体水平和新城疫抗体滴度均无显著影响,试验结果说明从全期来看L-茶氨酸可能不直接影响机体抗体产生,但短期可能有一定影响,其原因有待进一步研究。sIgA是肠黏膜分泌的主要的免疫球蛋白,能够中和和排斥病原体,防止细菌及病毒与黏膜结合,促进外分泌液中天然抗菌因子的分泌,调节黏膜免疫[10-11],而黏膜免疫是构成动物有机体抵抗病原微生物入侵的第一道免疫屏障。本试验中,L-茶氨酸显著提高了21 d时黄羽肉鸡肠道中sIgA含量,提示L-茶氨酸能增强生长前期黄羽肉鸡肠道的黏膜免疫功能,从而增强机体免疫力。
细胞因子是免疫细胞产生的一类能在细胞间传递信息、具有免疫调节和效应功能的小分子蛋白质。本试验中,49 d时100、200、400 mg/kg L-茶氨酸显著提高了黄羽肉鸡血清IL-2的含量,21和49 d时,200、400、800 mg/kg L - 茶氨酸显著提高了黄羽肉鸡血清IFN-γ的含量,但整个试验期L-茶氨酸对血清IL-4的含量影响均不显著。这种细胞因子的变化可能与L-茶氨酸对γδT细胞的影响有关系。γδT细胞是近20年来新认识的一种T细胞亚群,在机体内的分布与物种相关[12],在正常人及其他部分哺乳动物中γδT细胞占外周血比例较少(3% ~5%),但在家禽的外周血中γδT细胞所占比例达到50%以上,其表皮及相关黏膜上皮组织中也存在大量 γδT 细胞[12-14]。γδT细胞是T细胞依据其表面的抗原识别受体(TCR)而分为的两大类T淋巴细胞亚群之一,绝大多数表型为 CD3+CD4-CD8-,少数表型为 CD3+CD4+CD8-或 CD3+CD4-CD8+[15],TCR γδT 细胞与传统TCR αβT细胞有着截然不同的抗原识别途径,主要以主要组织相容性复合体(MHC)非限制方式识别各类未经加工处理的抗原,即γδT细胞可不经专职抗原提呈细胞(APC)呈递而通过其TCR直接识别多种细菌或细胞中存在的非蛋白质胺类、应激蛋白及非蛋白质磷酸有机物(如磷酸化碳水化合物)[16-17]的抗原成分。研究表明,一些来自细菌、可食用植物或茶叶中的烷基胺类物质可以激活人的先天性免疫反应[18]。L-茶氨酸在机体内可经酶促水解代谢为谷氨酸和乙胺,故L-茶氨酸或其水解产物就属于能迅速被γδT细胞直接识别的一类含烷基胺的非蛋白质生物活性物质,γδT细胞被这类物质激活后能产生 IL-2、IFN-γ等细胞因子参与免疫反应。据报道,茶饮料中一些功能成分(L-茶氨酸等)能促进γδT细胞增殖和IFN-γ分泌[19]。L-茶氨酸能显著提高荷瘤小鼠血清IL-2的含量[20],与本研究结果基本一致。但本试验中L-茶氨酸对黄羽肉鸡血清IL-4含量的影响不显著,其原因仍需进一步研究。茶叶中的L-茶氨酸或其代谢产物也可以调节人体γδT细胞功能,促进抗病菌、病毒、真菌和寄生虫感染的化学物质IFN-γ的分泌,从而增强人体的先天性免疫反应降低流感等疾病的发生[21]。L-茶氨酸属于茶类植物中所独有的天然非蛋白质功能性氨基酸,具有增强机体先天性免疫反应的功能,这种功能可为保障随时面临病原菌威胁处于亚健康状态的经济动物的健康养殖提供科学思路。
4 结论
①饲粮添加L-茶氨酸对黄羽肉鸡生长后期生产性能、免疫器官指数均无显著影响,说明其对黄羽肉鸡后期生长是安全的。
②L-茶氨酸可提高黄羽肉鸡生长前期肠道sIgA含量、后期血清IL-2的含量及全期血清IFN-γ的含量,从而增强其机体免疫功能。
[1]MUKAI T,HORIE H,GOTO T.Differences in free amino acids and total nitrogen contents among various prices of green tea[J].Tea Research Journal,1992,76:45-50.
[2]酒户弥二郎.L-茶氨酸的合成[J].日本农业化学会谈志,1950,23:262.
[3]DESAI M J,GILL M S,HSU W H,et al.Pharmacokinetics of theanine enantiomers in rats[J].Chirality,2005,17:154 -162.
[4]赵丹,王朝旭.茶氨酸的国内外研究现状[J].食品科学,2002,23:145 -147.
[5]UNNO T,SUZUKI Y,KAKUDA T,et al.Metabolism of theanine,gamma-glutamylethylamide,in rats[J].Journal of Agricultural and Food Chemistry,1999,47:1593-1596.
[6]TSUGE H,SANO S,HAYAKAWA T,et al.Theanine,gamma-glutamylethylamide,is metabolized by renal phosphate-independent glutaminase[J].Biochimica et Biophysica Acta,2003,1620:47 -53.
[7]KITAOKA S,HAYASHI H,YOKOGOSHI H,et al.Transmural potential changes associated with the in vitro absorption of theanine in the guinea pig intestine[J].Bioscience Biotechnology and Biochemistry,1996,60:1768 -1771.
[8]TERASHIMA T,TAKIDO J,YOKOGOSHI H.Timedependent changes of amino acids in the serum,liver,brain and urine of rats administered with theanine[J].Bioscience Biotechnology and Biochemistry,1999,63:615-618.
[9]谭俊峰,李靓,何普明,等.茶氨酸对ICR小鼠免疫功能的影响及其急性毒性初步研究[J].茶叶科学,2011,31:17 -21.
[10]张晓文,杨倩.禽流感灭活抗原与佐剂配合鼻腔免疫对鸡呼吸道抗体分泌细胞的影响[J].南京农业大学学报,2007,30:94 -98.
[11]MESTECKY J,MCGHEE J R.Immunoglobin A(IgA)molecular and celluar interactions involved in IgA biosynthesis and immune response[J].Advances in Immunology,1987,40:153 -245.
[12]SU C,JAKOBSEN I,GU X,et al.Diversity and evolution of T-cell receptor variable region genes in mammals and birds[J].Immunogenetics,1999,50:301 -308.
[13]BERNDT A,PIEPER J,METHNER U.Circulating gamma delta T cells in response to Salmonella enterica serovar enteritidis exposure in chickens[J].Infection and Immunity,2006,74:3967 -3978.
[14]BERNDT A,METHNER U.Gamma/delta T cell response of chickens after oral administration of attenuated and non-attenuated Salmonella typhimurium strains[J].Veterinary Immunology and Immunopathology,2001,78:143 -161.
[15]BRENNER M B,MCLEAN J,DIALYNAS D P,et al.Identification of a putative second T-cell receptor[J].Nature,1986,322:145 - 149.
[16]ARSTILA T P,TOIVANEN P,LASSILA O.Primed avian gamma delta T cells respond to mycobacterial antigens,but show no preference for the 65-kDa heat shock protein[J].Cellular Immunology,1995,162:74-79.
[17]MORITA C T,JIN C,SARIKONDA G,et al.Nonpeptide antigens,presentation mechanisms,and immunological memory of human gamma-delta T cells:discriminating friend from foe through the recognition of prenyl pyrophosphate antigens[J].Immunological Reviews,2007,215:59 -76.
[18]BUKOWSKI J F,MORITA C T,BRENNER M B.Human γδT cells recognize alkylamines derived from microbes,edible plants,and tea implications for innate immunity[J].Immunology,1999,11:57 - 65.
[19]KAMATH A B,WANG L S,DAS H,et al.Antigens in tea-beverage prime human γδT cells in vitro and in vivo for memory and nonmemory antibacterial cytokine responses[J].Proceedings of the National Academy of Sciences of the USA,2003,100:6009 -6014.
[20]袁太宁.湖北五峰绿茶体内外抗肿瘤作用研究[J].中外医疗,2009,28:84.
[21]BUKOWSKI J F,PERCIVAL S S.L-theanine intervention enhances human gammadelta T lymphocyte function[J].Nutrition Reviews,2008,66:96 - 102.
