薏仁多糖诱导人肺癌A549细胞凋亡
2012-09-11卢相义刘薇罗成
卢相义 刘薇 罗成
薏米(Coix)别名薏苡仁、米仁、薏珠子、菩提子、芑实、解蠡等,广泛地种植于亚洲、非洲和地中海周边的温暖地区。薏米的干燥成熟种仁叫做薏仁,薏仁质坚实,断面白色,粉性,气微,味微甜,薏仁通过烘烤或加工成薏米粉食用[1]。它含有丰富的蛋白质、脂肪、碳水化合物和多种氨基酸、维生素、无机盐,其中主要的功能性成分是脂肪和糖类。在传统的中药中作为一种利尿剂、抗炎药物、抗癌药物、镇痛剂和一种营养物[2]。研究表明薏仁中含有大量脂肪酸包括棕榈酸、硬脂酸、十八碳二烯酸、硬脂酸、油酸、亚油酸等[3],其中含有的寡聚糖具有DPPH自由基清除能力和脂质抗氧化能力[4]。薏仁组份已被证实具有降血糖[5],提高免疫力[6]等作用。本研究提取纯化得到薏仁多糖(CP-1)并作用于肺癌细胞A549细胞,观察其对肺癌细胞细胞凋亡作用的影响,为以后进一步研究CP-1的抗肿瘤作用提供参考。
1 材料与方法
1.1 材料与试剂 人非小细胞肺癌细胞A549细胞实验室自有;薏仁购于天津滨海新区TESCO超市;DEAE-52柱材料购于北京索莱宝公司;淀粉酶购于北京索莱宝公司;糖化酶购于北京索莱宝公司;透析袋购于上海欧韦达仪器科技有限公司;胎牛血清购于GIBCO公司;改良型PRMI-1640培养基购于美国Thermo公司;1%青链霉素混合液购于北京索莱宝公司;胰酶购于北京索莱宝公司;二甲基亚砜分析纯购于北京索莱宝公司;噻唑蓝购于北京索莱宝公司;多聚甲醛购于北京索莱宝公司;碘化丙啶购于美国Sigma公司;RNase Inhibitor购于美国MBI公司;总RNA提取试剂盒Qiagen购于德国Hilden公司;逆转录试剂盒Fermentas购于美国Hanover公司;其它试剂为分析纯。
1.2 仪器与设备 KW-1000DC恒温水浴锅购自金坛市瑞华仪器有限公司;高速离心机购自美国Thermo公司;SU-1510电子扫描显微镜购自日本日立公司;真空冷冻干燥机购自美国Thermo公司;BT-200B数显恒流泵购自上海沪西分析仪器有限公司;紫外全波长扫描仪购自美国Agilent公司;酶标仪购自美国Thermo公司;EOVS-FL倒置荧光显微镜购自德国AMG公司;Cytomics FC 500流式细胞仪购自美国Beckman Coulter公司;PCR仪购自德国biometra公司;DYY-8C电泳仪购自北京市六一仪器厂;凝胶成像系统购自Bio-RAD公司。
1.3 薏仁多糖的提取
1.3.1 薏仁多糖提取工艺流程 薏仁→筛选→粉碎→脱脂→提取→去淀粉→浓缩→醇沉→干燥→薏仁粗多糖。
1.3.2 薏仁多糖提取 挑选籽粒饱满、色泽洁白、无虫蛀、无霉斑的薏仁置于超微粉碎机中,粉碎过筛。使用索式提取器分别用乙酸乙酯和石油醚脱脂,置于三角瓶中,加pH 5.2的蒸馏水于水浴锅中90oC提取。提取后趁热离心,取上清液冷却,按20 IU/g加淀粉酶到提取液中水浴温度60oC、pH7.0去淀粉直到碘检不变色;接着按18 IU/g加糖化酶,在水浴温度 50oC-60oC,pH6.5条件下处理1 h。100oC水浴条件下灭活酶10 min,然后在3,000 r/min下离心10 min,上清液使用旋转蒸发仪浓缩,加入3倍浓缩液体积的95%冰乙醇沉淀过夜离心,真空冷冻干燥沉淀得薏仁粗多糖。
1.4 薏仁多糖的纯化
1.4.1 纯化工艺流程 薏仁粗多糖→脱蛋白→脱色→透析→DEAE-52柱层析→真空冷冻干燥→CP-1。
1.4.2 脱蛋白 将CP-1粉末溶解在蒸馏水中,加入1/3体积的Sevage试剂(氯仿:正丁醇=4:1),剧烈震荡30 min,3,000 r/min离心15 min,用分液漏斗除去有机相与水相之间的变形蛋白沉淀,水相重复上述操作,至没有变性蛋白沉淀产生。用3倍体积95%冰乙醇沉淀,离心,蒸馏水溶解。
1.4.3 脱色 CP-1水溶液以浓氨水调至pH8.0滴加30%H2O2至浅黄色,于50oC水浴保温2 h。
1.4.4 透析 用截留相对分子质量为8,000-14,000的透析袋流水透析2 d。透析后将CP-1浓缩,真空冷冻干燥。
1.4.5 DEAE-52离子交换柱层析 在DEAE-52纤维素层析柱中,加样 5 mL以0.1 mol/L NaCl溶液洗脱(恒流泵流速:1.8 r/min-2.1 r/min,5 mL/管)用苯酚硫酸法监测换位检测。将含有CP-1的部分合并,浓缩,真空冷冻干燥得CP-1纯品。苯酚硫酸法测得CP-1的糖含量为85%。
1.5 紫外全波长扫描 将CP-1溶解于甲醇中,于200 nm-800 nm区间进行紫外全波长扫描,观察在260 nm、280 nm处是否有吸收峰。
1.6 细胞培养 A549细胞培养于含10%胎牛血清和1%青链霉素混合液(100×)的改良型PRMI-1640培养液中,于培养箱(37oC、5%CO2)中恒温培养,取对数期细胞进行实验。
1.7 MTT检测对A549细胞存活率影响 对数期成长的细胞,胰酶消化,培养于96孔板中,加入不同浓度的CP-1(0、10 μg/mL、25 μg/mL、50 μg/mL、75 μg/mL、100 μg/mL、200 μg/mL和300 μg/mL)处理24 h、48 h、72 h之后避光加入5 mg/mL的MTT(噻唑蓝)20 μL 37oC培养4 h,3,000 r/min离心5 min,吸去上清,加入150 μL二甲基亚砜(DMSO)。用微型振荡器振荡混匀,酶标仪在570 nm下测定吸光度值,以DMSO处理的A549细胞作为阴性对照组细胞,计算细胞存活率,实验重复3次。

1.8 A549细胞凋亡形态的电子扫描显微镜观察 对数期A549细胞,不同浓度CP-1(200 μg/mL和300 μg/mL)处理24 h,用PBS缓冲液洗涤。按一定方向轻轻摇动。洗涤2次,每次5 min。用2.5%的戊二醛(pH为7.2-7.4)固定液,于4oC冰箱内固定1 h。PBS再次清洗样品,浓度依次为30%、50%、70%、80%、90%、100%的乙醇梯度脱水去除样品中水分,每次脱水时间5 min。将样品进行自然干燥,PBS洗3次,电子扫描显微镜观察细胞形态。
1.9 单细胞凝胶电泳测定A549细胞DNA损伤 A549细胞用冰冷的PBS洗1次,离心收集,用PBS重悬密度为1×106个/mL;将载玻片的磨砂面向上,40oC预热,将预热45oC的100 μL的0.5%正常熔点琼脂糖(NMA)铺于载玻片上,盖上干净的盖玻片,再置于4oC环境中10 min使NMA凝固。将10 μL细胞(约1×104个)和75 μL的0.7%低溶点琼脂糖LMA(在37oC下水浴加热至少20 min使之完全溶化)混合均匀。轻轻揭去盖玻片,迅速将含细胞的LMA滴到第1层琼脂糖上,立即盖上另一干净盖玻片,置4oC、10 min使第2层LMA凝固。第2层LMA凝固后,室温下移去盖玻片,滴加预热37oC的75 μL的0.7%低溶点琼脂糖LMA,盖上盖玻片4oC下凝固。移去盖玻片,将玻片置于平皿中,倒入预冷的细胞裂解液,4oC裂解1 h-2 h,取出载玻片用PBS漂洗。将载玻片置于水平电泳槽。倒入新配制的碱性电泳缓冲液(1 mmol/L EDTA,300 mmol/L NaOH),约覆过载玻片胶面0.25 cm左右,室温放置20 min-60 min。在电压25 V条件下,电泳20 min-30 min。电泳后将载玻片置于平皿内。加入0.4 mmol/L Tris-HCl(pH7.5)缓冲液,将载玻片没入,4oC中和3次,每次10 min,弃去Tris-HCl缓冲液,每个载玻片加20 μL的PI染液,盖上盖玻片,避光染色10 min。激光共聚焦显微镜543 nm波长的激发光观察。
1.10 细胞周期分析 A549细胞接种在六孔板中,不同浓度CP-1(0、100 μg/mL、200 μg/mL和300 μg/mL)处理,培养72 h后,胰酶消化,制成细胞悬液,800 r/min离心5 min,PBS洗两次,4%多聚甲醛固定4oC过夜。固定的细胞800 r/min离心8 min,弃上清,PBS洗2遍,加入终浓度为50 U/mL的RNase Inhibitor,37oC水浴30 min。加入终浓度为50 μg/mL的碘化丙啶(PI),室温避光40 min,过400目筛,流式细胞仪检测。
1.11 总RNA提取及半定量PCR(RT-PCR) A549细胞培养在培养皿中,分为空白组、CP-1组(200 μg/mL和300 μg/mL)。加CP-1后培养24 h。按总RNA提取试剂盒(Qiagen)说明书提取细胞总RNA,提取的总RNA结果通过1%的琼脂糖凝胶电泳鉴定。按逆转录试剂盒(Fermentas)逆转录得到cDNA。在50 μl的PCR反应体系中,加入2 μL的cDNA、5 μL的反应缓冲液(10×)、2 μL的dNTP及正、反向引物各1.5 μL、5 U的耐热多聚核酸聚合酶(Taq酶)、38 μL的去核酸双蒸水,置于PCR仪中,93oC预变性3 min后,进行35个循环(94oC变性30 s,58oC退火30 s,72oC延伸45 s),72oC延伸10 min。半胱天冬酶(caspase)-3、caspase-9和β-actin引物序列见表1。
1.12 统计学处理 采用 SPSS 17.0软件进行 t检验,数据采用Mean±SD表示。采用配对样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 紫外全波长扫描检测 紫外全波长扫描检测显示,在260 nm、280 nm处没有吸收峰,说明纯化后的CP-1中不含核酸和蛋白质。
2.2 薏仁多糖对A549细胞存活率的影响 使用MTT检测CP-1对肺癌细胞A549细胞存活率结果如图1,CP-1对细胞的抑制作用具有明显的作用时间和作用浓度依赖性。CP-1对A549细胞的存活率影响明显(P<0.05),当CP-1的浓度达到300 μg/mL时,作用72 h,细胞存活率为62.77%。
2.3 A549细胞扫描电子显微镜观察结果 扫描电子显微镜下观察经CP-1处理的A549细胞和空白组细胞。观察结果见图2。空白组细胞,细胞表面有小的绒毛,并有小的凸起;200 μg/mL CP-1组细胞核细胞凸起开始增加、变大,细胞表面形成褶皱;300 μg/mL CP-1组细胞表面形成大量凸起,并产生凋亡小体。
2.4 单细胞凝胶电泳(彗星实验)测定A549细胞DNA损伤 A549细胞的单细胞凝胶电泳在激光共聚焦显微镜下观察结果如图3(x,y: 50 μm),空白组无DNA损伤的细胞表现为一圆形荧光细胞核,200 μg/mL、300 μg/mL组的DNA彗星头很小,头长不超过5 μm,亮度高,慧尾近似椭圆形,在细胞后面形成长的拖尾,呈典型的凋亡彗星尾形状。结果显示CP-1作用后彗星尾距较空白组均增加,差异明显(P<0.05),且二者的改变与作用时间相关。
2.5 薏仁多糖诱引起S期阻滞 CP-1对A549细胞细胞周期的影响通过流式细胞仪检测,检测结果如图4。在浓度为300 μg/mL时CP-1造成A549细胞凋亡率较为明显(22.06%)。和空白组相比CP-1形成明显的S期阻滞。
2.6 RT-PCR测定caspase-3、caspase-9基因表达 不同浓度CP-1作用于A549细胞前后,A549细胞中的caspase-3、caspase-9基因表达的相对表达量(caspase-3/β-actin和caspase-9/β-actin)见图5A。不同浓度CP-1作用于A549细胞后caspase-3、caspase-9两种基因的相对表达量明显增加,两种基因表达的差异明显(P<0.05)(图 5B)。

表1 引物列表Tab 1 List of primers used in polymerase chain reactions
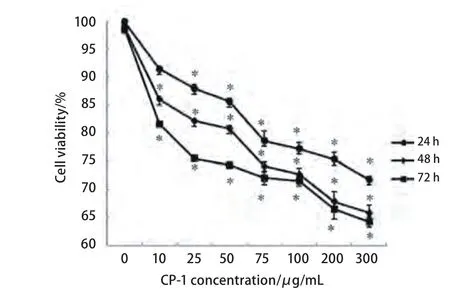
图1 CP-1对A549细胞存活率的影响(n=3)(*P<0.05)Fig 1 Effect of CP-1 on the cell viability of A549 cells (n=3) (*P<0.05)
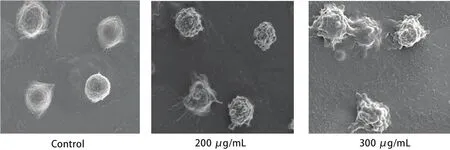
图2 A549细胞SEM观察结果Fig 2 The morphology of A549 cells observed by SEM
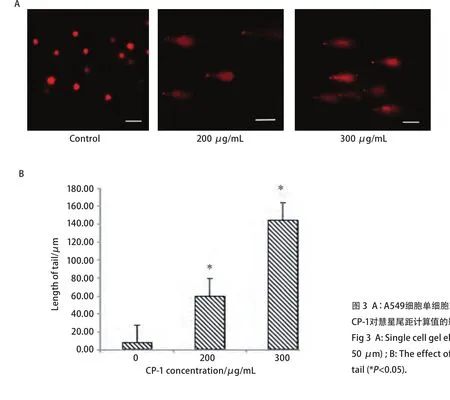
图3 A:A549细胞单细胞凝胶电泳图(比例棒:50 μM);B:CP-1对慧星尾距计算值的影响(*P<0.05)。Fig 3 A: Single cell gel electrophoresis of A549 (scale bar:50 μm) ; B: The effect of CP-1 in the calculation of comet tail (*P<0.05).
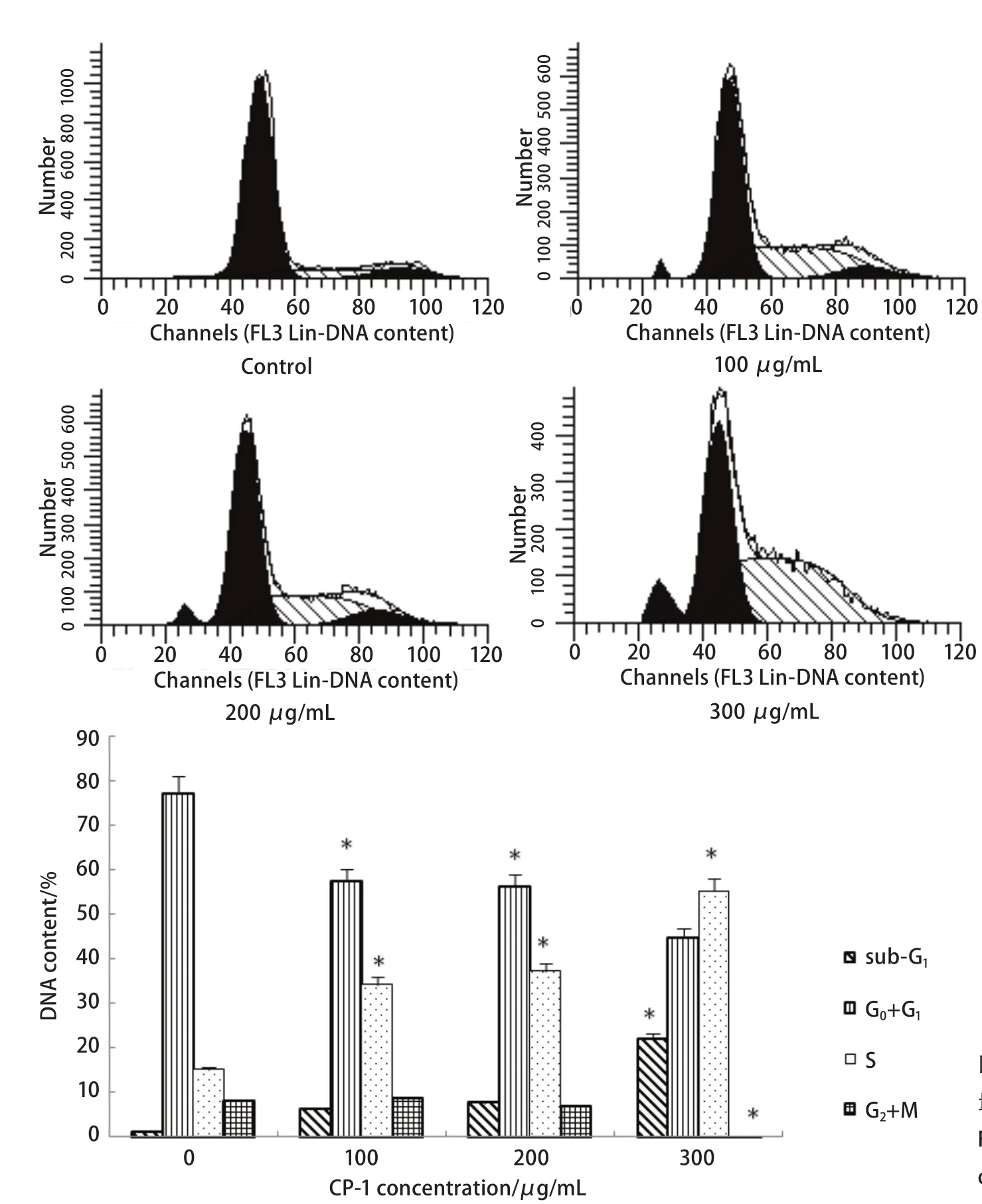
图4 ACP-1对A549细胞周期(DNA含量)的影响(*P<0.05)。Fig 4 Effect of CP-1 on the cell cycle of A549 cells (*P<0.05).
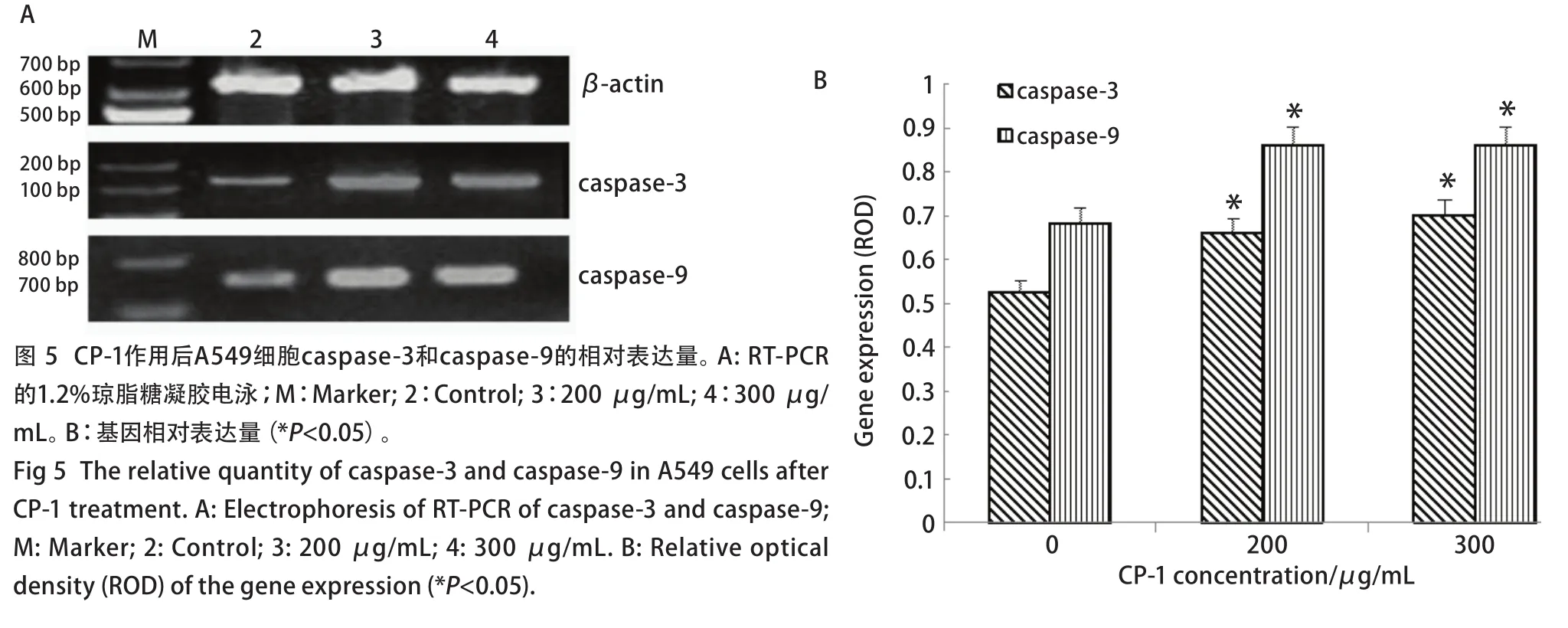
图5 CP-1作用后A549细胞caspase-3和caspase-9的相对表达量。A: RT-PCR的1.2%琼脂糖凝胶电泳;M:Marker; 2:Control; 3:200 μg/mL; 4:300 μg/mL。B:基因相对表达量(*P<0.05)。Fig 5 The relative quantity of caspase-3 and caspase-9 in A549 cells after CP-1 treatment. A: Electrophoresis of RT-PCR of caspase-3 and caspase-9;M: Marker; 2: Control; 3: 200 μg/mL; 4: 300 μg/mL. B: Relative optical density (ROD) of the gene expression (*P<0.05).
3 讨论
肺癌仍然是癌症死亡的主要原因,是当今社会主要的医疗、科学、社会问题[7],目前对于恶性肿瘤的临床治疗手段主要包括放疗、化疗或者手术切除等[8]。近年来传统中药的抗癌成分备受人们关注。多糖是植物、真菌、酵母等的主要组成部分,由于多糖的免疫调节机制和抗癌作用,现在多糖的研究引起了越来越多的关注[9]。一些多糖具有诱导癌细胞凋亡的作用,其中一些多糖表现出很明显的凋亡作用,但没副作用[10,11]。癌症的产生与发展是由于癌细胞的凋亡功能丧失,使之高增殖与扩散,研究细胞凋亡对于癌症的研究具有很大的意义[12]。
在本实验中,我们对CP-1组分诱导A549细胞凋亡的能力进行评估。细胞存活率实验(MTT检测)表明CP-1诱导A549细胞凋亡具有浓度和时间依赖性。在流式细胞仪检测过程中发现凋亡峰,并且造成细胞周期S期阻滞,该作用与一些其它多糖的作用类似,比如枸杞多糖[13]。通过扫描电镜我们观察到细胞凋亡前的特征图像,单细胞凝胶电泳实验表明CP-1处理后的彗星尾距拉长也清晰地表明CP-1组分可诱导凋亡。从分子机理研究,caspase家族在细胞凋亡信号传导过程中起核心作用[14,15]。caspase-3是凋亡过程中细胞凋亡的执行者,是多种死亡受体介导的凋亡途径的共同下游效应部分,能够降解细胞骨架蛋白和核蛋白[16,17]。caspase-3活化后,可酶解、切割特异性底物如DNA依赖性蛋白激酶、固醇调控元件结合蛋白等,通过改变其结构或影响特定信号分子而引起细胞凋亡[18]。caspase-9属于上游蛋白酶,起到活化caspase-3的作用。RT-PCR显示CP-1使caspase-3和caspase-9表达量提高,表明CP-1通过影响caspase-3和caspase-9表达导致A549的细胞凋亡。
从以上结果分析,CP-1能够降低A549细胞存活率,诱导细胞内的caspase-3、caspase-9基因相对表达量上调,进而诱导A549细胞产生凋亡小体,S期阻滞,表明薏仁多糖可以诱导人非小细胞肺癌细胞A549细胞凋亡。该研究为以后进一步研究CP-1的抗肿瘤作用提供了有价值的参考。
