MACC1和c-met在非小细胞肺癌中的表达及其预后价值
2012-09-11胡兴胜付曦文世民邹心怡刘雨松
胡兴胜 付曦 文世民 邹心怡 刘雨松
目前,肺癌死亡率已位居男、女性恶性肿瘤的第一位[1],全球每年至少有160万的新发病例和130万的死亡病例。非小细胞肺癌(non-small cell lung cancer, NSCLC)约占肺癌总数的80%。侵润和转移是恶性肿瘤最重要的生物学特征之一,亦是导致患者死亡的主要原因。肺癌易发生浸润和转移,其5年生存率低。目前有关肺癌浸润转移的机制尚不完全清楚,因此探索与肺癌浸润转移尤其是与预后相关的生物学指标,显得尤为重要。研究[2]表明,结肠癌转移相关基因1(metastasis-associated in colon cancer 1, MACC1)是2009年新发现的,能够预测肿瘤浸润转移及预后的新基因,其机制可能与调节肝细胞生长因子(hepatocyte growth factor,HGF,又称离散因子)及其受体c-met表达有关。为此,我们采用免疫组化联合检测了MACC1和c-met在NSCLC组织中的表达情况,并分析了它们与肺癌临床病理特征及预后的关系。
1 材料与方法
1.1 材料 选取2003年1月-2006年1月在川北医学院第二临床学院胸心外科手术标本103例和同期40例距离癌肿边缘5 cm以上的正常组织。所有患者术前均未化疗或放疗,有完整的临床资料和明确的术后病理诊断。其中男性77例,女性26例;<60岁51例,≥60岁52例;不吸烟42例,吸烟61例;鳞癌56例,腺癌47例;高分化15例,中分化68例,低分化20例;T1期+T2期78例,T3期+T4期25例;N0期70例,N1,2,3期33例;I期56例,II期12例,III期35例。
随访:所有患者每3个月均进行电话、门诊或住院部随访,随访开始于2003年4月,2011年1月结束,最短随访时间为4个月,最长随访时间为5年。期间有9例失访。
1.2 免疫组化检测MACC1和c-met蛋白的表达 手术标本经10%甲醛固定后,常规石蜡包埋、切片,厚度4 μm。采用免疫组化SP法(兔抗人MACC1多克隆抗体购自美国Sigma公司,兔抗人c-met多克隆抗体购自北京博奥森生物技术有限公司,免疫组化二抗SP试剂盒购自北京中杉生物公司)。用PBS液代替一抗作为阴性对照,按照试剂说明书进行操作。结果判断:所有切片均采用双盲法由两位病理科医师独立阅片。MACC1和c-met阳性表达均定位于细胞浆和细胞膜,呈浅黄色、黄色或棕黄色。随机选择10个高倍镜视野(400倍),每个视野连续计数100个细胞,共计数1,000个细胞。最后表达以染色强度和阳性细胞率的得分之和进行判断:无染色记0分,弱染色记1分,中等染色记2分,强染色记3分;阳性细胞率<5%记0分,5%-25%记1分,26%-50%记2分,>50%记3分。上述两项评分相加,<3分为阴性,≥3分为阳性。
1.3 统计学处理 采用SPSS 17.0统计学软件包分析。率的比较采用χ2检验或Fisher精确检验,单因素生存分析采用Kaplan-Meier生存曲线和Log-rank检验,多因素生存分析采用Cox多因素分析模型,以P<0.05为差异有统计学意义。
2 结果
2.1 MACC1和c-met蛋白检测结果 MACC1和c-met在癌组中的阳性率分别为67.9%(70/103)和68.9%(71/103),均明显高于其在正常组织中的表达5.0%(2/40)(χ2=45.684, P<0.001)和7.5%(3/40)(χ2=43.545, P<0.001)(图1)。
2.2 MACC1蛋白表达与肺癌临床病理特征的联系 统计学结果显示,MACC1和c-met的阳性率均随肿瘤分化程度的降低、T分期的增加、淋巴结转移和TNM分期的增加而增加(P<0.05),而与性别、年龄、吸烟及组织学类型等无关(P>0.05)(表1)。
2.3 MACC1和c-met相关性分析 经Spearman秩相关分析发现,在103例肺癌组织中MACC1和c-met的表达呈正相关,(r=0.403, P<0.001)。
2.4 生存分析 Kaplan-Meier生存曲线显示,MACC1阳性组的5年生存率为19.5%,明显低于阴性组的59.9%(χ2=15.093, P<0.001)。c-met阳性组5年生存率为25.4%,明显低于阴性组的48.3%(χ2=8.230, P=0.004)(图2)。
2.5 Cox多因素回归分析 Kaplan-Meier单因素分析发现,分化程度、T分期、淋巴结转移、TNM分期均与患者的生存期相关,故均纳入Cox多因素分析模型。Cox多因素分析结果显示,只有MACC1(P=0.026)和TNM分期(P=0.004)是肺癌患者的独立预后危险因素,其相对危险度(relative risk, RR)分别为2.178(95%CI:1.097-4.327)和2.230(95%CI: 1.288-3.860),而c-met表达不是患者的独立危险因素(P>0.05)(表2)。
3 讨论
MACC1基因定位于人染色体7p21.1。该基因是2009年由Stein等[2]发现并命名的一个新基因,研究表明它与结肠癌的浸润、转移及预后密切相关。Stein检测到MACC1在结肠癌组织中表达异常增高,在有远处转移病例中其表达明显高于无转移者,MACC1高表达者5年生存率为15%明显低于低表达者的80%,且是结肠癌转移的独立预后指标。后来研究表明,MACC1在胃癌[3]、肝癌[4-5]、卵巢癌[6]、肺腺癌[7]、前列腺癌[8]等腺癌组织及膀胱移行细胞癌[9]、脑胶质瘤[10]、小细胞肺癌细胞系[11]等非腺癌组织中过表达,并且与浸润转移密切相关。MACC1高表达的肝癌组患者总生存率和无病生存率均明显低于低表达组[5]。在肺癌的研究中,Chundong等[7]采用免疫组化方法对197例手术后肺腺癌患者研究结果显示,MACC1的阳性率为65.5%,在复发组中的阳性率为82.5%(33/40),明显高于非复发组的61.1%(96/157),阳性组无病生存期较阴性组降低。杨淑慧等[11]观察到MACC1在小细胞肺癌细胞系中高表达,用MACC1 siRNA抑制其表达后,能明显抑制癌细胞的增殖迁移能力。

图 1 免疫组化检测MACC1在肺鳞癌(A)和腺癌(B)以及c-met在肺鳞癌(C)和腺癌(D)组织中的阳性表达(×400)Fig 1 The positive expression of MACC1 in lung squamous carcinoma (A) and adenocarcinoma (B), c-met in lung squamous carcinoma (C) and adenocarcinoma (D) tissue by immunohistochemistry (×400).
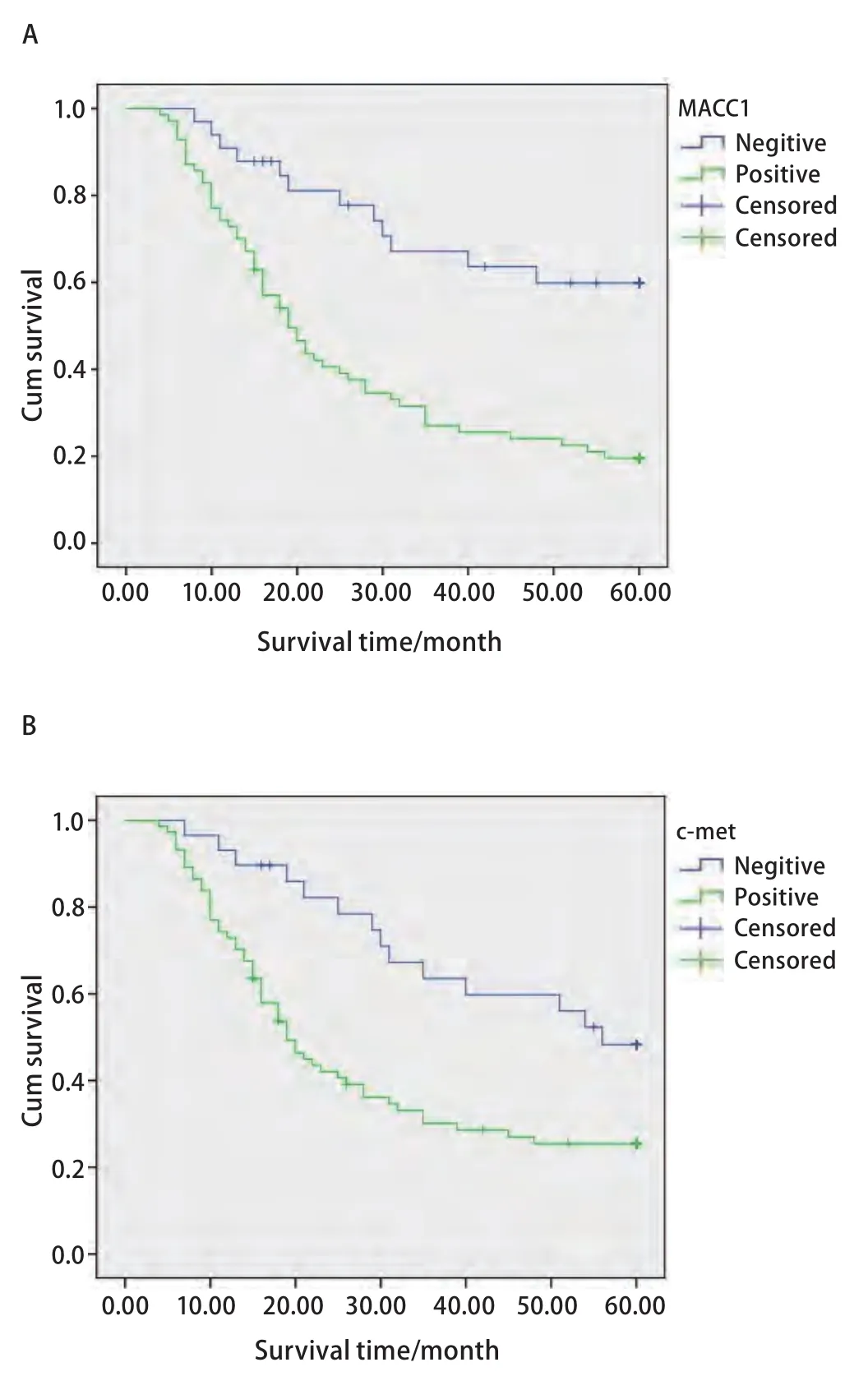
图 2 Kaplan-Meier累计生存时间曲线分析。A:MACC1表达阳性和阴性NSCLC患者;B:c-met表达阳性和阴性NSCLC患者。Fig 2 Kaplan-Meier cumulative survival time curves analysis. A: MACC1 positive and negative expression group of NSCLC petients; B: c-met positive and negative expression group of NSCLC petients; NSCLC:non-small cell lung cancer.
HGF是一种多功能细胞活性因子,具有很强的促有丝分裂作用,可诱导上皮细胞和成纤维细胞发生离散和运动。c-met是由原癌基因编码的HGF受体,主要在各种上皮细胞中表达。c-met编码了酪氨酸激酶,可调节肿瘤细胞侵袭性生长。HGF须与c-met受体结合方能发挥作用,两者结合导致两个酪氨酸残端在羧基端的磷酸化,引起一系列信号转导蛋白的酶促反应,从而调节相应的生物学行为,如细胞的运动等。正常的HGF/c-met通路在调节胚胎发育及组织损伤修复,而异常激活促进肿瘤的转移。HGF/c-met在多种恶性肿瘤组织中异常表达,并且与肿瘤的进展密切相关[12,13]。
MACC1是HGF/c-met信号通路的一个关键调节因子。c-met已被证明是MACC1的转录子靶点[2],它能通过扩增和(或)变异而不依赖与HGF的结合来激活。MACC1调节c-met的机制,可能是与c-met启动子区的SP1位点结合,从而激活c-met,促进其转录。HGF与c-met结合后,能启动下游3条信号途径:①磷脂酰肌醇3-激酶(PI3K);②信号转导及转录激活因子(STAT);③有丝分裂原活化激酶(MAPK)。这3条通路是细胞核内主要转录机构,从而促使肿瘤细胞增殖、运动、浸润、转移及血管生成等。另外,MACC1还可通过促进细胞外基质的降解、调节细胞骨架的结构[8]等方面,促进肿瘤的浸润和转移。
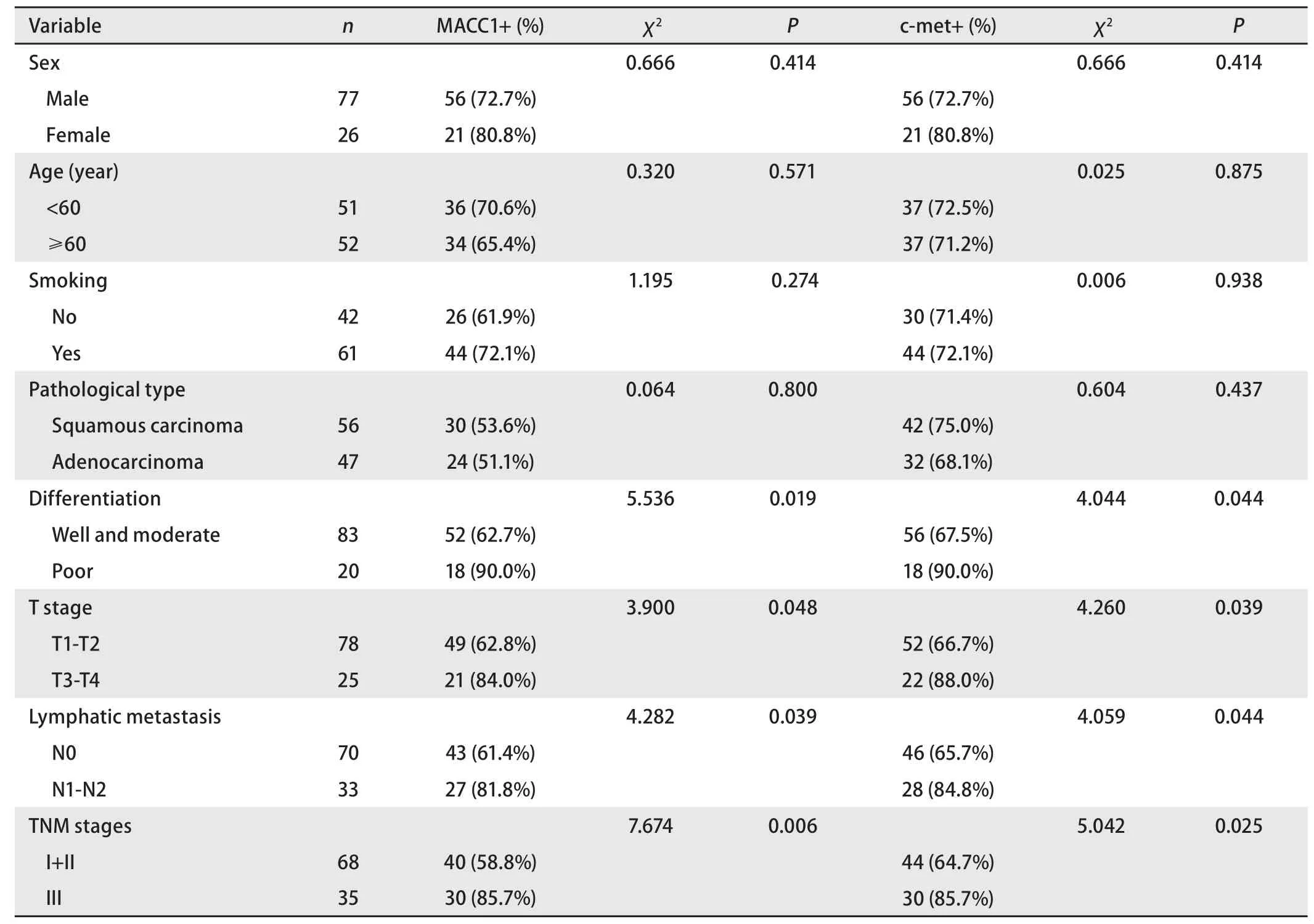
表 1 MACC1和c-met的表达与NSCLC的临床病理特征联系Tab 1 Correlation of MACC1 and c-met expression with clinicopathologic characteristics of NSCLC

表 2 Cox方程中的变量Tab 2 Cox variables in the Equation
本研究结果显示,MACC1和c-met蛋白均在NSCLC组织中呈过表达。虽然文献多数报道MACC1在腺癌中高表达,但本研究首次报道了其在鳞癌组织中的高表达,与腺癌组织中的表达无统计学差异,这可能与MACC1(与c-met相关)在肿瘤的发展过程中普遍起作用相关,这已在膀胱癌[9]、脑胶质瘤[10]、小细胞肺癌细胞系[11]非腺癌中得到证实。本研究表明,MACC1和c-met蛋白的异常表达均与肺癌的分化程度、T分期、淋巴结转移和TNM分期密切相关,与文献报道基本一致。T分期是肿瘤体积的大小和侵袭能力的综合反应,提示MACC1参与了肿瘤的分化、增殖、侵袭和转移等。本研究中MACC1和c-met的表达呈正相关(r=0.403, P<0.001),与Zhang[6]在卵巢癌中的报道(r=0.429, P=0.002)基本一致,但高于Qiu[5]在肝癌中对两者mRNA检测的报道(r=0.235, P=0.009),导致这种差异可能与肿瘤的类型、蛋白/mRNA检测的差异及样本量有关。本研究生存分析显示,MACC1和c-met的高表达均预示肺癌的不良预后,其中MACC1是肺癌独立预后危险因素,这与Stein[2]在结肠癌、Qiu[5]在肝癌及Chundong[7]在肺腺癌中的报道基本一致,提示MACC1可能是肿瘤的一个重要独立预后分子指标。
综上所述,我们的研究揭示了MACC1和c-met均在肺癌组织中过表达,其表达与肺癌的分化、浸润转移相关,它们对生存期均有一定的影响,而MACC1可能是肺癌的一项新的独立预后指标。因此,通过检测MACC1和c-met的表达可以更好的判断肺癌的恶性程度和预后,设想通过抑制MACC1的表达,抑制肿瘤浸润转移等,改善肺癌的不良预后,为肿瘤的靶向治疗提供新的靶点,为肿瘤发病机制的研究提供新的思路。
